解题方法
1 . 辉铜矿的主要成分是Cu2S,含较多的Fe2O3、SiO2杂质:软锰矿的主要成分是MnO2,含有较多的SiO2杂质。辉铜矿的湿法冶炼,目前国内外都处于探索之中。自氧化还原氨分离法是一种较为理想的湿法冶炼方法,工艺流程如图:
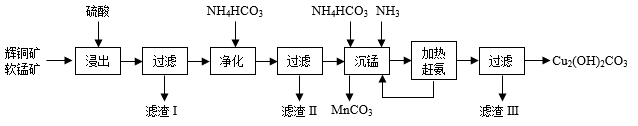
回答下列问题:
(1)将100g辉铜矿和40g98%的浓硫酸混合,在80~90℃条件下浸出2.5h,铜的浸出率随软锰矿用量的变化如表:
则浸出100g辉铜矿,软锰矿的最适宜用量为___________ g。
(2)“浸出”后的浸出液中含有CuSO4、MnSO4、Fe2(SO4)3等溶质,“滤渣I”中含有淡黄色固体单质,则“浸出”时产生淡黄色固体的化学方程式为___________ 。
(3)研究表明矿物中Fe2O3在“浸出”反应中起着重要的媒介作用,促进Cu2S与MnO2的溶解,其反应过程如下:
①Fe2O3+3H2SO4=Fe2(SO4) 3+3H2O;
②Cu2S+2Fe2(SO4)3=2CuSO2+4FeSO4+S↓
③___________ 。(写出反应的化学方程式)
(4)“滤渣II”的主要成分是___________ ;“沉锰”后,得到的深蓝色溶液中除NH 、H+外,还含有的阳离子为
、H+外,还含有的阳离子为___________ 。(写化学式)
(5)“滤液III”经结晶可得到(NH4)2SO4晶体。结晶时,当___________ 时,即可停止加热。
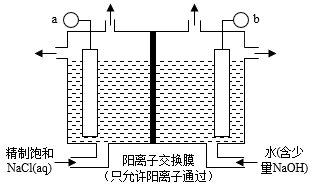
(6)如图表示用石墨作电极,在一定条件下电解饱和食盐水制取Cl2时,与a相连的电极上会产生少量的ClO2,产生ClO2电极反应式:___________ ;与b相连的电极上的电极反应式:___________ ;电解一段时间,当阴极产生标准状况下气体112mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为___________ mol。

回答下列问题:
(1)将100g辉铜矿和40g98%的浓硫酸混合,在80~90℃条件下浸出2.5h,铜的浸出率随软锰矿用量的变化如表:
| 锰矿用量(g) | 15 | 20 | 25 | 30 | 35 |
| 铜浸出率(%) | 84.0 | 86.5 | 89.8 | 89.9 | 89.9 |
则浸出100g辉铜矿,软锰矿的最适宜用量为
(2)“浸出”后的浸出液中含有CuSO4、MnSO4、Fe2(SO4)3等溶质,“滤渣I”中含有淡黄色固体单质,则“浸出”时产生淡黄色固体的化学方程式为
(3)研究表明矿物中Fe2O3在“浸出”反应中起着重要的媒介作用,促进Cu2S与MnO2的溶解,其反应过程如下:
①Fe2O3+3H2SO4=Fe2(SO4) 3+3H2O;
②Cu2S+2Fe2(SO4)3=2CuSO2+4FeSO4+S↓
③
(4)“滤渣II”的主要成分是
 、H+外,还含有的阳离子为
、H+外,还含有的阳离子为(5)“滤液III”经结晶可得到(NH4)2SO4晶体。结晶时,当
(6)如图表示用石墨作电极,在一定条件下电解饱和食盐水制取Cl2时,与a相连的电极上会产生少量的ClO2,产生ClO2电极反应式:

您最近一年使用:0次
2020高三·全国·专题练习
名校
解题方法
2 . K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]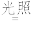 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为___ 。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。

①通入氮气的目的是____ 。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有____ 、___ 。
③为防止倒吸,停止实验时应进行的操作是___ 。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是____ 。
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]
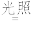 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为(2)某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。

①通入氮气的目的是
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有
③为防止倒吸,停止实验时应进行的操作是
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是
您最近一年使用:0次
2020-12-09更新
|
637次组卷
|
5卷引用:专题讲座(九) 热点实验综合探究 (精讲)-2021年高考化学一轮复习讲练测
(已下线)专题讲座(九) 热点实验综合探究 (精讲)-2021年高考化学一轮复习讲练测专题9 第一~三单元综合拔高练-高中化学必修第二册苏教版2019四川省绵阳市南山中学实验学校2022届高三上学学期开学考试化学试题四川省泸县第四中学2021-2022学年高三上学期第二次月考理综化学试题(已下线)专题讲座(十)化学实验设计与探究(练) — 2022年高考化学一轮复习讲练测(新教材新高考)
名校
解题方法
3 . A、B、C、D 四种可溶性盐,其阳离子分别是 Na+、Ba2+、Cu2+、Ag+中的某一种, 阴离子分别是 Cl-、 、
、 、
、 中的某一种。现做以下实验:
中的某一种。现做以下实验:
①将四种盐各取少量,分别溶于盛有 5mL 蒸馏水的四支试管中,只有 B 盐溶液呈蓝色。
②分别向 4 支试管中加入 2mL 稀盐酸,发现 A 盐溶液中产生白色沉淀,C 盐溶液中有较多气泡产生,而 D 盐溶液无明显现象。
(1)根据上述事实,推断这四种盐的化学式分别为:A_____ 、B_____ 、C_____ 、D_____ 。
(2)写出下列反应的离子方程式:
①C+D_____ ;
②B+D_____ ;
③C+HCl→气体_____ 。
 、
、 、
、 中的某一种。现做以下实验:
中的某一种。现做以下实验:①将四种盐各取少量,分别溶于盛有 5mL 蒸馏水的四支试管中,只有 B 盐溶液呈蓝色。
②分别向 4 支试管中加入 2mL 稀盐酸,发现 A 盐溶液中产生白色沉淀,C 盐溶液中有较多气泡产生,而 D 盐溶液无明显现象。
(1)根据上述事实,推断这四种盐的化学式分别为:A
(2)写出下列反应的离子方程式:
①C+D
②B+D
③C+HCl→气体
您最近一年使用:0次
2020-11-22更新
|
197次组卷
|
7卷引用:成都龙泉第二中学2019-2020学年高二上学期入学考试化学试题
4 . A~L为中学常见物质,A为绿色矿石,C为无色常见液体,D为金属氧化物,E为光合作用原料之一,F为硫酸,K、H分别为黑色固体单质C、Fe,J为红色金属单质,I的水溶液呈绿色,它们之间的转化关系如图所示。
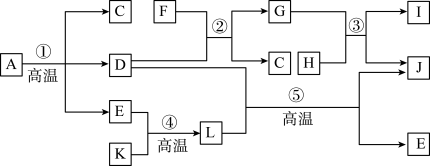
回答下列问题:
(1)A所含主要物质的化学式为__________ ,D 的化学式为__________ 。
(2)反应②的离子方程式为____________ 。
(3)写出反应③离子方程式并用单线桥法标明电子的转移:__________ 。
(4)反应⑤的现象为_______________ ,写出该反应的化学方程式并用双线桥法标明电子的转移且指出氧化剂、还原剂_________ 。

回答下列问题:
(1)A所含主要物质的化学式为
(2)反应②的离子方程式为
(3)写出反应③离子方程式并用单线桥法标明电子的转移:
(4)反应⑤的现象为
您最近一年使用:0次
5 . 有A、B、C、D、E、F六种化合物它们之间的反应关系如下。
①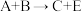
②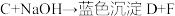
③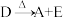
④
(1)写出A~F的化学式:A________ ;B________ ;C________ ;D________ ;E________ ;F________ 。
(2)写出反应①④的化学方程式。
①_______ ;
④_______ 。
①
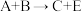
②
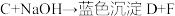
③
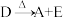
④

(1)写出A~F的化学式:A
(2)写出反应①④的化学方程式。
①
④
您最近一年使用:0次
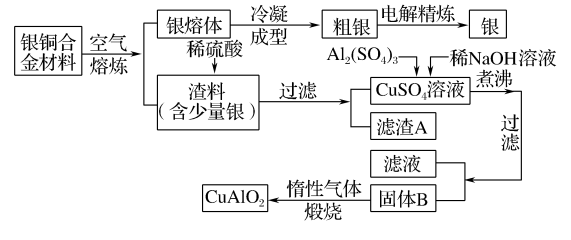
6 . 银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺流程如图所示:
【注: 和
和 ,开始分解的温度分别为
,开始分解的温度分别为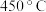 和
和 】
】
(1)固体B的组成为______ (填化学式);在生成固体B的过程中,需控制稀 溶液的加入量。若稀
溶液的加入量。若稀 溶液过量,则因过量引起的反应的离子方程式为
溶液过量,则因过量引起的反应的离子方程式为_____________ 。
(2)完成煅烧过程中一个反应的化学方程式:___ CuO+___ Al2O3
____ 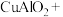
____  。
。
(3)若银铜合金中铜的质量分数为64%,理论上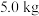 废料中的铜可完全转化为
废料中的铜可完全转化为_____ 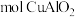 ,至少需要
,至少需要 的
的 溶液
溶液______ L。
(4) 溶液也可用于制备胆矾,其基本操作是
溶液也可用于制备胆矾,其基本操作是_____ 、_____ 、过滤、洗涤和干燥。

【注:
 和
和 ,开始分解的温度分别为
,开始分解的温度分别为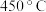 和
和 】
】(1)固体B的组成为
 溶液的加入量。若稀
溶液的加入量。若稀 溶液过量,则因过量引起的反应的离子方程式为
溶液过量,则因过量引起的反应的离子方程式为(2)完成煅烧过程中一个反应的化学方程式:

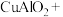
 。
。(3)若银铜合金中铜的质量分数为64%,理论上
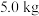 废料中的铜可完全转化为
废料中的铜可完全转化为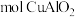 ,至少需要
,至少需要 的
的 溶液
溶液(4)
 溶液也可用于制备胆矾,其基本操作是
溶液也可用于制备胆矾,其基本操作是
您最近一年使用:0次
名校
解题方法
7 . 为探索工业上含铝、铁、铜的合金废料的再利用情况,某同学设计的回收利用方案如图所示:

(1)写出步骤①中涉及反应的离子方程式:___________ 。
(2)步骤②中通入过量 生成沉淀C的离子方程式为
生成沉淀C的离子方程式为___________ 。
(3)由滤渣 滤液
滤液 滤渣E,需加入的试剂的化学式为
滤渣E,需加入的试剂的化学式为_______ 反应的离子方程式为_____________ 。
(4)检验滤液D中是否含有 的最佳试剂为
的最佳试剂为___________ (填字母)。
A. 溶液 B.
溶液 B. 溶液 C.氯水 D.KSCN溶液
溶液 C.氯水 D.KSCN溶液
(5)试剂Y应是一种______ (填“氧化剂”或“还原剂”),它不可能是________ (填字母)。
A. B.铁单质 C.
B.铁单质 C.

(1)写出步骤①中涉及反应的离子方程式:
(2)步骤②中通入过量
 生成沉淀C的离子方程式为
生成沉淀C的离子方程式为(3)由滤渣
 滤液
滤液 滤渣E,需加入的试剂的化学式为
滤渣E,需加入的试剂的化学式为(4)检验滤液D中是否含有
 的最佳试剂为
的最佳试剂为A.
 溶液 B.
溶液 B. 溶液 C.氯水 D.KSCN溶液
溶液 C.氯水 D.KSCN溶液(5)试剂Y应是一种
A.
 B.铁单质 C.
B.铁单质 C.
您最近一年使用:0次
2020-10-02更新
|
588次组卷
|
4卷引用:人教版(2019)高一必修第一册 第三章 铁 金属材料 第二节 金属材料
10-11高三上·山西·期中
名校
解题方法
8 . 三氧化二铁和氧化亚铜( )都是红色粉末,常用作颜料。某校一化学实验小组通过实验探究一红色粉末的成分。探究过程如下:
)都是红色粉末,常用作颜料。某校一化学实验小组通过实验探究一红色粉末的成分。探究过程如下:
【查阅资料】 溶于稀硫酸生成Cu、
溶于稀硫酸生成Cu、 和
和 ,在空气中加热生成
,在空气中加热生成 。
。
【提出假设】假设1:红色粉末是 ;
;
假设2:红色粉末是 ;
;
假设3:红色粉末是 和
和 的混合物。
的混合物。
【设计实验】取少量该红色粉末加入足量稀硫酸中,再向所得溶液中滴加KSCN溶液。
(1)若假设1成立,则实验现象是____________________________________________________________ 。
(2)若滴加KSCN溶液,溶液不变红,则证明原红色粉末中一定不含 。你认为这种说法
。你认为这种说法_________ (填“合理”或“不合理”),理由是______________________________________________________ 。
(3)若红色粉末完全溶解,滴加KSCN溶液,溶液不变红,则证明原红色粉末是_____________________ ,写出发生反应的离子方程式:_________________________________________________________ 。
【探究延伸】
(4)经实验分析,确定该红色粉末为 和
和 的混合物。某实验小组欲用加热法测定该红色粉末中
的混合物。某实验小组欲用加热法测定该红色粉末中 的质量分数。取
的质量分数。取 红色粉末在空气中充分加热,待质量不再变化时,称其质量为
红色粉末在空气中充分加热,待质量不再变化时,称其质量为 ,则该红色粉末中
,则该红色粉末中 的质量分数为
的质量分数为_____________________ 。
 )都是红色粉末,常用作颜料。某校一化学实验小组通过实验探究一红色粉末的成分。探究过程如下:
)都是红色粉末,常用作颜料。某校一化学实验小组通过实验探究一红色粉末的成分。探究过程如下:【查阅资料】
 溶于稀硫酸生成Cu、
溶于稀硫酸生成Cu、 和
和 ,在空气中加热生成
,在空气中加热生成 。
。【提出假设】假设1:红色粉末是
 ;
;假设2:红色粉末是
 ;
;假设3:红色粉末是
 和
和 的混合物。
的混合物。【设计实验】取少量该红色粉末加入足量稀硫酸中,再向所得溶液中滴加KSCN溶液。
(1)若假设1成立,则实验现象是
(2)若滴加KSCN溶液,溶液不变红,则证明原红色粉末中一定不含
 。你认为这种说法
。你认为这种说法(3)若红色粉末完全溶解,滴加KSCN溶液,溶液不变红,则证明原红色粉末是
【探究延伸】
(4)经实验分析,确定该红色粉末为
 和
和 的混合物。某实验小组欲用加热法测定该红色粉末中
的混合物。某实验小组欲用加热法测定该红色粉末中 的质量分数。取
的质量分数。取 红色粉末在空气中充分加热,待质量不再变化时,称其质量为
红色粉末在空气中充分加热,待质量不再变化时,称其质量为 ,则该红色粉末中
,则该红色粉末中 的质量分数为
的质量分数为
您最近一年使用:0次
2020-10-02更新
|
499次组卷
|
7卷引用:2010年山西省山大附中高三上学期期中考试化学卷
(已下线)2010年山西省山大附中高三上学期期中考试化学卷【全国百强校】河北省张家口市第一中学2018-2019学年高一(衔接班)下学期开学考试化学试题高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 方法帮人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物 方法帮(已下线)第3章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)(已下线)2011届福建省泉州外国语中学高三上学期期中考试(理综)化学部分(已下线)2011-2012学年甘肃省天水一中高二第二学段测试化学试卷
9 . 有A、B、C、D、E、F六种化合物,它们之间的反应关系如下所示:
①A+B→C+E ②C + NaOH→蓝色沉淀D + F
③ D→A+E ④F + Ba(NO3)2 → 白色沉淀 + NaNO3
回答下列问题:
(1)写出它们的化学式:
A____________ ;B____________ ;C____________ ;
D____________ ;E____________ ;F____________ 。
(2)写出①④反应的离子方程式:
①_______ ;④_________ 。
①A+B→C+E ②C + NaOH→蓝色沉淀D + F
③ D→A+E ④F + Ba(NO3)2 → 白色沉淀 + NaNO3
回答下列问题:
(1)写出它们的化学式:
A
D
(2)写出①④反应的离子方程式:
①
您最近一年使用:0次
2020-09-23更新
|
1874次组卷
|
8卷引用:2012年鲁科版高中化学必修1 2.2电解质练习卷
20-21高一·全国·课时练习
解题方法
10 . 某课外小组对一些金属单质和化合物的性质进行研究。
(1)表为“铝与氯化铜溶液反应”实验报告的一部分:
①按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式):
置换反应________________________ ,化合反应________________________ .
②用石墨作电极,电解上述实验分离出的溶液,两极产生气泡,持续电解,在阴极附近的溶液中还可观察到的现象是________________________ ,解释此现象的离子方程式是____________________ 。
(2)探究氧化铜性质
①取A、B两支试管,向A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡.实验结论是___________________ 。
②用收集气体并测定其体积的方法探究试管A中反应的速率,必需的实验仪器有:______________ 。
(1)表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色 |
置换反应
②用石墨作电极,电解上述实验分离出的溶液,两极产生气泡,持续电解,在阴极附近的溶液中还可观察到的现象是
(2)探究氧化铜性质
①取A、B两支试管,向A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡.实验结论是
②用收集气体并测定其体积的方法探究试管A中反应的速率,必需的实验仪器有:
您最近一年使用:0次



