名校
解题方法
1 . 碳是地球上组成生命的最基本的元素之一。根据要求回答下列问题:
(1)碳原子的价电子排布式______________ ,核外有_________ 种不同运动状态的电子。
(2)碳可以形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。
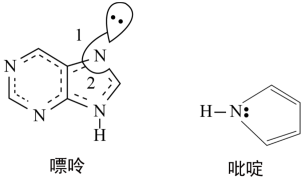
①嘌呤中所有元素的电负性由大到小的顺序__________________ 。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因__________________ 。
③吡啶结构中N原子的杂化方式__________________ 。
④分子中的大π键可用符号 表示,m代表形成大π键的原子数,n代表参与形成大π键的电子数。则吡啶结构中的大π键表示为
表示,m代表形成大π键的原子数,n代表参与形成大π键的电子数。则吡啶结构中的大π键表示为__________ 。
(3)碳元素能形成CO、CO2、H2CO3等多种无机化合物。
①二氧化碳的晶体叫做干冰,每个二氧化碳分子周围通常有__________ 个紧邻的分子。
②在CO转化成CO2的反应过程中,下列说法正确的是__________ 。
A.分子中孤电子对数不变 B.分子的极性发生变化
C.原子间成键方式发生改变 D.分子晶体的熔沸点升高
③H2CO3与H3PO4均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因_________ 。
(4)2017年,中外科学家团队共同合成了碳的一种新型同素异形体:T-碳。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代形成碳的一种新型三维立方晶体结构,如下图。已知T碳晶胞参数为a pm,阿伏伽德罗常数为NA,则T碳的密度的表达式为__________ g/cm3。(写出表达式即可)

(1)碳原子的价电子排布式
(2)碳可以形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。

①嘌呤中所有元素的电负性由大到小的顺序
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因
③吡啶结构中N原子的杂化方式
④分子中的大π键可用符号
 表示,m代表形成大π键的原子数,n代表参与形成大π键的电子数。则吡啶结构中的大π键表示为
表示,m代表形成大π键的原子数,n代表参与形成大π键的电子数。则吡啶结构中的大π键表示为(3)碳元素能形成CO、CO2、H2CO3等多种无机化合物。
①二氧化碳的晶体叫做干冰,每个二氧化碳分子周围通常有
②在CO转化成CO2的反应过程中,下列说法正确的是
A.分子中孤电子对数不变 B.分子的极性发生变化
C.原子间成键方式发生改变 D.分子晶体的熔沸点升高
③H2CO3与H3PO4均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因
(4)2017年,中外科学家团队共同合成了碳的一种新型同素异形体:T-碳。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代形成碳的一种新型三维立方晶体结构,如下图。已知T碳晶胞参数为a pm,阿伏伽德罗常数为NA,则T碳的密度的表达式为

您最近一年使用:0次
2018-04-14更新
|
365次组卷
|
2卷引用:江西省抚州市资溪县第一中学2022-2023学年高二下学期5月期中考试化学试题
解题方法
2 . 铁、钻、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题:
(1)基态钴原子的价电子排布式为________ ,铁、钴、镍的基态原子核外未成对电子数最少的是_____________
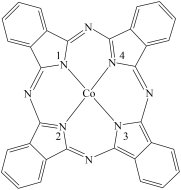
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是__________ (填1、2、3、4),三种非金属原子的电负性由大到小的顺序为____ (用相应的元素符号表示);碳原子的杂化轨道类型为_________
(3)Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO) x晶体属于_______ (填晶体类型),若配合物Fe(CO) x的中心原子价电子数与配体提供电子数之和为18,则x=_________
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO______ FeO(填“>”“<”或“=”),原因是___________________________ 。
(5)NiAs的晶胞结构如图所示:
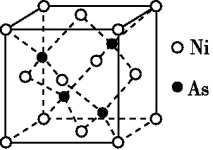
①镍离子的配位数为_________ 。
②若阿伏伽德罗常数的值为NA,晶体密度为pg.cm-1,则该晶胞中最近的离子之间的距离为_____ cm。(写出计算表达式)
(1)基态钴原子的价电子排布式为
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是

(3)Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO) x晶体属于
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO
(5)NiAs的晶胞结构如图所示:

①镍离子的配位数为
②若阿伏伽德罗常数的值为NA,晶体密度为pg.cm-1,则该晶胞中最近的离子之间的距离为
您最近一年使用:0次
名校
解题方法
3 . 图1是元素周期表的一部分,已知A、B、C、D、E、F、G都是周期表中的前四周期元素,它们在周期表中的位置如图1所示。
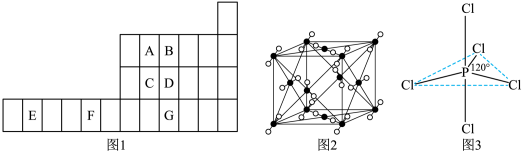
试回答下列问题:
(1)F元素基态原子的核外电子排布式为_________________ 。
(2)ABC的第一电离能由大到小的顺序______________ (用元素符号表示)。
(3)B元素单质分子中的_______ 个π键,与其互为等电子体的阴离子为____________________ 。
(4)图2为A元素某种氧化物的晶胞,其分子中心原子采用________ 杂化,每个分子周围有_____ 个分子与之距离相等且最近。若晶胞棱长为a pm,则该晶体密度的表达式为________ g·cm-3。
(5)G元素的氢化物分子的空间构型为________ ,其沸点与B元素的氢化物相比________ (填高或低),其原因是________ 。
(6)向CuSO4溶液中滴加入B 元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,请写出沉淀溶解的离子方程式________ 。
(7)知道B 的电负性大于氯,则B 与F2或Cl2形成的化合物水解,产物是否相同__________ ?(填“相同”或“不同”)。

试回答下列问题:
(1)F元素基态原子的核外电子排布式为
(2)ABC的第一电离能由大到小的顺序
(3)B元素单质分子中的
(4)图2为A元素某种氧化物的晶胞,其分子中心原子采用
(5)G元素的氢化物分子的空间构型为
(6)向CuSO4溶液中滴加入B 元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,请写出沉淀溶解的离子方程式
(7)知道B 的电负性大于氯,则B 与F2或Cl2形成的化合物水解,产物是否相同
您最近一年使用:0次
名校
解题方法
4 . 氮族元素和硼族元素在生产生活中有很重要的地位。
(1)写出硼族元素Ga的基态原子核外电子排布式_________________ 。
(2)NF3的分子构型为__________ ,NO3-的空间构型为______ ,1molNO3-中含有的σ键的数目为:_________ 。
(3)氮化硼的立方结晶的变体被认为是已知的最硬的物质。BN的晶体结构与金刚石相似,其中B原子的杂化方式________ 。
(4)元素第一电离能的大小:As______ (填“”或“=”)Ga,原因是__________ 。
(5)相同条件下,在水中的溶解度:NH3(填“”或“=”)PH3,原因是__________ 。
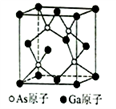
(6)已知立方砷化镓晶胞的结构如图所示,其晶胞边长为cpm。则砷化镓的化学式为________ ,晶胞中As原子和它最近的Ga原子之间的距离为_______ pm(用含c的式子表示),砷化镓的密度为_______ g/cm3(设NA为阿伏伽德罗常数的值,用含c、NA的式子表示,原子量:Ga-70,As-75)。
(1)写出硼族元素Ga的基态原子核外电子排布式
(2)NF3的分子构型为
(3)氮化硼的立方结晶的变体被认为是已知的最硬的物质。BN的晶体结构与金刚石相似,其中B原子的杂化方式
(4)元素第一电离能的大小:As
(5)相同条件下,在水中的溶解度:NH3(填“”或“=”)PH3,原因是
(6)已知立方砷化镓晶胞的结构如图所示,其晶胞边长为cpm。则砷化镓的化学式为

您最近一年使用:0次
名校
解题方法
5 . [化学一选修3:物质结构与性质]
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为________ ,结构中有 ___ 种不同形状的电子云。
(2)MgO的熔点高于CuO的原因是__________________________
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是_____________________
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为_____________________
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为______ ,BF4-的空间构型为_________________ 。
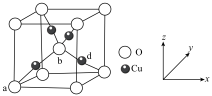
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为____________ ,已知该晶体的密度为ρg/cm3,NA是阿伏伽德罗常数值,则晶胞参数为 _______________ cm(列出计算式即可)。
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为
(2)MgO的熔点高于CuO的原因是
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为

您最近一年使用:0次
2018-01-12更新
|
552次组卷
|
4卷引用:江西省兴国中学2019届高三下学期第二次综合测试(二)理科综合化学试题
名校
6 . 不同元素的原子在分子内吸引电子的能力大小可用一定数值 x 来表示,若 x 越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷的一方。
下面是某些短周期元素的 x 值:
(1)通过分析 x 值变化规律,确定Al、N的 x 值范围:________ < x (Al)<________
(2)推测 x 值与原子半径关系是________ ,根据短周期元素的 x 值变化特点,体现了元素性质的________ 变化规律。
(3)某有机化合物结构式为: ,其中SO键中你认为共用电子对偏向谁?
,其中SO键中你认为共用电子对偏向谁?________ (写原子名称)。
(4)经验规律告诉我们:当成键的两原子相应元素的 x 差值(Δ x )即 x >1.7时,一般为离子键;当Δ x <1.7时,一般为共价键。试推断AlF 3 中化学键类型是________ 。
(5)预测元素周期表中, x 值最小的元素的位置:_______ (放射性元素除外)。
下面是某些短周期元素的 x 值:
| 元素符号 | Li | Be | B | C | N | F |
| x 值 | 0.98 | 1.57 | 2.04 | 2.25 | 2.89 | 3.98 |
| 元素符号 | Na | Mg | Si | P | S | Cl |
| x 值 | 0.93 | 1.35 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)推测 x 值与原子半径关系是
(3)某有机化合物结构式为:
 ,其中SO键中你认为共用电子对偏向谁?
,其中SO键中你认为共用电子对偏向谁?(4)经验规律告诉我们:当成键的两原子相应元素的 x 差值(Δ x )即 x >1.7时,一般为离子键;当Δ x <1.7时,一般为共价键。试推断AlF 3 中化学键类型是
(5)预测元素周期表中, x 值最小的元素的位置:
您最近一年使用:0次
解题方法
7 . 金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。
请回答下列问题:
(1)Ti的基态原子价电子排布式为_______ 。
(2)纳米TiO2常用作下述反应的催化剂。
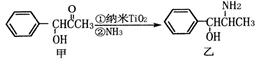
化合物甲的分子中采取sp2方式杂化的碳原子有_______ 个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为_______ 。
(3)含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2·H2O,其配离子中含有的化学键类型是_______ ,1 mol该配合物中含有的 键数目是
键数目是_______ 。
(4)通过X—射线探知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据如下:
KCl、MgO、CaO、TiN四种离子晶体熔点由高到低的顺序为_______ 。
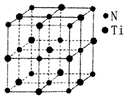
(5)某种氮化钛晶体的晶胞如图所示,该晶体中与N原子距离相等且最近的N原子有_______ 个:Ti原子的配位数为_______ ;此配位原子构成的空间构型为_______ ;该晶胞中N、Ti原子之间的最近距离为a nm。则该氮化钛晶体的密度为_______ g·cm-3、NA为阿伏伽德罗常数的值,只列计算式)。
请回答下列问题:
(1)Ti的基态原子价电子排布式为
(2)纳米TiO2常用作下述反应的催化剂。

化合物甲的分子中采取sp2方式杂化的碳原子有
(3)含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2·H2O,其配离子中含有的化学键类型是
 键数目是
键数目是(4)通过X—射线探知KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据如下:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
(5)某种氮化钛晶体的晶胞如图所示,该晶体中与N原子距离相等且最近的N原子有

您最近一年使用:0次
2017-04-13更新
|
295次组卷
|
2卷引用:2017届江西省南昌市十所省重点中学命制高三第二次模拟突破冲刺(一)理综化学试卷
解题方法
8 . 太阳能电池板材料除单品硅外,还有铜、铟、稼、硒、硅等化学物质。
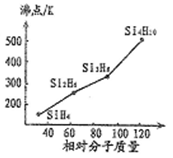
(1)硒、硅与氢元素形成的组成最简单的氢化物中,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se____ Si(填“>”、“<”)。人们把硅与氢元素形成的一类化合物叫硅烷(SinH2n+2)。硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是______________ 。
(2)①已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d 和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是___________ 。
② 金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为___________________ 。
③ 铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,计算晶体铜的密度_____ g/cm3。
(3)稼的基态原子的电子排布式是_______ 。与铟、稼元家处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物.如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为______ ,B与N之间形成______ 键;硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质.其电离方程式为______________ 。
(1)硒、硅与氢元素形成的组成最简单的氢化物中,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se
(2)①已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d 和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是
② 金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为
③ 铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,计算晶体铜的密度
(3)稼的基态原子的电子排布式是
您最近一年使用:0次
填空题
|
较难(0.4)
|
名校
9 . 铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表的第______ 族,其基态原子中未成对电子个数为________ 。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为_________________________________ ,所含非金属元素的电负性由大到小的顺序是_____________________________ 。
(3)尿素[CO(NH2)2]分子中,碳原子为_______ 杂化,分子中σ键与π键的数目之比为_________ 。
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需知道的数据是________________________________________ 。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________________ 。
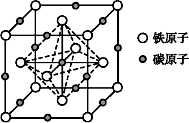
(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为____________ 。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子的距离为___________________ pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。
(1)钴位于元素周期表的第
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为
(3)尿素[CO(NH2)2]分子中,碳原子为
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需知道的数据是
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为
(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为

您最近一年使用:0次
2017-02-24更新
|
2505次组卷
|
11卷引用:江西省上饶市重点中学2018届高三六校第一次联考理综化学试题
江西省上饶市重点中学2018届高三六校第一次联考理综化学试题2017届安徽省A10联盟高三下学期开年考试理综化学试卷2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷吉林省实验中学2018届高三第八次月考(第四次模拟)理科综合化学试题【全国百强校】四川省棠湖中学2019届高三上学期第二次月考理科综合化学试题(已下线)2018年12月9日 《每日一题》一轮复习- 每周一测湖北省黄冈市罗田县第一中学2019届高三上学期12月月考理科综合化学试题(已下线)2019年12月8日 《每日一题》2020年高考化学一轮复习——每周一测陕西省泾干中学2021-2022学年高三上学期第一次月考化学试题2020年全国卷Ⅰ理综化学高考真题变式题广西钦州市第四中学2021-2022学年高三上学期期中考试理综化学试题
名校
解题方法
10 . 新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为_____ ,该能层具有的原子轨道数为_____ .
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是_____ ,B原子的杂化轨道类型是_____ .
Li、B、H元素的电负性由大到小排列顺序为_____ .
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+_____ H﹣(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
M是_____ (填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为_____ ,NaH的理论密度是___________ g•cm﹣3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是
Li、B、H元素的电负性由大到小排列顺序为
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+
| I1/kJ•mol﹣1 | I2/kJ•mol﹣1 | I3/kJ•mol﹣1 | I4/kJ•mol﹣1 | I5/kJ•mol﹣1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
M是
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为
您最近一年使用:0次
2016-12-09更新
|
390次组卷
|
7卷引用:江西省南昌市第十中学2020届高三上学期期末考试化学试题



