13-14高一下·北京西城·期末
名校
1 . 为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。
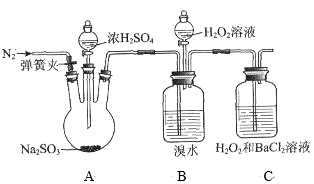
(1)A中发生反应的化学方程式是____ 。
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2。
①乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是____ 。
②丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是___ 。
③将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性H2O2>SO2。
(3)ⅲ中滴入少量H2O2没有明显变化。提出假设:
观点1:H2O2的量少不能氧化Br―
观点2:B中有未反应的H2SO3
为验证观点2,应进行的实验操作及现象是________ 。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是____ 。

| 实验操作 | 实验现象 |
| ⅰ.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
| ⅲ.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2。
①乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是
②丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是
③将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性H2O2>SO2。
(3)ⅲ中滴入少量H2O2没有明显变化。提出假设:
观点1:H2O2的量少不能氧化Br―
观点2:B中有未反应的H2SO3
为验证观点2,应进行的实验操作及现象是
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是
您最近一年使用:0次
2016-12-09更新
|
1162次组卷
|
9卷引用:四川省眉山市彭山区第一中学2019-2020学年高二上学期开学考试化学试题
四川省眉山市彭山区第一中学2019-2020学年高二上学期开学考试化学试题(已下线)2013-2014北京市西城区下学期高一年级期末考试化学试卷(已下线)2015届河南省洛阳市高三上学期期中考试化学试卷2014-2015学年湖北省部分重点高中高二下期末考试化学试卷(已下线)北京市第四中学2016-2017学年高一下学期期中考试化学试题北京市2019年普通高中学业水平合格性考试模拟化学试题(人教版2019)必修第二册 模块学业水平合格性测评北京市朝阳区2021-2022学年高一年级下学期合格考模拟检测化学试题江西省省重点校联盟2022-2023学年高二上学期入学联考化学试题
2 . 现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(1)试从下图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:
A接___ ,___ 接___ ,B接___ ,____ 接____ 。
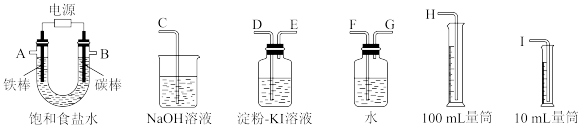
(2)铁棒接直流电源的______ 极;碳棒上发生的电极反应为_________ 。
(3)能说明氯气具有氧化性的实验现象是____________ 。
(4)假定装入的饱和食盐水为50 mL(电解前后溶液体积变化可忽略),当测得的氢气换算成标准状况下为5.6 mL时,溶液的pH为_______ 。
(1)试从下图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:
A接
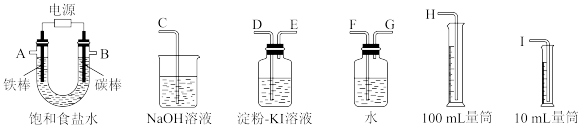
(2)铁棒接直流电源的
(3)能说明氯气具有氧化性的实验现象是
(4)假定装入的饱和食盐水为50 mL(电解前后溶液体积变化可忽略),当测得的氢气换算成标准状况下为5.6 mL时,溶液的pH为
您最近一年使用:0次
2016-12-09更新
|
278次组卷
|
2卷引用:2014-2015四川省重点中学高二下学期期中考试化学试卷
2013·山西忻州·一模
3 . X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的氢化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成分之一。
(1)写出实验室制取W2反应的离子方程式_______ 。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。

①分别通入YX2和W2,在装置A中观察到的现象是否相同_______ (填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为_______ ;若装置D中装的是五氧化二钒,当通入足量YX2时,打开K通入适量X2,化学反应方程式为_______ ;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为_______ 。
(2)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是_______ (填字母)。
A.氨水B.稀盐酸C.稀硝酸D.氯化钙E.双氧水F.硝酸银
(1)写出实验室制取W2反应的离子方程式
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。

①分别通入YX2和W2,在装置A中观察到的现象是否相同
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为
(2)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是
A.氨水B.稀盐酸C.稀硝酸D.氯化钙E.双氧水F.硝酸银
您最近一年使用:0次
2016-12-09更新
|
321次组卷
|
4卷引用:2014-2015四川省达州市大竹县文星中学高一3月月考化学试卷
2014-2015四川省达州市大竹县文星中学高一3月月考化学试卷(已下线)2013届山西省忻州市高三第一次联考化学试卷2015届福建省长汀县第一中学高三上学期第四次月考化学试卷2016届甘肃省嘉峪关一中高三上第三次模拟考试化学试卷
解题方法
4 . 聚合硫酸铁(简称PFS,化学式为[Fe(OH)n(SO4)3-n/2]m)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理,现用一定质量的铁的氧化物(如下图所示)为原料来制取聚合硫酸铁。实验步骤如下:
(1)实验室用18.4mol/L的浓硫酸配制250mL4.8mol/L的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需的玻璃仪器__________ 。定容操作中若俯视容量瓶刻度线,所配硫酸溶液浓度将___________ (填“偏高”、“偏低”或“无影响”)
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是_______ 。
A.确定下一步还原所需铁的量 B.控制溶液中Fe2+与Fe3+含量比
C.确定氧化Fe2+所需ClO2的量 D.确保铁的氧化物酸溶完全
(3)写出步骤Ⅳ中用ClO2氧化Fe2+时的离子方程式:____________________ 。(还原产物为Cl-)
(4)为了分析产品聚合硫酸铁溶液中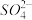 与Fe3+物质的量之比,有人设计了以下操作:
与Fe3+物质的量之比,有人设计了以下操作:
(I)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤,洗涤、干燥后,称重,其质量为mg。
(II)另取25mL聚合硫酸铁溶液,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL与VmL0.1000mol/LKMnO4酸性溶液恰好完全反应,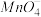 被还原为Mn2+。
被还原为Mn2+。
回答下列问题:
①根据(II)步骤中判断Cu2+、Fe2+、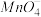 、Fe3+氧化性由强到弱的顺序:
、Fe3+氧化性由强到弱的顺序:__________ 。
②聚合硫酸铁中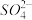 与Fe3+的物质的量之比为
与Fe3+的物质的量之比为____________ (用含m、V的代数式表示)。

(1)实验室用18.4mol/L的浓硫酸配制250mL4.8mol/L的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需的玻璃仪器
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是
A.确定下一步还原所需铁的量 B.控制溶液中Fe2+与Fe3+含量比
C.确定氧化Fe2+所需ClO2的量 D.确保铁的氧化物酸溶完全
(3)写出步骤Ⅳ中用ClO2氧化Fe2+时的离子方程式:
(4)为了分析产品聚合硫酸铁溶液中
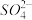 与Fe3+物质的量之比,有人设计了以下操作:
与Fe3+物质的量之比,有人设计了以下操作:(I)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤,洗涤、干燥后,称重,其质量为mg。
(II)另取25mL聚合硫酸铁溶液,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL与VmL0.1000mol/LKMnO4酸性溶液恰好完全反应,
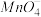 被还原为Mn2+。
被还原为Mn2+。回答下列问题:
①根据(II)步骤中判断Cu2+、Fe2+、
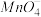 、Fe3+氧化性由强到弱的顺序:
、Fe3+氧化性由强到弱的顺序:②聚合硫酸铁中
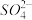 与Fe3+的物质的量之比为
与Fe3+的物质的量之比为
您最近一年使用:0次
名校
5 . 下列说法正确的是
| A.同一元素的含氧酸,该元素的化合价越高,其酸性越强,氧化性也越强 |
| B.具有下列电子排布式的原子中:①1s22s22p63s23p2、②1s22s22p3、③1s22s22p2、④1s22s22p63s23p4,原子半径最大的是④ |
C.铜的原子结构示意图: |
D.过氧化氢电子式: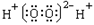 |
您最近一年使用:0次
名校
6 . 酸性KMnO4溶液和CuS混合时,发生反应: +CuS+H+→Cu2++SO2↑+Mn2++H2O(未配平),下列有关该反应的说法中正确的是
+CuS+H+→Cu2++SO2↑+Mn2++H2O(未配平),下列有关该反应的说法中正确的是
 +CuS+H+→Cu2++SO2↑+Mn2++H2O(未配平),下列有关该反应的说法中正确的是
+CuS+H+→Cu2++SO2↑+Mn2++H2O(未配平),下列有关该反应的说法中正确的是| A.被氧化的元素是Cu和S |
B. 作氧化剂,表现氧化性,发生氧化反应 作氧化剂,表现氧化性,发生氧化反应 |
| C.氧化剂与还原剂的物质的量之比为6:5 |
| D.若生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol |
您最近一年使用:0次
2020-12-24更新
|
132次组卷
|
2卷引用:四川省绵阳市南山中学2020-2021学年高一上学期12月月考化学试题
解题方法
7 . 四种短周期元素在元素周期表中的相对位置如图所示,其中丙元素最外层电子数是其电子层数的2倍。下列叙述正确的是
甲 | 乙 | |
丙 | 丁 |
| A.四种元素中原子半径最大的是丁 |
| B.氧化物对应水化物的酸性:丁一定强于丙 |
| C.单核阴离子还原性:乙强于丙 |
| D.甲的气态氢化物可与其最高价氧酸反应生成离子化合物 |
您最近一年使用:0次
名校
解题方法
8 . 在化学课上围绕浓硫酸的化学性质进行如下实验探究,将适量的蔗糖放入烧杯中,加几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。请回答下列问题:
(1)生成的这种黑色物质(单质)是(填化学式)________ 。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的污染物之一,这种刺激性气味气体为(填化学式)___ ,反应的化学方程式为________ 。
(3)根据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有(填字母)_______ 。
A 酸性 B 吸水性 C 脱水性 D 强氧化性
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,探究SO2与品红作用的可逆性,请写出实验操作及现象______ 。;将(2)中产生的有刺激性气味的气体通入氯水中,发生反应的化学方程式为_______ 。
(5)工厂煤燃烧产生的烟气若直接排放到空气中,引发的主要环境问题有_____ 。
A 温室效应 B 酸雨 C 粉尘污染 D 水体富营养化
工业上为实现燃煤脱硫,常通过煅烧石灰石得到生石灰,以生石灰为脱硫剂,与烟气中SO2反应从而将硫固定,其产物可作建筑材料。写出其中将硫固定的化学方程式是______ 。
(1)生成的这种黑色物质(单质)是(填化学式)
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的污染物之一,这种刺激性气味气体为(填化学式)
(3)根据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有(填字母)
A 酸性 B 吸水性 C 脱水性 D 强氧化性
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,探究SO2与品红作用的可逆性,请写出实验操作及现象
(5)工厂煤燃烧产生的烟气若直接排放到空气中,引发的主要环境问题有
A 温室效应 B 酸雨 C 粉尘污染 D 水体富营养化
工业上为实现燃煤脱硫,常通过煅烧石灰石得到生石灰,以生石灰为脱硫剂,与烟气中SO2反应从而将硫固定,其产物可作建筑材料。写出其中将硫固定的化学方程式是
您最近一年使用:0次
2020-06-09更新
|
114次组卷
|
3卷引用:四川省攀枝花市第十五中学2019-2020学年高一下学期期中考试化学试题
名校
解题方法
9 . 某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的 转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
测得实验①和②溶液中的 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。

(2)上述反应后草酸被氧化为_______________ (填化学式)。
(3)实验①和②的结果表明___________________________________ ;实验①中0~t1时间段反应速率v(Cr3+)=_______________________ mol·L-1·min-1(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:___________________________ ;
假设三:___________________________ ;
(5)请你设计实验验证上述假设一,完成下表中内容。
[除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中 的浓度可用仪器测定]
的浓度可用仪器测定]
(6)某化学兴趣小组要完成中和热的测定,实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是________ 、___________ 。
(7)在量热计中将100 mL 0.50 mol·L-1的醋酸溶液与100 mL 0.55 mol·L-1的氢氧化钠溶液混合,温度从298.0 K升高到300.7 K,已知量热计的热容常数(量热计各部件温度每升高1 K所需要的热量)是150.5 J·K-1,溶液密度均为1 g·mL-1,充分混合后溶液的比热容c=4.184 J·g-1·K-1。试求醋酸与氢氧化钠发生中和反应的反应热ΔH=________ 。
(8)若用KOH代替NaOH,对测定结果____ (填“有”或“无”)影响;若用盐酸代替醋酸做实验,对测定结果ΔH____ (填“偏大”或“偏小”无影响)。
 转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。
| 实验 编号 | 初始 pH | 废水样品 体积/mL | 草酸溶液 体积/mL | 蒸馏水 体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | | 20 |
 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为
(3)实验①和②的结果表明
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:
假设三:
(5)请你设计实验验证上述假设一,完成下表中内容。
[除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中
 的浓度可用仪器测定]
的浓度可用仪器测定]| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
(7)在量热计中将100 mL 0.50 mol·L-1的醋酸溶液与100 mL 0.55 mol·L-1的氢氧化钠溶液混合,温度从298.0 K升高到300.7 K,已知量热计的热容常数(量热计各部件温度每升高1 K所需要的热量)是150.5 J·K-1,溶液密度均为1 g·mL-1,充分混合后溶液的比热容c=4.184 J·g-1·K-1。试求醋酸与氢氧化钠发生中和反应的反应热ΔH=
(8)若用KOH代替NaOH,对测定结果
您最近一年使用:0次
11-12高一下·辽宁抚顺·期中
名校
解题方法
10 . 下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
| A.在空气中敞口久置的浓硫酸,溶液质量增大(脱水性) |
| B.在加热条件下铜与浓硫酸反应(氧化性、酸性) |
| C.蔗糖与浓硫酸反应中有海棉状的炭生成(吸水性) |
| D.浓硫酸可用来干燥某些气体(难挥发性) |
您最近一年使用:0次
2020-06-02更新
|
269次组卷
|
14卷引用:四川省威远中学2019-2020学年高一下学期第一次月考化学试题
四川省威远中学2019-2020学年高一下学期第一次月考化学试题(已下线)2011-2012学年辽宁省抚顺县高级中学高一下学期期中考试化学试卷(已下线)2012-2013学年山东省淄博一中高一上学期期末考试化学试卷(已下线)2013-2014学年浙江省瑞安中学高一上学期期中考试化学试卷2014-2015甘肃省白银市会宁县五中高一上学期期末化学试卷2017届西藏山南二中高三上11月月考化学试卷宁夏银川市兴庆区2018届高三上学期第二次月考化学试题河南省商城县上石桥高级中学2018-2019学年高二上学期12月月考化学试题【全国百强校】吉林省长春市外国语学校2018-2019学年高一下学期第一次月考化学试题(已下线)吉林省长春市实验中学2019-2020学年高一下学期期中考试化学试题吉林省长春市实验中学2019-2020学年高一下期中考试化学试题黑龙江省绥化市2019-2020学年高一下学期期末考试化学试题云南省昌宁县第一中学2021-2022学年高一 3月月考化学试题广东省深圳聚龙科学中学2022-2023学年高一下学期第一次段考(学业水平)化学试题



