1 . 氧化还原反应知识贯穿于中学化学教材,从初中阶段的简单了解,到高中基本理论知识,再到元素化合物部分的实际应用,再到化学电源本质的理解,再到有机化学中物质类型的变化关系,层层推进,高潮迭起。分析氧化还原反应常用双线桥法和单线桥法来表示电子转移的方向和数目。
I.在KClO3+6HCl=KCl+3Cl2↑+3H2O的反应中:
(1)请用单线桥 法标出电子转移的方向和数目________ ;
(2)该反应中,氧化产物与还原产物的物质的量之比为_____________ ;
(3)若生成 0.3 mol Cl2,则转移的电子的数目为________________ ;
II.已知硫化亚铁是一种黑色块状固体,在空气中煅烧时生成二氧化硫气体和烧渣;硫化亚铁常温下难溶于水,易溶于稀盐酸、稀硫酸而生成能溶于水的硫化氢气体。硫化亚铁与浓硫酸加热条件下,可发生反应:2FeS+6H2SO4(浓) Fe2(SO4)3+3SO2↑ +2S+6H2O:
Fe2(SO4)3+3SO2↑ +2S+6H2O:
(4)请用双线桥 法标出电子转移的方向和数目_______ 。
(5)H2SO4在该反应中显示出来的性质是___________ ;(填序号)
A.氧化性 B.还原性 C.酸性 D.碱性
(6)该反应中,氧化产物是________________ 。
I.在KClO3+6HCl=KCl+3Cl2↑+3H2O的反应中:
(1)请用
(2)该反应中,氧化产物与还原产物的物质的量之比为
(3)若生成 0.3 mol Cl2,则转移的电子的数目为
II.已知硫化亚铁是一种黑色块状固体,在空气中煅烧时生成二氧化硫气体和烧渣;硫化亚铁常温下难溶于水,易溶于稀盐酸、稀硫酸而生成能溶于水的硫化氢气体。硫化亚铁与浓硫酸加热条件下,可发生反应:2FeS+6H2SO4(浓)
 Fe2(SO4)3+3SO2↑ +2S+6H2O:
Fe2(SO4)3+3SO2↑ +2S+6H2O:(4)请用
(5)H2SO4在该反应中显示出来的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
(6)该反应中,氧化产物是
您最近一年使用:0次
2 .  是饮用水、工业用水、城市污水及游泳池循环水处理的高效廉价絮凝剂,也是中学实验室中常见的试剂。某实验小组用以下装置制备
是饮用水、工业用水、城市污水及游泳池循环水处理的高效廉价絮凝剂,也是中学实验室中常见的试剂。某实验小组用以下装置制备 固体,并探究
固体,并探究 溶液与
溶液与 的反应。
的反应。
已知: 晶体易升华,
晶体易升华, 易水解。
易水解。
Ⅰ. 的制备
的制备
(1)装置C中碱石灰的作用是_____ 。
(2)从D、E、F中选择合适的装置制备纯净的 ,正确的接口顺序为a→
,正确的接口顺序为a→_____ (可选试剂:饱和食盐水、 溶液、浓硫酸、碱石灰,仪器可以重复使用)。
溶液、浓硫酸、碱石灰,仪器可以重复使用)。
(3)写出装置D中制备 的离子方程式:
的离子方程式:_____ 。
Ⅱ.探究 溶液与
溶液与 的反应
的反应
向 溶液中滴加几滴
溶液中滴加几滴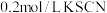 溶液,溶液变红;再加入过量
溶液,溶液变红;再加入过量 粉,溶液红色褪去,不久有白色沉淀产生。
粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知: 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
猜想1: 与过量的
与过量的 粉反应生成
粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
猜想2: 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
针对上述猜想,实验小组同学设计了以下实验:
(4)实验结果说明猜想_____ (填“1”或“2”)不合理。
(5)根据实验现象进一步查阅资料发现:
i. 与
与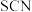 可发生如下两种反应:
可发生如下两种反应:
反应A: (淡黄色)
(淡黄色)
反应B: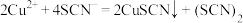 (黄色)。
(黄色)。
ii.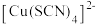 与
与 共存时溶液显绿色。
共存时溶液显绿色。
①由实验2中的现象推测,反应速率:A_____ (填“>”或“<”)B,说明反应B_____ (填“是”或“不是”)产生 的主要原因。
的主要原因。
②进一步查阅资料可知,当反应体系中同时存在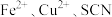 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入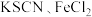 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式:
,写出该反应离子方程式:_____ 。
 是饮用水、工业用水、城市污水及游泳池循环水处理的高效廉价絮凝剂,也是中学实验室中常见的试剂。某实验小组用以下装置制备
是饮用水、工业用水、城市污水及游泳池循环水处理的高效廉价絮凝剂,也是中学实验室中常见的试剂。某实验小组用以下装置制备 固体,并探究
固体,并探究 溶液与
溶液与 的反应。
的反应。已知:
 晶体易升华,
晶体易升华, 易水解。
易水解。Ⅰ.
 的制备
的制备
(1)装置C中碱石灰的作用是
(2)从D、E、F中选择合适的装置制备纯净的
 ,正确的接口顺序为a→
,正确的接口顺序为a→ 溶液、浓硫酸、碱石灰,仪器可以重复使用)。
溶液、浓硫酸、碱石灰,仪器可以重复使用)。(3)写出装置D中制备
 的离子方程式:
的离子方程式:Ⅱ.探究
 溶液与
溶液与 的反应
的反应向
 溶液中滴加几滴
溶液中滴加几滴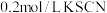 溶液,溶液变红;再加入过量
溶液,溶液变红;再加入过量 粉,溶液红色褪去,不久有白色沉淀产生。
粉,溶液红色褪去,不久有白色沉淀产生。查阅资料可知:
 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:猜想1:
 与过量的
与过量的 粉反应生成
粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。猜想2:
 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。针对上述猜想,实验小组同学设计了以下实验:
| 实验编号 | 操作 | 现象 |
| 实验1 |  | 加入铜粉后无现象 |
| 实验2 |  | 溶液很快由蓝色变为绿色,未观察到白色沉淀;2h后溶液为绿色,未观察到白色沉淀;24h后,溶液绿色变浅,试管底部有白色沉淀 |
(5)根据实验现象进一步查阅资料发现:
i.
 与
与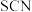 可发生如下两种反应:
可发生如下两种反应:反应A:
 (淡黄色)
(淡黄色)反应B:
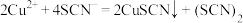 (黄色)。
(黄色)。ii.
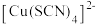 与
与 共存时溶液显绿色。
共存时溶液显绿色。①由实验2中的现象推测,反应速率:A
 的主要原因。
的主要原因。②进一步查阅资料可知,当反应体系中同时存在
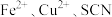 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入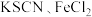 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式:
,写出该反应离子方程式:
您最近一年使用:0次
3 . 镁与稀硝酸的反应为:Mg+ HNO3(稀)—— Mg(NO3)2+ NH4NO3+ H2O
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目。_____
(2)该反应中,还原产物是_________ ,HNO3表现了________ (选填“还原性”、“氧化性”、“酸性”、“碱性”)。
(3)若反应过程中转移的电子数为6.02×1023,则被还原的硝酸物质的量为________ 。
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目。
(2)该反应中,还原产物是
(3)若反应过程中转移的电子数为6.02×1023,则被还原的硝酸物质的量为
您最近一年使用:0次
名校
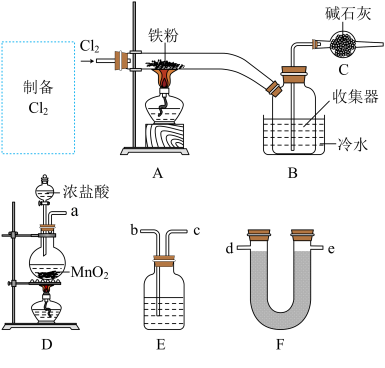
4 . 化学小组同学设计如下实验验证氧气的部分性质,并探究氯水的成分和性质。
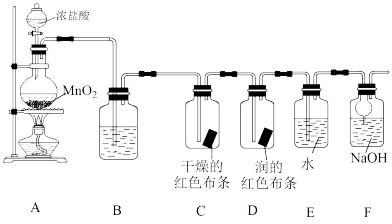
回答下列问题:
(1)装置A中装浓盐酸的仪器的名称是_______ 。
(2)装置A中发生反应的化学方程式为_______ 。
(3)验证干燥的氯气没有漂白性的现象为_______ 。
(4)装置F的作用(用离子方程式表示)是_______ 。
(5)资料:淀粉的特征反应——遇 变蓝色:
变蓝色: 。
。
研究新制氯水的成分和性质,分别取装置E中的溶液(氯水)进行下列实验:
①根据实验1,滴加淀粉碘化钾溶液,溶液变蓝,可知氧化性:
_______  (填“﹥”或“﹤”)。
(填“﹥”或“﹤”)。
②实验2中,将氯水滴入石蕊溶液中,石蕊溶液先变红,后褪色,褪色是因为溶液中含有_______ 分子。
③若用实验3证明氯水中含有氯离子,则操作、现象:_______ 。

回答下列问题:
(1)装置A中装浓盐酸的仪器的名称是
(2)装置A中发生反应的化学方程式为
(3)验证干燥的氯气没有漂白性的现象为
(4)装置F的作用(用离子方程式表示)是
(5)资料:淀粉的特征反应——遇
 变蓝色:
变蓝色: 。
。研究新制氯水的成分和性质,分别取装置E中的溶液(氯水)进行下列实验:
①根据实验1,滴加淀粉碘化钾溶液,溶液变蓝,可知氧化性:

 (填“﹥”或“﹤”)。
(填“﹥”或“﹤”)。②实验2中,将氯水滴入石蕊溶液中,石蕊溶液先变红,后褪色,褪色是因为溶液中含有
③若用实验3证明氯水中含有氯离子,则操作、现象:
您最近一年使用:0次
2022-12-07更新
|
115次组卷
|
2卷引用:四川省内江市资中县第二中学2022-2023学年高二上学期期中考试化学试题
11-12高二·辽宁·期末
名校
5 . 维生素C 又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+ 转变为易吸收的Fe2+ ,这说明维生素C具有
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
您最近一年使用:0次
2016-12-09更新
|
383次组卷
|
7卷引用:四川省绵阳南山中学2021-2022学年高一上学期半期考试化学试题
6 . 下表是元素周期表中的一部分。

根据A—J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是______ ,氧化性最强的单质是____ ,还原性最强的单质是_____ 。
(2)最高价氧化物对应的水化物中,碱性最强的是___________ ,酸性最强的是___________ ,呈两性的是_______________ 。
(3)A分别与E、F、G、H、I形成的化合物中,最稳定的是______________ 。
(4)在B、C、D、G、I中,原子半径最大的是______________________ 。
(5)元素C与I形成的化合物的电子式是________________________ 。

根据A—J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是
(2)最高价氧化物对应的水化物中,碱性最强的是
(3)A分别与E、F、G、H、I形成的化合物中,最稳定的是
(4)在B、C、D、G、I中,原子半径最大的是
(5)元素C与I形成的化合物的电子式是
您最近一年使用:0次
2016-12-09更新
|
192次组卷
|
2卷引用:2014-2015学年四川省乐山市五通桥中学高一下化学试卷
10-11高一上·四川成都·期中
7 . 已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn + 6H2SO4 = 2AsH3 + 6ZnSO4+ 3H2O
(1)请用双线桥法标出电子转移的方向和数目_______ 。
(2)As2O3在上述反应中显示出来的性质是_______ 。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是_______ ,还原产物是_______ 。
(4)若生成 0.1 mol AsH3,则转移的电子数为_______ 。
(1)请用双线桥法标出电子转移的方向和数目
(2)As2O3在上述反应中显示出来的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是
(4)若生成 0.1 mol AsH3,则转移的电子数为
您最近一年使用:0次
13-14高一·四川成都·期末
8 . 下列结论正确的是
①粒子半径:K>Cl>S ②氢化物稳定性:HF>H2S>PH3;
③离子还原性:S2->Cl->Br->I- ④单质氧化性:Cl2>S>Si;
⑤酸性:H2SO4>HClO ⑥碱性强弱:KOH>NaOH>Mg(OH)2
①粒子半径:K>Cl>S ②氢化物稳定性:HF>H2S>PH3;
③离子还原性:S2->Cl->Br->I- ④单质氧化性:Cl2>S>Si;
⑤酸性:H2SO4>HClO ⑥碱性强弱:KOH>NaOH>Mg(OH)2
| A.①④⑤ | B.③⑥ | C.②④⑤⑥ | D.①③④ |
您最近一年使用:0次
名校
9 . I.某化学兴趣小组用如图装置制备 并探究其性质。
并探究其性质。
i. 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii. 有较强的还原性
有较强的还原性
(1)装置A中a的作用是_____________________________ ;
(2)上述装置中存在一处缺陷,会干扰 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是_________________ 。
(3)改进实验装置后,B中 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式_________________________ 。
(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①用离子方程式表示C中溶液变红色的原因____________________________ 、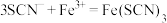 。
。
②某同学对褪色原因提出假设:
假设1: 被
被 氧化为更高价态;
氧化为更高价态;
假设2: 被
被 氧化为更高价态。
氧化为更高价态。
为进一步探究,该同学取装置C褪色后的溶液少许于试管中,加入____________________________ ,若出现____________________________ 现象,则说明假设2成立。
II.有两组化学兴趣小组同学对、 、
、 、
、 的性质及其之间的反应进行探究。回答下列问题:
的性质及其之间的反应进行探究。回答下列问题:
(5)甲组同学探究溶液 对
对 稳定性的影响,得到如图所示结果,则增强
稳定性的影响,得到如图所示结果,则增强 稳定性的措施为
稳定性的措施为______________________________ 。 与
与 的反应,进行如图所示实验:
的反应,进行如图所示实验: 与
与 反应的离子方程式为
反应的离子方程式为______________________________ 。
为了探究白色沉淀产生的原因,同学们查阅资料得知:
i. 是难溶于水的白色固体;
是难溶于水的白色固体;
ii. 的化学性质与
的化学性质与 相似;
相似;
iii.
填写实验方案:
②步骤2的空格中填写的数据为___________________ 。
③ 与
与 反应的离子方程式为
反应的离子方程式为____________________________________ 。
 并探究其性质。
并探究其性质。
i.
 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii.
 有较强的还原性
有较强的还原性(1)装置A中a的作用是
(2)上述装置中存在一处缺陷,会干扰
 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是(3)改进实验装置后,B中
 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①用离子方程式表示C中溶液变红色的原因
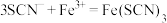 。
。②某同学对褪色原因提出假设:
假设1:
 被
被 氧化为更高价态;
氧化为更高价态;假设2:
 被
被 氧化为更高价态。
氧化为更高价态。为进一步探究,该同学取装置C褪色后的溶液少许于试管中,加入
II.有两组化学兴趣小组同学对、
 、
、 、
、 的性质及其之间的反应进行探究。回答下列问题:
的性质及其之间的反应进行探究。回答下列问题:(5)甲组同学探究溶液
 对
对 稳定性的影响,得到如图所示结果,则增强
稳定性的影响,得到如图所示结果,则增强 稳定性的措施为
稳定性的措施为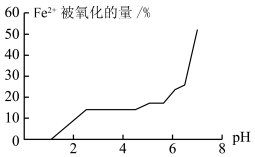
 与
与 的反应,进行如图所示实验:
的反应,进行如图所示实验:
 与
与 反应的离子方程式为
反应的离子方程式为为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.
 是难溶于水的白色固体;
是难溶于水的白色固体;ii.
 的化学性质与
的化学性质与 相似;
相似;iii.

填写实验方案:
实验方案 | 实验现象 |
步骤1:取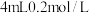 的 的 溶液,向其中滴加3滴 溶液,向其中滴加3滴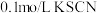 溶液 溶液 | 无明显现象 |
步骤2:取 的 的 溶液,向其中滴加3滴 溶液,向其中滴加3滴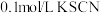 溶液 溶液 | 产生白色沉淀 |
③
 与
与 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
2024-01-13更新
|
165次组卷
|
4卷引用:四川省德阳市外国语学校1-10班2023-2024学年高一下学期入学考试化学试题
解题方法
10 . 为了探究乙二酸的不稳定性、弱酸性和还原性,某化学兴趣小组设计如下实验。
[查阅资料]乙二酸俗称草酸,草酸晶体(H2C2O4·2H2O)在100℃时开始升华,157℃时大量升华并开始分解;草酸蒸气在低温下迅速冷凝为固体;草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊。
I.乙二酸的不稳定性:根据草酸晶体的组成,猜想其受热分解产物为CO、CO2和H2O。
(1)请用下列装置组成一套探究并验证其产物的实验装置。请回答下列问题:

①装置的连接顺序为:A→D→B→G→_______ →_______ →C→G。
②装置中冰水混合物的作用是_______ 。
③整套装置存在不合理之处_______ 。
II.乙二酸的弱酸性:该小组同学为验证草酸性质需0.1mol/L的草酸溶液480mL。
(2)配制该溶液需要的玻璃仪器有量筒、烧杯、玻璃棒、_______ 、_______ 。
(3)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的的是_______ 。
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定0.1mol/L草酸溶液的pH
C.将草酸溶液加入Na2CO3溶液中,有CO2放出
(4)该小组同学将0.1mol/L草酸溶液和0.1mol/L的NaOH溶液等体积混合后,测定反应后溶液呈酸性,则所得溶液中各离子浓度由大到小的顺序为_______ 。
III.乙二酸的还原性:
(5)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。该反应的离子方程式为_______ 。
[查阅资料]乙二酸俗称草酸,草酸晶体(H2C2O4·2H2O)在100℃时开始升华,157℃时大量升华并开始分解;草酸蒸气在低温下迅速冷凝为固体;草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊。
I.乙二酸的不稳定性:根据草酸晶体的组成,猜想其受热分解产物为CO、CO2和H2O。
(1)请用下列装置组成一套探究并验证其产物的实验装置。请回答下列问题:

①装置的连接顺序为:A→D→B→G→
②装置中冰水混合物的作用是
③整套装置存在不合理之处
II.乙二酸的弱酸性:该小组同学为验证草酸性质需0.1mol/L的草酸溶液480mL。
(2)配制该溶液需要的玻璃仪器有量筒、烧杯、玻璃棒、
(3)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的的是
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定0.1mol/L草酸溶液的pH
C.将草酸溶液加入Na2CO3溶液中,有CO2放出
(4)该小组同学将0.1mol/L草酸溶液和0.1mol/L的NaOH溶液等体积混合后,测定反应后溶液呈酸性,则所得溶液中各离子浓度由大到小的顺序为
III.乙二酸的还原性:
(5)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。该反应的离子方程式为
您最近一年使用:0次



