名校
1 . 亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用下图所示装置制备NaNO2 (A中加热装置已略去)。

已知:① ;
;
②NO能被酸性 氧化成
氧化成 ,
, 被还原为
被还原为 ;
;
回答下列问题:
(1)仪器X的名称_______ ,B装置中Cu发生反应的化学方程式_______ 。
(2)C装置的作用_______ ,盛放的试剂名称为_______ 。
(3)E装置中反应的离子方程式_______ 。
(4)实验前后均需打开弹簧夹,通入一段时间的N2,两次通入N2的目的分别是_______ 。

已知:①
 ;
;②NO能被酸性
 氧化成
氧化成 ,
, 被还原为
被还原为 ;
;回答下列问题:
(1)仪器X的名称
(2)C装置的作用
(3)E装置中反应的离子方程式
(4)实验前后均需打开弹簧夹,通入一段时间的N2,两次通入N2的目的分别是
您最近一年使用:0次
名校
解题方法
2 . 硫酸铵一种优良的氮肥,适用于各种土壤和作物,硫酸铵还可用于纺织、皮革、医药等方面。某化工厂以硫酸钙为原料制备硫酸铵,其工艺流程如下图甲:

(1)X为___________ (填化学式),操作a名称为___________ 。
(2) 是工业制硝酸的重要原料,写出氨的催化氧化反应的化学方程式
是工业制硝酸的重要原料,写出氨的催化氧化反应的化学方程式___________ 。将产生的氨气与过量的氧气通入到图乙所示装置中,用酒精灯加热催化剂至红热时反应开始发生,熄灭酒精灯后反应仍能继续进行,说明该反应是___________ (填“吸热”或“放热”)反应。

(3)SCR脱硝技术已成为使用广泛和成熟的烟气净化技术,脱硝效率高达90%以上。其催化反应机理如图所示,写出该反应发生的化学方程式___________ 。

(4)上述流程图甲中,可以循环使用的物质有___________ (填化学式)。
(5)从滤液中获得 晶体,必要的操作步骤是蒸发浓缩、
晶体,必要的操作步骤是蒸发浓缩、___________ 、过滤等。

(1)X为
(2)
 是工业制硝酸的重要原料,写出氨的催化氧化反应的化学方程式
是工业制硝酸的重要原料,写出氨的催化氧化反应的化学方程式
(3)SCR脱硝技术已成为使用广泛和成熟的烟气净化技术,脱硝效率高达90%以上。其催化反应机理如图所示,写出该反应发生的化学方程式

(4)上述流程图甲中,可以循环使用的物质有
(5)从滤液中获得
 晶体,必要的操作步骤是蒸发浓缩、
晶体,必要的操作步骤是蒸发浓缩、
您最近一年使用:0次
名校
解题方法
3 . 二氧化硫虽污染环境,但在生活、生产中又有着广泛应用,根据要求回答问题。
Ⅰ.如图所示是酸雨的形成示意图,根据图示回答下列问题。

(1)某实验小组采集硫酸型酸雨样品,随着时间的变化多次测定该样品的pH,得到表中数据:酸雨样品放置时pH变化的主要原因是___________ (用化学方程式表示)。
(2)你认为减少酸雨的产生可采取的措施是___________(填字母)。
①减少用煤作燃料 ②开发新能源 ③化石燃料脱硫 ④在已酸化的土壤中洒石灰 ⑤监测并治理汽车排出的大量尾气 ⑥收集大气中氮氧化物制备硝酸
Ⅱ.某同学根据铜与浓硫酸反应能生成 ,预测锌与浓硫酸反应生成的产物可能为混合气体(水蒸气除外),设计如下装置进行验证(加热和部分夹持装置略):
,预测锌与浓硫酸反应生成的产物可能为混合气体(水蒸气除外),设计如下装置进行验证(加热和部分夹持装置略):

回答下列问题:
(3)A中盛放浓硫酸的仪器名称为___________ 。
(4)该同学预测的混合气体的成分可能为___________ 。
(5)C装置所盛试剂可以是___________ (填一种),实验过程中,理论上可观察到E、F装置的实验现象分别为___________ 、___________ 。
Ⅲ.为测定空气中 的含量,某课外小组的同学将空气样品经过管道通入密闭容器中的
的含量,某课外小组的同学将空气样品经过管道通入密闭容器中的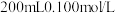 的酸性高锰酸钾溶液。若管道中空气流量为
的酸性高锰酸钾溶液。若管道中空气流量为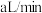 ,经过
,经过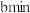 溶液恰好褪色,假定样品中的
溶液恰好褪色,假定样品中的 可以被溶液充分吸收。
可以被溶液充分吸收。
(6)写出上述反应的离子方程式:___________ 。
(7)该样品中的 含量是
含量是___________ 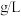 。
。
Ⅰ.如图所示是酸雨的形成示意图,根据图示回答下列问题。

| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水的 | 4.75 | 4.60 | 4.58 | 4.50 | 4.50 |
(2)你认为减少酸雨的产生可采取的措施是___________(填字母)。
①减少用煤作燃料 ②开发新能源 ③化石燃料脱硫 ④在已酸化的土壤中洒石灰 ⑤监测并治理汽车排出的大量尾气 ⑥收集大气中氮氧化物制备硝酸
| A.①②③④⑤⑥ | B.①②③⑤ | C.①②③④⑤ | D.②③⑤⑥ |
Ⅱ.某同学根据铜与浓硫酸反应能生成
 ,预测锌与浓硫酸反应生成的产物可能为混合气体(水蒸气除外),设计如下装置进行验证(加热和部分夹持装置略):
,预测锌与浓硫酸反应生成的产物可能为混合气体(水蒸气除外),设计如下装置进行验证(加热和部分夹持装置略):
回答下列问题:
(3)A中盛放浓硫酸的仪器名称为
(4)该同学预测的混合气体的成分可能为
(5)C装置所盛试剂可以是
Ⅲ.为测定空气中
 的含量,某课外小组的同学将空气样品经过管道通入密闭容器中的
的含量,某课外小组的同学将空气样品经过管道通入密闭容器中的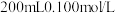 的酸性高锰酸钾溶液。若管道中空气流量为
的酸性高锰酸钾溶液。若管道中空气流量为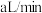 ,经过
,经过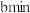 溶液恰好褪色,假定样品中的
溶液恰好褪色,假定样品中的 可以被溶液充分吸收。
可以被溶液充分吸收。(6)写出上述反应的离子方程式:
(7)该样品中的
 含量是
含量是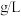 。
。
您最近一年使用:0次
名校
4 . 用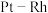 合金催化氧化
合金催化氧化 制
制 ,其反应的微观模型如图①,含氮生成物产率随反应温度的变化曲线如图②。下列说法不正确的是
,其反应的微观模型如图①,含氮生成物产率随反应温度的变化曲线如图②。下列说法不正确的是

 合金催化氧化
合金催化氧化 制
制 ,其反应的微观模型如图①,含氮生成物产率随反应温度的变化曲线如图②。下列说法不正确的是
,其反应的微观模型如图①,含氮生成物产率随反应温度的变化曲线如图②。下列说法不正确的是
| A.低温不利于该反应的发生 |
B. 时,生成的含氮产物有 时,生成的含氮产物有 |
C. 合金催化氧化 合金催化氧化 制 制 ,适宜的温度为 ,适宜的温度为 |
D. 以上,可能发生反应: 以上,可能发生反应: |
您最近一年使用:0次
2023-04-27更新
|
202次组卷
|
2卷引用:广东省广州市第七中学2022-2023学年高一下学期期中考试化学试题
5 . 下列关于铁及其化合物之间转化反应的方程式书写正确的是
A. (g)通过灼热铁粉: (g)通过灼热铁粉: |
B.过量铁粉加入稀硝酸中: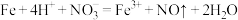 |
C.氢氧化铁中加入氢碘酸: |
D. 溶液中加入酸性 溶液中加入酸性 溶液: 溶液: |
您最近一年使用:0次
2023-04-19更新
|
1242次组卷
|
3卷引用:广东省广州市2023届高三二模考试化学试题
名校
6 .  、
、 、
、 、
、 、
、 、
、 六种短周期主族元素,其原子序数依次增大。
六种短周期主族元素,其原子序数依次增大。 是形成化合物种类最多的元素,
是形成化合物种类最多的元素, 、
、 能形成两种液态化合物
能形成两种液态化合物 和
和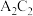 ,
, 、
、 同主族,
同主族, 元素的周期序数与主族序数相等。根据以上信息,回答下列问题:
元素的周期序数与主族序数相等。根据以上信息,回答下列问题:
(1) 元素在周期表中的位置为
元素在周期表中的位置为_______ 。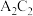 所含的化学键有
所含的化学键有_______
(2)化合物 、
、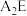 性质比较:热稳定性:
性质比较:热稳定性:
_______ 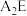 (填“
(填“ ”或“
”或“ ”)。
”)。
(3)物质 由
由 、
、 两种元素组成,
两种元素组成, 的产量可以用来衡量一个国家的石油化工发展水平,则
的产量可以用来衡量一个国家的石油化工发展水平,则 分子的电子式为:
分子的电子式为:_______ ,将 通入溴的四氯化碳溶液中,发生反应的化学方程式为
通入溴的四氯化碳溶液中,发生反应的化学方程式为_______ 。
(4) 的单质和化合物是一种用途很广的材料。写出
的单质和化合物是一种用途很广的材料。写出 单质与氧化铁高温加热制取铁,同时生成D的氧化物的化学方程式:
单质与氧化铁高温加热制取铁,同时生成D的氧化物的化学方程式:_______ 。
(5)向 溶液中通入适量的
溶液中通入适量的 单质后,取少量反应后的溶液,往其中滴加少许淀粉溶液,现象是:
单质后,取少量反应后的溶液,往其中滴加少许淀粉溶液,现象是:_______ 。
 、
、 、
、 、
、 、
、 、
、 六种短周期主族元素,其原子序数依次增大。
六种短周期主族元素,其原子序数依次增大。 是形成化合物种类最多的元素,
是形成化合物种类最多的元素, 、
、 能形成两种液态化合物
能形成两种液态化合物 和
和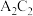 ,
, 、
、 同主族,
同主族, 元素的周期序数与主族序数相等。根据以上信息,回答下列问题:
元素的周期序数与主族序数相等。根据以上信息,回答下列问题:(1)
 元素在周期表中的位置为
元素在周期表中的位置为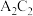 所含的化学键有
所含的化学键有(2)化合物
 、
、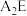 性质比较:热稳定性:
性质比较:热稳定性:
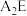 (填“
(填“ ”或“
”或“ ”)。
”)。(3)物质
 由
由 、
、 两种元素组成,
两种元素组成, 的产量可以用来衡量一个国家的石油化工发展水平,则
的产量可以用来衡量一个国家的石油化工发展水平,则 分子的电子式为:
分子的电子式为: 通入溴的四氯化碳溶液中,发生反应的化学方程式为
通入溴的四氯化碳溶液中,发生反应的化学方程式为(4)
 的单质和化合物是一种用途很广的材料。写出
的单质和化合物是一种用途很广的材料。写出 单质与氧化铁高温加热制取铁,同时生成D的氧化物的化学方程式:
单质与氧化铁高温加热制取铁,同时生成D的氧化物的化学方程式:(5)向
 溶液中通入适量的
溶液中通入适量的 单质后,取少量反应后的溶液,往其中滴加少许淀粉溶液,现象是:
单质后,取少量反应后的溶液,往其中滴加少许淀粉溶液,现象是:
您最近一年使用:0次
名校
解题方法
7 . 硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:

已知:某些氢氧化物沉淀的pH如下表所示:
根据题意回答第(1)~(5)题:
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:___________ 、___________ 。
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为___________ 。
(3)滤渣的主要成份除含有Fe(OH)3,Al(OH)3、MnO2外,还有___________ 。
(4)已知MgSO4、CaSO4的溶解度如下表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤是___________ ,___________ 。
(5)实验中提供的硼镁泥共100g,得到的MgSO4·7H2O为172.2g,计算MgSO4·7H2O的产率为___________ 。

已知:某些氢氧化物沉淀的pH如下表所示:
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为
(3)滤渣的主要成份除含有Fe(OH)3,Al(OH)3、MnO2外,还有
(4)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(5)实验中提供的硼镁泥共100g,得到的MgSO4·7H2O为172.2g,计算MgSO4·7H2O的产率为
您最近一年使用:0次
2023-04-05更新
|
1154次组卷
|
2卷引用:广东省广州市第二中学2023届高三模拟考试化学试题
名校
解题方法
8 . 下列物质性质实验对应的离子方程式书写正确的是
A.铁与稀硫酸反应: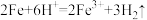 |
B. 溶液中通入硫化氢: 溶液中通入硫化氢: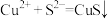 |
C. 通入酸性 通入酸性 溶液中: 溶液中: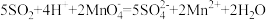 |
D. 溶液中加入稀硫酸: 溶液中加入稀硫酸: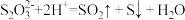 |
您最近一年使用:0次
2023-03-16更新
|
2085次组卷
|
4卷引用:广东省广州市2023届高三一模考试化学试题
名校
9 . 载人航天器中的物质和能量资源都十分宝贵,我国科学家进行了如图所示的氧循环研究,实现了空间站中氧气的再生。下列说法不正确的是


| A.用于循环的氢原子利用率为100% |
| B.太阳能可作为反应①和②的能量来源 |
C.反应①为 |
D.等物质的量的 和 和 含有的电子数相同 含有的电子数相同 |
您最近一年使用:0次
2023-03-16更新
|
2054次组卷
|
8卷引用:广东省广州市2023届高三一模考试化学试题
名校
10 . FeCl3是中学常见的试剂,某实验小组用以下装置制备FeCl3固体,并探究FeCl3溶液与Cu的反应。
已知:FeCl3晶体易升华,FeCl3溶液易水解。
Ⅰ.FeCl3的制备___________ 。
(2)F的名称为___________ ,从D、E、F中选择合适的装置制备纯净的 ,正确的接口顺序为a-
,正确的接口顺序为a-___________ (可选试剂:饱和食盐水、NaOH溶液、浓硫酸、碱石灰,仪器可重复使用)。
(3)写出装置D中制备 的离子方程式
的离子方程式___________ 。
Ⅱ.探究FeCl3溶液与Cu的反应
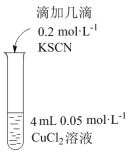
向4mL0.1mol/LFeCl3溶液中滴加几滴0.2mol/LKSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知: 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
猜想1: 与过量的Cu粉反应生成
与过量的Cu粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
猜想2: 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
针对上述猜想,实验小组同学设计了以下实验:
(4)实验结果说明猜想___________ (填“1”或“2”)不合理。
(5)根据实验2中的现象进一步查阅资料发现:
i. 与
与 可发生如下两种反应:
可发生如下两种反应:
反应A: (淡黄色);
(淡黄色);
反应B: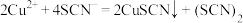 (黄色)。
(黄色)。
ii. 与
与 共存时溶液显绿色。
共存时溶液显绿色。
①由实验2中的现象推测,反应速率:A___________ (填“>”或“<”)B,说明反应B___________ (填“是”或“不是”)产生 的主要原因。
的主要原因。
②进一步查阅资料可知,当反应体系中同时存在 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入 、
、 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式
,写出该反应离子方程式___________ 。
(6)若向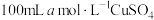 溶液中滴加足量的
溶液中滴加足量的 和
和 的混合溶液,经过一系列操作得到白色沉淀
的混合溶液,经过一系列操作得到白色沉淀 的质量
的质量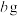 ,则
,则 的产率为
的产率为___________ (写出表达式即可)。
已知:FeCl3晶体易升华,FeCl3溶液易水解。
Ⅰ.FeCl3的制备
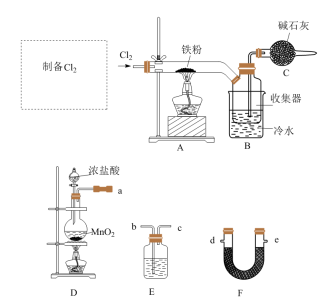
(2)F的名称为
 ,正确的接口顺序为a-
,正确的接口顺序为a-(3)写出装置D中制备
 的离子方程式
的离子方程式Ⅱ.探究FeCl3溶液与Cu的反应
向4mL0.1mol/LFeCl3溶液中滴加几滴0.2mol/LKSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知:
 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:猜想1:
 与过量的Cu粉反应生成
与过量的Cu粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。猜想2:
 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。针对上述猜想,实验小组同学设计了以下实验:
| 实验编号 | 操作 | 现象 |
| 实验1 |
| 加入铜粉后无现象 |
| 实验2 |
| 溶液很快由蓝色变为绿色,未观察到白色沉淀; 2h后溶液为绿色,未观察到白色沉淀;24h后, 溶液绿色变浅,试管底部有白色沉淀 |
(5)根据实验2中的现象进一步查阅资料发现:
i.
 与
与 可发生如下两种反应:
可发生如下两种反应:反应A:
 (淡黄色);
(淡黄色);反应B:
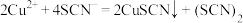 (黄色)。
(黄色)。ii.
 与
与 共存时溶液显绿色。
共存时溶液显绿色。①由实验2中的现象推测,反应速率:A
 的主要原因。
的主要原因。②进一步查阅资料可知,当反应体系中同时存在
 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入 、
、 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式
,写出该反应离子方程式(6)若向
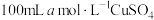 溶液中滴加足量的
溶液中滴加足量的 和
和 的混合溶液,经过一系列操作得到白色沉淀
的混合溶液,经过一系列操作得到白色沉淀 的质量
的质量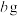 ,则
,则 的产率为
的产率为
您最近一年使用:0次
2023-03-10更新
|
1014次组卷
|
3卷引用:广东省广州大学附属中学2023-2024学年高三上学期开学考试化学试题