解题方法
1 . 某同学欲探究铁及其化合物的性质,下列实验方案可行的是
| A.将铁粉加入热的浓硫酸中:探究铁的活泼性 |
B.将热的NaOH溶液滴入 溶液中:制备 溶液中:制备 胶体 胶体 |
C.将铜粉加入 溶液中:验证 溶液中:验证 的氧化性强于 的氧化性强于 |
D.在蒸发皿中加热蒸干 溶液:制备 溶液:制备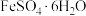 晶体 晶体 |
您最近半年使用:0次
解题方法
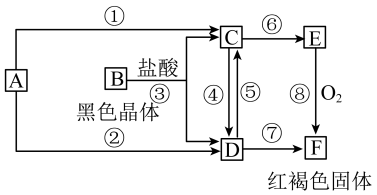
2 . 已知A为常见的金属单质,根据下图所示的关系:___________ ,B为___________ ,C为___________ ,D为___________ ,E为___________ ,F为___________ 。
(2)写出④⑤的离子方程式,⑧的化学方程式。
④___________ ,
⑤___________ ,
⑧___________ 。
(2)写出④⑤的离子方程式,⑧的化学方程式。
④
⑤
⑧
您最近半年使用:0次
解题方法
3 . 下列除杂方法或对应方程式错误的是
| 选项 | 物质(杂质) | 除杂方法或试剂 | 方程式 |
| A | 溶液 ( ( ) ) | 过量Fe,过滤 |  |
| B | 固体 ( ( ) ) | 水溶后通过量 ,结晶,过滤 ,结晶,过滤 | 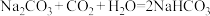 |
| C | 固体 ( ( ) ) | 水溶后加入过量NaOH |  |
| D |  ( ( ) ) | 过量Fe,过滤 |  |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
4 . 印刷电路板的制作原理是用FeCl3溶液腐蚀覆铜板上不需要的铜箔。下列说法错误的是
| A.Fe3+能溶解Cu,说明氧化性:Fe3+>Cu2+ |
| B.“腐蚀液”的颜色最终由黄色变为无色 |
| C.当有1mol电子转移时,溶液中Cu2+增加0.5mol |
D.该原理的离子方程式为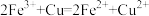 |
您最近半年使用:0次
名校
5 . 根据下列实验操作和现象得出的结论错误的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向稀硫酸酸化的FeSO4,溶液中滴入H2O2溶液 | 溶液变黄 | 氧化性:H2O2>Fe3+ |
| B | 向CO还原Fe2O3,所得到的产物中加入稀盐酸,再滴加KSCN溶液 | 溶液不变红 | Fe2O3一定已全部被CO还原 |
| C | 向NaCl溶液中滴入几滴AgNO3溶液,再加入氨水,振荡 | 先产生白色沉淀,加氨水后沉淀消失 | AgCl不溶于水,但可溶于氨水 |
| D | 用pH试纸分别测定浓度均为0.1mol·L-1的CH3COONa溶液,NaNO2溶液的pH | 前者pH约为9,后者pH约为8 | Ka(CH3COOH)<Ka(HNO2) |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
6 . 铁是人类较早使用的金属之一,回答下列问题。
(1)下列所含铁元素只有还原性的物质是___________ (填字母)。
A.Fe B.FeCl3 C.FeSO4
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性,能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是___________ (填字母)。
A.药品美蓝发生还原反应 B.药品美蓝是还原剂 C.药品美蓝被还原
(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:___________ 。
(4)请设计实验检验在空气中放置的硫酸亚铁溶液已部分变质:___________ 。
(5)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。工业上湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。写出并配平该反应的离子方程式
、Cl-、H2O。写出并配平该反应的离子方程式___________ ;若反应过程中转移了0.3 mol电子,则还原产物的物质的量为___________ mol。
(1)下列所含铁元素只有还原性的物质是
A.Fe B.FeCl3 C.FeSO4
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性,能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是
A.药品美蓝发生还原反应 B.药品美蓝是还原剂 C.药品美蓝被还原
(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:
(4)请设计实验检验在空气中放置的硫酸亚铁溶液已部分变质:
(5)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。工业上湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。写出并配平该反应的离子方程式
、Cl-、H2O。写出并配平该反应的离子方程式
您最近半年使用:0次
名校
7 . 某实验小组以含铁污泥(主要成分为Fe2O3、FeO、Fe及杂质;杂质与酸不反应,且难溶于水)为原料,设计了如图两种不同的合成路线(部分步骤已略去),用于生产绿矾(FeSO4•7H2O)和柠檬酸铁铵。根据所学知识,回答下列问题:
① 时检验,溶液变红,写出反应的离子方程式
时检验,溶液变红,写出反应的离子方程式___________ 。
② 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因___________ 。
③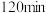 时检验,溶液复又变红,用离子方程式说明原因
时检验,溶液复又变红,用离子方程式说明原因___________ 。
(2)操作①的名称是___________ ,路线I中,加H2O2溶液的目的是(用离子方程式说明)___________ 。
(3)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是___________
(4)测定所得硫酸亚铁晶体中 的含量,步骤如下:
的含量,步骤如下:
Ⅰ:称取 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。
Ⅱ:取出 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入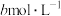 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液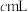 。
。
①计算硫酸亚铁晶体样品中 的质量分数
的质量分数___________ 。
②若配置硫酸亚铁溶液出现黄色,则测定结果___________ (填:偏高、偏低、不变)
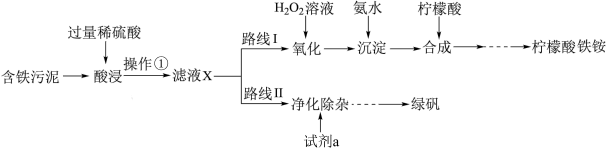
| 酸浸时间 |  |  | 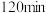 |
| 用KSCN溶液检验 | 变红 | 未变红 | 变红 |
 时检验,溶液变红,写出反应的离子方程式
时检验,溶液变红,写出反应的离子方程式②
 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因③
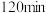 时检验,溶液复又变红,用离子方程式说明原因
时检验,溶液复又变红,用离子方程式说明原因(2)操作①的名称是
(3)实验室中配制FeSO4溶液时通常需加入少量的试剂a,目的是
(4)测定所得硫酸亚铁晶体中
 的含量,步骤如下:
的含量,步骤如下:Ⅰ:称取
 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。Ⅱ:取出
 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入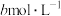 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液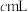 。
。①计算硫酸亚铁晶体样品中
 的质量分数
的质量分数②若配置硫酸亚铁溶液出现黄色,则测定结果
您最近半年使用:0次
名校
8 . 下列物质的用途或者制备中所涉及到的离子方程式书写正确的是
| 选项 | 用途或者制备 | 离子方程式 |
| A | 往饱和碳酸钠溶液中通入CO2 |  +CO2+H2O=2 +CO2+H2O=2 |
| B | 实验室用大理石与稀盐酸反应制备二氧化碳 |  +2H+=H2O+CO2↑ +2H+=H2O+CO2↑ |
| C | 用氢氧化钠溶液吸收氯气 | Cl2+2OH-=Cl-+ClO-+H2O |
| D | 用氯化铁溶液刻蚀铜板 | Fe3++Cu=Fe2++Cu2+ |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
9 .  是制造微电子器件、光电子器件的新型半导体材料。综合利用炼锌矿渣{主要含铁酸镓
是制造微电子器件、光电子器件的新型半导体材料。综合利用炼锌矿渣{主要含铁酸镓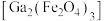 、铁酸锌
、铁酸锌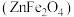 ,还含少量
,还含少量 及一些难溶于酸的物质}获得金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如图。
及一些难溶于酸的物质}获得金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如图。 在酸性条件下不稳定,易转化为
在酸性条件下不稳定,易转化为 。
。
②常温下,“浸出液”中的金属离子对应的氢氧化物的溶度积常数如下表,离子浓度小于 时可视为沉淀完全。
时可视为沉淀完全。
③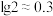 ,
,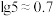 。
。
回答下列问题:
(1)写出两条加快“浸出”速率的措施:_____ 。
(2) 中铁元素的化合价为
中铁元素的化合价为_____ , 与稀硫酸反应的化学方程式为
与稀硫酸反应的化学方程式为_____
(3)“调 ”时需调节溶液
”时需调节溶液 的最小值为
的最小值为_____ 。
(4)“滤液1”中主要含有的金属阳离子为_____ ,检验“滤液1”中是否含有 的试剂为
的试剂为_____ (填名称)。
(5)“转化2”加入铁粉时主要发生反应的离子方程式为_____ 。
(6)“电解”反萃取液(溶质为 )制粗镓后的电解废液经处理后可循环使用,电解废液的主要溶质为
)制粗镓后的电解废液经处理后可循环使用,电解废液的主要溶质为_____ (填化学式)。
(7)采用MOCVD(金属有机化合物化学气相沉积)技术制备GaN时,反应会产生一种标准状况下密度约为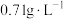 的可燃性气体,写出该反应的化学方程式:
的可燃性气体,写出该反应的化学方程式:_____ (不写条件)。
 是制造微电子器件、光电子器件的新型半导体材料。综合利用炼锌矿渣{主要含铁酸镓
是制造微电子器件、光电子器件的新型半导体材料。综合利用炼锌矿渣{主要含铁酸镓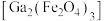 、铁酸锌
、铁酸锌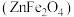 ,还含少量
,还含少量 及一些难溶于酸的物质}获得金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如图。
及一些难溶于酸的物质}获得金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如图。
 在酸性条件下不稳定,易转化为
在酸性条件下不稳定,易转化为 。
。②常温下,“浸出液”中的金属离子对应的氢氧化物的溶度积常数如下表,离子浓度小于
 时可视为沉淀完全。
时可视为沉淀完全。| 氢氧化物 |  |  |  |  |
 |  |  | 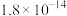 | 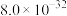 |
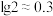 ,
,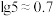 。
。回答下列问题:
(1)写出两条加快“浸出”速率的措施:
(2)
 中铁元素的化合价为
中铁元素的化合价为 与稀硫酸反应的化学方程式为
与稀硫酸反应的化学方程式为(3)“调
 ”时需调节溶液
”时需调节溶液 的最小值为
的最小值为(4)“滤液1”中主要含有的金属阳离子为
 的试剂为
的试剂为(5)“转化2”加入铁粉时主要发生反应的离子方程式为
(6)“电解”反萃取液(溶质为
 )制粗镓后的电解废液经处理后可循环使用,电解废液的主要溶质为
)制粗镓后的电解废液经处理后可循环使用,电解废液的主要溶质为(7)采用MOCVD(金属有机化合物化学气相沉积)技术制备GaN时,反应会产生一种标准状况下密度约为
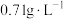 的可燃性气体,写出该反应的化学方程式:
的可燃性气体,写出该反应的化学方程式:
您最近半年使用:0次
10 . 根据下列图示的操作及对应的现象,不能得出相应结论的是
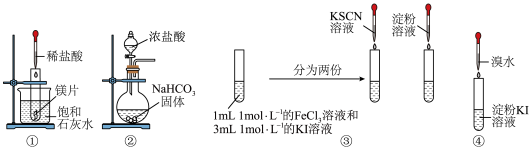
选项 | 操作 | 现象 | 结论 |
A | ① | 饱和石灰水变浑浊 | 镁与盐酸的反应是放热反应 |
B | ② | 硅酸钠溶液变浑浊 | 碳酸的酸性强于硅酸 |
C | ③ | 滴入KSCN溶液变红色,滴入淀粉溶液变蓝色 |  是可逆反应 是可逆反应 |
D | ④ | 淀粉KI溶液变蓝色 | 溴的得电子能力强于碘 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次



