解题方法
1 . 下列实验操作和现象不能推出相应结论的是
| 选项 | 实验操作和现象 | 结论 |
| A | 常温下向相同物质的量浓度的NaCl和NaBr的混合溶液中滴入少量 溶液,产生淡黄色沉淀 溶液,产生淡黄色沉淀 |  |
| B | 常温下测得 溶液的pH约为5 溶液的pH约为5 |  |
| C | 将 溶液加入 溶液加入 溶液中,有白色沉淀生成 溶液中,有白色沉淀生成 |  结合 结合 能力比 能力比 强 强 |
| D | 向某钾盐中滴加浓盐酸,产生的气体通入品红溶液,品红溶液褪色 | 该钾盐为 或 或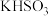 或二者混合物 或二者混合物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
2 . 下列反应对应的离子方程式正确的是
A.硫酸铜溶液使PbS转变为更难溶的CuS: |
B.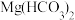 溶液中加足量的烧碱液: 溶液中加足量的烧碱液: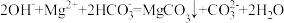 |
C.漂白粉溶液吸收少量二氧化硫气体: |
D.双氧水与酸性高锰酸钾溶液反应: |
您最近一年使用:0次
2021-05-15更新
|
592次组卷
|
3卷引用:湖南省衡阳市2021届高中毕业联考(二)(二模)化学试题
湖南省衡阳市2021届高中毕业联考(二)(二模)化学试题(已下线)专题04 离子反应-2022年高考化学二轮复习重点专题常考点突破练福建省厦外石狮分校、泉港一中两校联考2022-2023学年高三上学期第二次月考化学试题
解题方法
3 . 铍有“超级金属”之称,是航天、航空、电子和核工业等领域不可替代的材料。以绿柱石[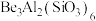 ]为原料制备金属铍的工艺如下:
]为原料制备金属铍的工艺如下:

已知: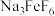 难溶于水,
难溶于水, 可与过量
可与过量 结合成
结合成 。
。
回答下列问题:
(1)“操作1”的目的是使烧结的固体在水浸过程有较大的接触面积,则其名称是___________ 。
(2)烧结时;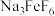 与绿柱石作用除生成易溶于水的
与绿柱石作用除生成易溶于水的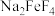 外,还有铁、铝、硅的氧化物,该反应的化学方程式为
外,还有铁、铝、硅的氧化物,该反应的化学方程式为___________ 。“滤渣1”中的酸性氧化物是___________ 。
(3)“过滤1”的滤液中需加入适量NaOH生成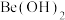 沉淀,但NaOH不能过量,原因是
沉淀,但NaOH不能过量,原因是___________ (用离子方程式表示)。
(4)已知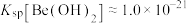 ,室温下
,室温下 恰好完全沉淀时[此时
恰好完全沉淀时[此时 浓度为
浓度为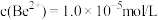 ]的
]的
___________ 。
(5) 在熔融状态下不能导电,工业上用电解
在熔融状态下不能导电,工业上用电解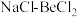 熔融混合物制备金属铍,可选用镍坩埚作电解槽的
熔融混合物制备金属铍,可选用镍坩埚作电解槽的___________ (填“阳极”或“阴极”)材料,电解总反应的化学方程式为___________ ;加入NaCl的主要目的是___________ 。
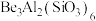 ]为原料制备金属铍的工艺如下:
]为原料制备金属铍的工艺如下:
已知:
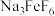 难溶于水,
难溶于水, 可与过量
可与过量 结合成
结合成 。
。回答下列问题:
(1)“操作1”的目的是使烧结的固体在水浸过程有较大的接触面积,则其名称是
(2)烧结时;
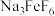 与绿柱石作用除生成易溶于水的
与绿柱石作用除生成易溶于水的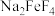 外,还有铁、铝、硅的氧化物,该反应的化学方程式为
外,还有铁、铝、硅的氧化物,该反应的化学方程式为(3)“过滤1”的滤液中需加入适量NaOH生成
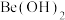 沉淀,但NaOH不能过量,原因是
沉淀,但NaOH不能过量,原因是(4)已知
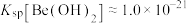 ,室温下
,室温下 恰好完全沉淀时[此时
恰好完全沉淀时[此时 浓度为
浓度为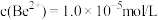 ]的
]的
(5)
 在熔融状态下不能导电,工业上用电解
在熔融状态下不能导电,工业上用电解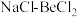 熔融混合物制备金属铍,可选用镍坩埚作电解槽的
熔融混合物制备金属铍,可选用镍坩埚作电解槽的
您最近一年使用:0次
2021-05-15更新
|
402次组卷
|
2卷引用:湖南省长沙同升湖实验学校2021-2022学年高三上学期第二次月考化学试题
4 . 钪(Sc)是一种三价金属元素,主要用于生产合金。“赤泥”是铝土矿加工过程中的废料,赤泥中各成分的含量如下表所示:
一种从其中获得氧化钪和钛白粉(TiO2)的生产工艺流程如下图所示:

(1)加快“浸取”时浸取速率的措施有_____ (任写一种),滤渣的主要成分是_____ 、_____ 。
(2)钪的萃取率(E%)与O/A值[萃取剂体积(O)和酸液体积(A)之比]的关系如图,应选择的合适O/A值为_____ 。

(3)反萃取时,Sc3+完全沉淀(浓度为1.0×10-6)时,反萃液的pH为_____ 。 (已知: ,lg2=0.30,结果保留小数点后2位有效数字)
,lg2=0.30,结果保留小数点后2位有效数字)
(4)写出Sc2(C2O4)3在空气中高温分解的化学方程式_____ 。
(5)在Ti2+水解过程中,加水稀释的目的:_____ 。
(6)设计“萃取”和“反萃取”的操作的目的是_____ 。
| 成分 | SiO2 | Al2O3 | Fe2O3 | TiO2 | Na2O | CaO | Sc2O2 | 其他 |
| 含量/% | 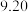 | 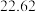 |  |  |  |  |  |  |

(1)加快“浸取”时浸取速率的措施有
(2)钪的萃取率(E%)与O/A值[萃取剂体积(O)和酸液体积(A)之比]的关系如图,应选择的合适O/A值为

(3)反萃取时,Sc3+完全沉淀(浓度为1.0×10-6)时,反萃液的pH为
 ,lg2=0.30,结果保留小数点后2位有效数字)
,lg2=0.30,结果保留小数点后2位有效数字)(4)写出Sc2(C2O4)3在空气中高温分解的化学方程式
(5)在Ti2+水解过程中,加水稀释的目的:
(6)设计“萃取”和“反萃取”的操作的目的是
您最近一年使用:0次
解题方法
5 . 下列实验操作、现象解释或结论都正确的是
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A |  片与足量浓硫酸加热反应,冷却后,再将冷水缓慢加入盛有反应混合物的烧杯中 片与足量浓硫酸加热反应,冷却后,再将冷水缓慢加入盛有反应混合物的烧杯中 | 溶液变蓝 | 证明反应生成 |
| B | 用一束光照射纳米铜的水溶液 | 具有丁达尔效应 | 纳米铜的直径约为10nm,纳米铜是一种固溶胶 |
| C | 向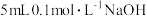 溶液中滴入 溶液中滴入 滴 滴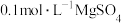 溶液,再滴加 溶液,再滴加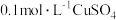 溶液 溶液 | 先有白色沉淀生成,后有蓝色沉淀生成 | 不能证明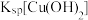 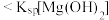 |
| D | 溶有 的 的 溶液中通入气体 溶液中通入气体 | 有白色沉淀生成 |  可能是 可能是 或 或 等 等 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 往含 和
和 的稀溶液中滴入
的稀溶液中滴入 溶液,产生沉淀的质量
溶液,产生沉淀的质量 (沉淀)与加入
(沉淀)与加入 溶液体积的关系如图所示。已知:
溶液体积的关系如图所示。已知: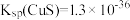 ,
,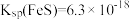 。则原溶液中
。则原溶液中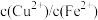 比值为
比值为
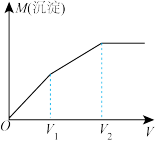
 和
和 的稀溶液中滴入
的稀溶液中滴入 溶液,产生沉淀的质量
溶液,产生沉淀的质量 (沉淀)与加入
(沉淀)与加入 溶液体积的关系如图所示。已知:
溶液体积的关系如图所示。已知: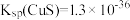 ,
,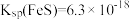 。则原溶液中
。则原溶液中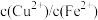 比值为
比值为
A.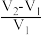 | B.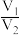 | C.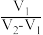 | D.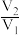 |
您最近一年使用:0次
7 . 为缓解新能源产业带来的用锂压力,某公司设计了从某含锂的电解铝废渣(主要成分有AlF3、NaF、LiF、CaO、SiO2等)中提取制备碳酸锂及合成冰晶石(Na3AIF6)的生产工艺。工艺流程如图:

回答下列问题:
(1)“酸浸”时AIF3发生反应的化学方程式为___ ,能提高“酸浸”时反应速率的方法有__ (任写一条)。
(2)“碱解反应”时,不同碳酸钠浓度下溶液中锂、铝浓度的变化如表,当碳酸钠浓度为__ mol/L时脱铝效果最好,且锂的损失相对较小。随着溶液中碳酸钠浓度的增大,溶液中Al质量浓度增大的原因是___ 。
(3)“苛化反应”中存在如下平衡:Li2CO3(s)+Ca2+(aq) 2Li+(aq)+CaCO3(s),通过计算说明该反应能否进行完全
2Li+(aq)+CaCO3(s),通过计算说明该反应能否进行完全__ 。
[已知:Ksp(Li2CO3)=8.75×10-4,Ksp(CaCO3)=2.5×10-9]
(4)“合成”冰晶石的化学方程式为___ 。

回答下列问题:
(1)“酸浸”时AIF3发生反应的化学方程式为
(2)“碱解反应”时,不同碳酸钠浓度下溶液中锂、铝浓度的变化如表,当碳酸钠浓度为
| 碳酸钠浓度/(mol/L) | 1.0 | 2.0 | 3.0 | 4.0 | 5.0 |
| 溶液中Al质量浓度/(g/L) | 0.432 | 0.360 | 0.200 | 0.272 | 0.350 |
| 溶液中Li质量浓度/(g/L) | 0.083 | 0.072 | 0.060 | 0.065 | 0.070 |
 2Li+(aq)+CaCO3(s),通过计算说明该反应能否进行完全
2Li+(aq)+CaCO3(s),通过计算说明该反应能否进行完全[已知:Ksp(Li2CO3)=8.75×10-4,Ksp(CaCO3)=2.5×10-9]
(4)“合成”冰晶石的化学方程式为
您最近一年使用:0次
2021-05-13更新
|
368次组卷
|
3卷引用:湖南省郴州市宜章县第一中学2021-2022学年高三下学期4月月考化学试题
湖南省郴州市宜章县第一中学2021-2022学年高三下学期4月月考化学试题山东省滨州市2021届高三第二次模拟考试化学试题(已下线)专题16 工艺流程综合题-备战2022年高考化学真题及地市好题专项集训【山东专用】
名校
解题方法
8 . 工业上利用锌焙砂(主要含ZnO、ZnFe2O4还含有少量FeO、CuO等)湿法制取金属锌的流程如图所示。
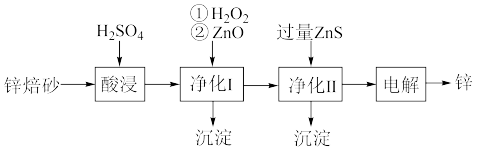
下列说法错误的是

下列说法错误的是
| A.ZnFe2O4溶于硫酸的离子方程式:ZnFe2O4+8H+=Zn2++2Fe3++4H2O |
| B.加入ZnO的目的是调节溶液的pH以除去溶液中的Fe3+ |
| C.加过量ZnS可除去溶液中的Cu2+是利用了Ksp(ZnS)>Ksp(CuS) |
| D.为加快反应速率,净化I和净化II均应在较高的温度下进行 |
您最近一年使用:0次
2021-05-13更新
|
1305次组卷
|
12卷引用:湖南省长沙市长郡中学2022-2023学年高三第三次月考化学试题
湖南省长沙市长郡中学2022-2023学年高三第三次月考化学试题山东省烟台市2021届高三5月二模化学试题(已下线)作业10 沉淀溶解平衡-2021年高二化学暑假作业(人教版2019)河南省新乡名校2020-2021学年高二下学期期末联考化学试题(已下线)专题讲座(八) 无机化工流程题的解题策略(精练)-2022年高考化学一轮复习讲练测(已下线)专题12 工艺流程选择题-备战2022年高考化学真题及地市好题专项集训【山东专用】内蒙古通辽和市赤峰市部分学校联考2021-2022学年高三上学期10月联考质量检测化学试题(已下线)必考点08 沉淀溶解平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)安徽省六安市第一中学2022届高三上学期第三次月考化学试题(已下线)2022年山东省高考真题变式题(不定项选择题)第三章 综合拔高练黑龙江省大庆实验中学实验二部2023-2024学年高二上学期 期中化学试卷
9 . 常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如图所示(不考虑 的水解)。下列叙述错误的是
的水解)。下列叙述错误的是

 的水解)。下列叙述错误的是
的水解)。下列叙述错误的是
| A.Ksp(Ag2C2O4)的数量级等于10-10 |
| B.a点表示Ag2C2O4的不饱和溶液 |
C.向c(Cl-)=c( )的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀 )的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀 |
D.Ag2C2O4(s)+2Cl-(aq) ⇌2AgCl(s)+ (aq)的平衡常数K=109.04 (aq)的平衡常数K=109.04 |
您最近一年使用:0次
2021-05-12更新
|
311次组卷
|
3卷引用:湖南省部分校2021-2022学年高二上学期12月联考化学试题
湖南省部分校2021-2022学年高二上学期12月联考化学试题湖南省武冈市第一中学2021-2022学年上学期高二11月月考化学试题(已下线)押山东卷第15题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(山东卷)
10 . 已知pCa=-lgc(Ca2+),Ksp(CaSO4)=9.0×10-6,Ksp(CaCO3)=2.8×10-9,向10 mLCaCl2溶液中滴加0.1 mol·L-1的Na2SO4溶液时,溶液中pCa与滴加Na2SO4溶液体积(V)的关系如图所示(实线),下列有关说法正确的是(已知lg3=0.48)
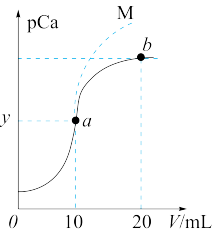

| A.y为3.48 |
| B.a与b两点对应溶液中c(Ca2+)之比为100:9 |
| C.原CaCl2溶液浓度为1 mol·L-1 |
| D.若把0.1 mol·L-1的Na2SO4溶液换成0.1 mol·L-1的Na2CO3溶液,则图象变化如曲线M所示 |
您最近一年使用:0次



