解题方法
1 . 锂离子电池是一种非常重要的储能技术,广泛应用于便携电子设备上,将锂离子电池废料进行处理并进行综合利用是十分重要的研究课题,不仅节约资源,还能减少锂离子电池废料对环境的危害。锂离子电池的正极铝钴膜主要含有LiCoO2、Al等,处理该废料并制取Co单质的一种工艺如下图所示:
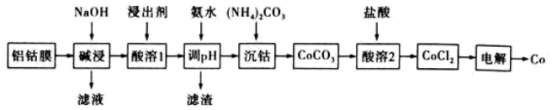
已知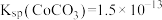 。回答下列问题:
。回答下列问题:
(1)提高“碱浸”速率的措施有_______ (任写一条)。
(2)“酸溶1”时不同的浸出剂,钴的浸出率如下表:
浸出剂①中HCl与浸出剂③的作用均为_______ 。浸出剂①的浸出率最高,而工业上一般不选用浸出剂①,其原因为_______ ,选用浸出剂③时,温度不宜过高,其理由为_______ 。
(3)氨水调节pH后所得滤渣主要为_______ 。
(4)“沉钴”的离子方程式为_______ ,“沉钴”时若溶液中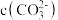 为
为 ,则此时溶液中的
,则此时溶液中的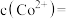
_______ 。
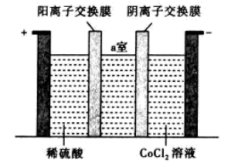
(5)“电解”时装置如图所示,阳极电极反应式为_______ ,电解后a室中的电解质溶液可以返回_______ 环节循环使用。

已知
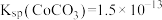 。回答下列问题:
。回答下列问题:(1)提高“碱浸”速率的措施有
(2)“酸溶1”时不同的浸出剂,钴的浸出率如下表:
| 浸出剂 | 钴浸出率% |
| ①HCl | 98.4 |
| ②H2SO4 | 72.3 |
③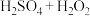 | 98.1 |
浸出剂①中HCl与浸出剂③的作用均为
(3)氨水调节pH后所得滤渣主要为
(4)“沉钴”的离子方程式为
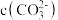 为
为 ,则此时溶液中的
,则此时溶液中的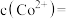
(5)“电解”时装置如图所示,阳极电极反应式为

您最近一年使用:0次
名校
2 . 已知:乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.4×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH__ 。(填“大”“小”或“相等”)
(2)常温下将0.1 mol/L的KOH溶液10mL与0.1 mol/L的草酸溶液10mL混合,若混合溶液显酸性,则混合后溶液中阴离子浓度的大小顺序为__ 。
(3)25℃时,向20 mL碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol/L的草酸钾溶液10mL后,能否产生沉淀(写出计算过程)__________ 。
(1)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH
(2)常温下将0.1 mol/L的KOH溶液10mL与0.1 mol/L的草酸溶液10mL混合,若混合溶液显酸性,则混合后溶液中阴离子浓度的大小顺序为
(3)25℃时,向20 mL碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol/L的草酸钾溶液10mL后,能否产生沉淀(写出计算过程)
您最近一年使用:0次
名校
3 . 黄铁矿(主要成分FeS2),在空气中会被缓慢氧化,氧化过程如图所示。下列说法不正确的是


| A.发生反应a时,0.05 mol FeS2被氧化时消耗标准状况下氧气的体积大约3.92 L |
| B.为了验证b过程反应后溶液中含Fe2+,可选用KSCN溶液和氯水 |
C.c发生反应的离子方程式为:14Fe3++FeS2+8H2O=15Fe2++2 +16H+ +16H+ |
| D.已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,则该温度下d反应的逆反应的平衡常数为K=2.79×103 |
您最近一年使用:0次
4 . 综合利用炼锌矿渣(主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4)获得3种金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如图。
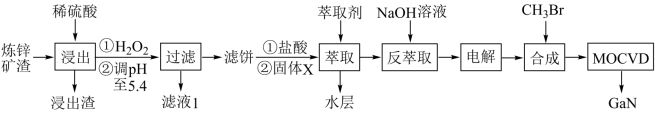
已知:①常温下,浸出液中各离子的浓度及其开始形成氢氧化物沉淀的pH如表。
②金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)如表。
(1)为提高浸出率,可采用的方法是____ (填一种方法即可),“浸出”时Ga2(Fe2O4)3发生反应的化学方程式为___ 。
(2)加入稀硫酸浸出后将pH调至5.4,目的是____ ;滤液1中主要溶质是____ (写化学式)。
(3)Ga与Al同主族,化学性质相似。反萃取时镓元素发生反应的离子方程式为____ 。
(4)电解过程包括电解反萃取液制粗镓和粗镓精炼两个步骤。精炼时,以粗镓为阳极,以NaOH溶液为电解液,阴极的电极反应为____ 。
(5)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以合成的三甲基镓[Ga(CH3)3]为原料,使其与NH3发生反应得到GaN和另一种气态产物,该过程的化学方程式为____ 。
(6)滤液1中残余的Fe3+的浓度为___ 。

已知:①常温下,浸出液中各离子的浓度及其开始形成氢氧化物沉淀的pH如表。
| 金属离子 | 浓度(mol•L-1) | 开始沉淀pH |
| Fe2+ | 1.0×10-3 | 8.0 |
| Fe3+ | 4.0×10-2 | 1.7 |
| Zn2+ | 1.5 | 5.5 |
| Ga3+ | 3.0×10-3 | 3.0 |
| 金属离子 | 萃取率(%) |
| Fe2+ | 0 |
| Fe3+ | 99 |
| Zn2+ | 0 |
| Ga3+ | 97~98.5 |
(2)加入稀硫酸浸出后将pH调至5.4,目的是
(3)Ga与Al同主族,化学性质相似。反萃取时镓元素发生反应的离子方程式为
(4)电解过程包括电解反萃取液制粗镓和粗镓精炼两个步骤。精炼时,以粗镓为阳极,以NaOH溶液为电解液,阴极的电极反应为
(5)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以合成的三甲基镓[Ga(CH3)3]为原料,使其与NH3发生反应得到GaN和另一种气态产物,该过程的化学方程式为
(6)滤液1中残余的Fe3+的浓度为
您最近一年使用:0次
2021-03-24更新
|
733次组卷
|
2卷引用:2021年湖南省高考化学试卷变式题11-19
名校
解题方法
5 . 为解决国家“973计划”中钒、铬资源的利用问题,2013年6月攀钢成立“钒铬渣分离提取钒铬技术研究”课题组,2020年5月课题组公布了提取钒铬的工艺流程:
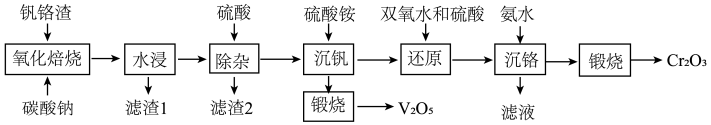
已知:
①钒铬渣中含有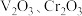 ,及
,及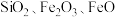 等;
等;
② 时,
时, 的溶度积常数为
的溶度积常数为 ;
;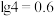 。
。
回答下列问题:
(1)“氧化焙烧”时,钒铬渣中化合价发生变化的元素为铬及______ (用元素名称表示)。
(2)为加快“水浸”速率,可采取的措施为______ (写出一种即可)。
(3)“除杂”产生的滤渣2的成分是______ (用化学式表示)。
(4)写出“煅烧”时反应的化学方程式______ (已知“沉钒”时析出正五价钒的含氧酸铵盐)。
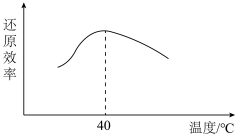
(5)“还原”溶液中的 时发生反应的离子方程式为
时发生反应的离子方程式为______ ,已知双氧水还原 的效率与温度的关系如图,分析
的效率与温度的关系如图,分析 时,双氧水还原效率最高的原因
时,双氧水还原效率最高的原因______ 。
(6)“沉铬”过程中,含铬元素的离子刚好完全沉淀时,溶液的pH=______ (已知溶液中离子浓度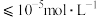 时认为已完全沉淀)。
时认为已完全沉淀)。

已知:
①钒铬渣中含有
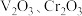 ,及
,及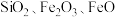 等;
等;②
 时,
时, 的溶度积常数为
的溶度积常数为 ;
; 。
。回答下列问题:
(1)“氧化焙烧”时,钒铬渣中化合价发生变化的元素为铬及
(2)为加快“水浸”速率,可采取的措施为
(3)“除杂”产生的滤渣2的成分是
(4)写出“煅烧”时反应的化学方程式
(5)“还原”溶液中的
 时发生反应的离子方程式为
时发生反应的离子方程式为 的效率与温度的关系如图,分析
的效率与温度的关系如图,分析 时,双氧水还原效率最高的原因
时,双氧水还原效率最高的原因(6)“沉铬”过程中,含铬元素的离子刚好完全沉淀时,溶液的pH=
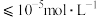 时认为已完全沉淀)。
时认为已完全沉淀)。
您最近一年使用:0次
2021-03-20更新
|
1906次组卷
|
10卷引用:湖南省衡阳市衡阳县第一中学2021-2022学年高三下学期期中考试化学试题
湖南省衡阳市衡阳县第一中学2021-2022学年高三下学期期中考试化学试题广东省肇庆市2021届高三第二次统一测试(二模)化学试题(已下线)押山东卷第16题 化工流程综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)微专题18 金属及其化合物制备流程(V)-备战2022年高考化学考点微专题(已下线)微专题18 金属及其化合物制备流程(Cr)-备战2022年高考化学考点微专题2021年辽宁高考化学试题变式题11-19河北省石家庄市第二中学西校区2021-2022学年高三下学期4月月考化学试题江西省九江第一中学2021-2022学年高二下学期5月月考化学试题(已下线)2022年全国甲卷高考真题变式题(非选择题)甘肃省张掖市2022-2023学年高三上学期第一次诊断考试化学试题
名校
解题方法
6 . 锰的重要用途是制造锰钢.一种以高铁锰矿(含MnO2、Fe2O3及少量FeO、CaO、K2O、Na2O)为原料生产金属锰的工艺流程如图:

回答下列问题:
(1)“焙烧还原”时,高铁锰矿中MnO2被还原为MnO。
①理论上,还能被还原的成分有__ 、__ (填化学式)。
②根据表中数据,焙烧时应选择的温度为__ 。
(2)“浸出”产生“滤渣”的主要成分为___ (填化学式);该步骤中需再加入MnSO4以促进“滤渣”析出,结合化学反应原理解释其原因:___ 。
(3)“除杂”时,加入的MnO2将Fe2+氧化为Fe3+,其离子方程式为___ ;再将pH逐步调至6,Fe3+水解为Fe(OH)3,同时Fe3+与Na+、K+形成络合物沉淀。
(4)电解“净化”所得溶液(MnSO4的酸性溶液)制备Mn。
①电解时,溶液中的阳离子在阴极存在两个相互竞争的电极反应,其产物分别为Mn和__ (填化学式)。
②研究表明,加入适量的SeO2有利于Mn在电极上析出.机理为:SeO2与水反应生成的H2SeO3(二元弱酸)在阴极放电生成Se单质,该电极反应为__ ;电极上的Se对Mn2+有特殊的吸附性能,使Mn2+的电还原沉积成为主要反应。
③电解废液可在上述流程的___ 步骤中循环使用。

回答下列问题:
(1)“焙烧还原”时,高铁锰矿中MnO2被还原为MnO。
①理论上,还能被还原的成分有
②根据表中数据,焙烧时应选择的温度为
| 还原温度/℃ | 焙烧后Mn元素在主要含锰物质中的分布/% | ||
| MnO2 | 高价锰(MnxOy) | 低价锰(MnO) | |
| 600 800 1000 1100 1200 | 40.92 10.56 5.77 痕量 痕量 | 34.76 6.63 2.70 0.46 0.30 | 24.32 82.81 91.29 98.76 97.94 |
(3)“除杂”时,加入的MnO2将Fe2+氧化为Fe3+,其离子方程式为
(4)电解“净化”所得溶液(MnSO4的酸性溶液)制备Mn。
①电解时,溶液中的阳离子在阴极存在两个相互竞争的电极反应,其产物分别为Mn和
②研究表明,加入适量的SeO2有利于Mn在电极上析出.机理为:SeO2与水反应生成的H2SeO3(二元弱酸)在阴极放电生成Se单质,该电极反应为
③电解废液可在上述流程的
您最近一年使用:0次
2021-03-19更新
|
946次组卷
|
4卷引用:湖南省长沙市第一中学2021届高三第一次模拟考试化学试题
湖南省长沙市第一中学2021届高三第一次模拟考试化学试题广东省深圳市2021届高三下学期第一次调研考试化学试题(已下线)押山东卷第16题 化工流程综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)第18周 周测卷-备战2022年高考化学周测与晚练(新高考专用)
名校
解题方法
7 . 以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaFe3(SO4)2(OH)6]和纳米镍粉的部分工艺流程如图:
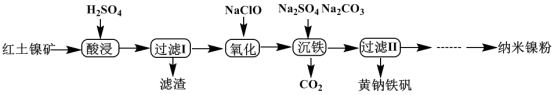
已知:Fe3+在pH约为3.7时可完全转化为Fe(OH)3,Fe2+在pH约为9时可完全转化为Fe(OH)2
下列说法错误的是

已知:Fe3+在pH约为3.7时可完全转化为Fe(OH)3,Fe2+在pH约为9时可完全转化为Fe(OH)2
下列说法错误的是
| A.“滤渣”的主要成分是SiO2 |
| B.为提高镍、铁元素的利用率,可将“过滤I”的滤液和滤渣洗涤液合并 |
| C.“氧化”过程发生的离子方程式为2H++2Fe2++ClO-=2Fe3++Cl-+H2O |
| D.“沉铁”过程中加入碳酸钠的作用是调节溶液的酸碱度,应将pH控制在3.7~9 |
您最近一年使用:0次
2021-03-18更新
|
1178次组卷
|
6卷引用:湖南省郴州市永兴县第一中学2021-2022学年高三下学期期中考试化学试题
湖南省郴州市永兴县第一中学2021-2022学年高三下学期期中考试化学试题湖北省八市2021届高三下学期(3月)联考化学试题(已下线)押山东卷第09题 化工生产流程选择题-备战2021年高考化学临考题号押题(山东卷)(已下线)考向06 钠及其重要化合物-备战2022年高考化学一轮复习考点微专题安徽省蚌埠第三中学2021-2022学年高二下学期开学测试化学试题广西河池市高级中学2021-2022学年高三上学期第二次月考化学试题
名校
解题方法
8 . H2S在重金属离子处理、煤化工等领域都有重要应用。请回答:
I.H2S是煤化工原料气脱硫过程的重要中间体,反应原理为:
i.COS(g)+H2(g) ⇌H2S(g)+CO(g) ∆H=+7kJ·mol
ii.CO(g)+H2O(g) ⇌CO2(g)+H2(g) ∆H=-42kJ·mol
已知断裂1mol气态分子中的化学键所需能量如下表所示。
(1)计算表中x=_______ ;
(2)T℃时,向VL容积不变的密闭容器中充入1molCOS(g)、1molH2(g)和1molH2O(g),发生上述两个反应。
①在T℃时测得平衡体系中COS为0.80mol,H2为0.85mol,则T℃时反应ⅰ的平衡常数K=____ (保留2位有效数字);
②上述反应达平衡后,若升高温度,则CO的平衡体积分数___ (填“增大”、“减小”或“不变”),其理由是___ ;
II.H2S在高温下分解制取H2,同时生成硫蒸气。
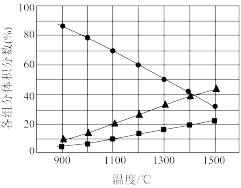
(3)向2L密闭容器中加入0.2molH2S,反应在不同温度(900~1500℃)下达到平衡时,混合气体中各组分的体积分数如下图所示,则在此温度区间内,H2S分解反应的主要化学方程式为__ ;在1300℃,反应经2min达到平衡,则0~2min的反应速率v(H2S)=___ 。
III.H2S用作重金属离子的沉淀剂。
(4)25℃时,向浓度均为0.001mol·L-1Sn2+和Ag+的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Ag+)=__ (已知:25℃时,Ksp(SnS)=1.0×10-25,Ksp(Ag2S)=1.6×10-49)。
I.H2S是煤化工原料气脱硫过程的重要中间体,反应原理为:
i.COS(g)+H2(g) ⇌H2S(g)+CO(g) ∆H=+7kJ·mol
ii.CO(g)+H2O(g) ⇌CO2(g)+H2(g) ∆H=-42kJ·mol
已知断裂1mol气态分子中的化学键所需能量如下表所示。
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) |
| 能量(kJ·mol-1) | 1310 | 442 | x | 669 |
(2)T℃时,向VL容积不变的密闭容器中充入1molCOS(g)、1molH2(g)和1molH2O(g),发生上述两个反应。
①在T℃时测得平衡体系中COS为0.80mol,H2为0.85mol,则T℃时反应ⅰ的平衡常数K=
②上述反应达平衡后,若升高温度,则CO的平衡体积分数
II.H2S在高温下分解制取H2,同时生成硫蒸气。
(3)向2L密闭容器中加入0.2molH2S,反应在不同温度(900~1500℃)下达到平衡时,混合气体中各组分的体积分数如下图所示,则在此温度区间内,H2S分解反应的主要化学方程式为

III.H2S用作重金属离子的沉淀剂。
(4)25℃时,向浓度均为0.001mol·L-1Sn2+和Ag+的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Ag+)=
您最近一年使用:0次
9 . 钛酸钡(BaTiO3)是电子陶瓷材料的基础原料,用于磁扩大器,电脑装置和计算机元件的制造,工业上生产钛酸钡的一种工艺流程如下:

已知:草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O。
(1)用盐酸酸浸时,当温度高于40℃时,浸出率急剧降低的主要原因是___________ ,常温下,若酸浸浸出液中c(Ba2+)=0.1 mol·L-1,则c(CO )在浸出液中的最大值为
)在浸出液中的最大值为___________ mol·L-1(已知常温下,BaCO3的溶度积Ksp=2.58×10-9)
(2)常温下,TiCl4为液体且极易水解,配制一定浓度的TiCl4溶液的方法是___________ 。
(3)加入H2C2O4溶液时,发生反应的化学方程式为___________ 。
(4)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。设计实验方案验证草酸氧化钛钡晶体是否洗涤干净?___________ 。
(5)高温煅烧草酸氧化钛钡晶体[BaTiO(C2O4)2·4H2O]得到BaTiO3的同时,生成高温气体产物有CO、___________ 。和___________ 。
(6)工业上还可利用固相合成法来制备BaTiO3,原理是将等物质的量的BaCO3和TiO2在1500℃下反应24h制备 BaTiO3,该反应的化学方程式为___________ 。

已知:草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O。
(1)用盐酸酸浸时,当温度高于40℃时,浸出率急剧降低的主要原因是
 )在浸出液中的最大值为
)在浸出液中的最大值为(2)常温下,TiCl4为液体且极易水解,配制一定浓度的TiCl4溶液的方法是
(3)加入H2C2O4溶液时,发生反应的化学方程式为
(4)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。设计实验方案验证草酸氧化钛钡晶体是否洗涤干净?
(5)高温煅烧草酸氧化钛钡晶体[BaTiO(C2O4)2·4H2O]得到BaTiO3的同时,生成高温气体产物有CO、
(6)工业上还可利用固相合成法来制备BaTiO3,原理是将等物质的量的BaCO3和TiO2在1500℃下反应24h制备 BaTiO3,该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
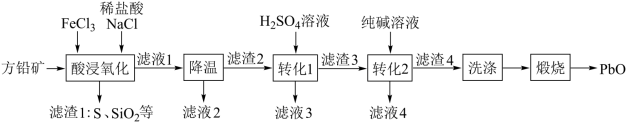
10 . 纳米级PbO是大规模集成电路(IC)制作过程中的关键性基础材料。一种以方铅矿(含PbS及少量Fe2O3、MgO、SiO2等)为原料制备PbO的工艺流程如图:
已知:[PbCl4]2-(aq) PbCl2(s)+2Cl-(aq) ΔH<0
PbCl2(s)+2Cl-(aq) ΔH<0
回答下列问题:
(1)“酸浸氧化”过程中被氧化的元素是:______ ,该过程需要加热,其目的是______ 。FeCl3与PbS发生反应生成[PbCl4]2-的离子方程式为______ 。
(2)检验滤液1中存在Fe2+,可取样后滴加少量______ 溶液(填化学式),观察到有蓝色沉淀析出。
(3)“降温”步骤中析出的晶体主要是______ (填化学式);滤液2中的金属阳离子有Na+、Fe3+、______ 。(填离子符号)
(4)要实现PbSO4转化为PbCO3,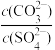 的最小值为
的最小值为______ 。(Ksp(PbCO3)=7.4×10-14、Ksp(PbSO4)=1.6×10-8)(保留两位有效数字)
(5)“煅烧”时,PbCO3发生反应的化学方程式为______ 。

已知:[PbCl4]2-(aq)
 PbCl2(s)+2Cl-(aq) ΔH<0
PbCl2(s)+2Cl-(aq) ΔH<0回答下列问题:
(1)“酸浸氧化”过程中被氧化的元素是:
(2)检验滤液1中存在Fe2+,可取样后滴加少量
(3)“降温”步骤中析出的晶体主要是
(4)要实现PbSO4转化为PbCO3,
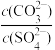 的最小值为
的最小值为(5)“煅烧”时,PbCO3发生反应的化学方程式为
您最近一年使用:0次
2021-03-13更新
|
704次组卷
|
3卷引用:湖南省岳阳市2021-2022学年高三教学质量监测(三)化学试题



