名校
解题方法
1 . 综合利用富钛废渣(含TiO2、ZnO、Fe2O3和少量有机物)制备锂离子电池正极材料中间体,并获得部分副产品的工艺流程如图:
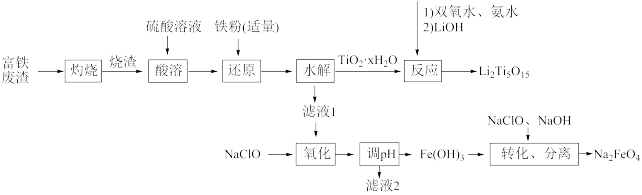
已知:Ksp[Zn(OH)2]=1.0×10-17、Ksp[Fe(OH)2]=1.0×10-16、Ksp[Fe(OH)3]=1.0×10-38,溶液中离子浓度≤10-5mol/L时认为该离子沉淀完全。回答下列问题:
(1)“灼烧”除去的物质为___ 。
(2)“还原”(避免水解产生其他杂质)中发生的主要离子反应为___ 。
(3)“酸溶”后钛以TiO2+形式存在,则“水解”反应的离子方程式为___ 。
(4)若“氧化”后所得溶液中金属离子的浓度均为0.1mol/L,则“调pH”的合理范围为___ 。
(5)“转化、分离”生成Na2FeO4,氧化剂与还原剂的物质的量之比为___ 。

已知:Ksp[Zn(OH)2]=1.0×10-17、Ksp[Fe(OH)2]=1.0×10-16、Ksp[Fe(OH)3]=1.0×10-38,溶液中离子浓度≤10-5mol/L时认为该离子沉淀完全。回答下列问题:
(1)“灼烧”除去的物质为
(2)“还原”(避免水解产生其他杂质)中发生的主要离子反应为
(3)“酸溶”后钛以TiO2+形式存在,则“水解”反应的离子方程式为
(4)若“氧化”后所得溶液中金属离子的浓度均为0.1mol/L,则“调pH”的合理范围为
(5)“转化、分离”生成Na2FeO4,氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
名校
解题方法
2 . 根据下列实验操作、现象得出的结论中,正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 灼烧白色粉末 | 火焰呈黄色 | 原粉末中有Na+无K+ |
| B | 镀锌铁出现刮痕后浸泡在食盐水中,后滴入K3[Fe(CN)6]溶液 | 无明显现象 | 该过程未发生氧化还原反应 |
| C | 在酸性KMnO4中,加入足量的Na2O2固体 | 溶液紫红色褪去,且产生大量气泡 | 氧化性:KMnO4>Na2O2 |
| D | 在5mL1mol/LNaOH溶液中滴入1mL1mol/LMgSO4溶液,再滴入1mol/LCuSO4溶液 | 先有白色沉淀生成后变为浅蓝色沉淀 | Cu(OH)2比Mg(OH)2更难溶 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . MnSO4是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有Fe3O4、FeO、CoO等)为原料制备MnSO4的工艺流程如图。
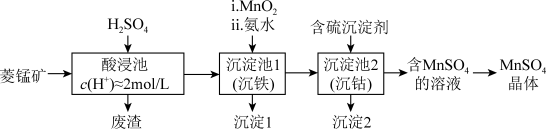
资料:金属离子沉淀的pH
(1)酸浸后所得溶液的金属阳离子包括Mn2+、Co2+、____________ 。
(2)沉淀池1中,先加MnO2充分反应后再加氨水。写出加MnO2时发生反应的离子方程式:_____________ 。
(3)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是_______ 。
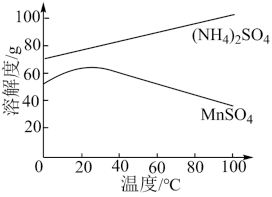
(4)图为MnSO4和(NH4)2SO4的溶解度曲线。从“含MnSO4的溶液”中提取“MnSO4晶体”的操作为_________ ,洗涤干燥。
(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下。
i.称取a g废渣,加酸将锰元素全部溶出成Mn2+,过滤,将滤液定容于100mL容量瓶中;
ii.取25.00 mL溶液于锥形瓶中,加入少量催化剂和过量(NH4)2S2O8溶液,加热、充分反应后,煮沸溶液使过量的(NH4)2S2O8分解。
iii.加入指示剂,用b mol/L (NH4)2Fe(SO4)2溶液滴定。滴定至终点时消耗 (NH4)2Fe(SO4)2溶液的体积为c mL,MnO4-重新变成Mn2+。
①补全步骤ⅱ中反应的离子方程式:__________ 。
2Mn2++ S2O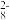 +_____ = MnO
+_____ = MnO + +__+
+ +__+
②废渣中锰元素的质量分数为________ 。
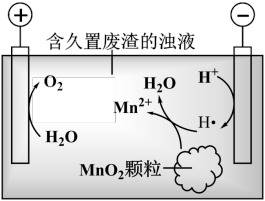
(6)废渣长期露置于空气,其中的锰元素逐渐转化为MnO2。研究者用下图装置提取MnO2中的锰元素。图中“H·”代表氢自由基。实验测得电解时间相同时,随外加电流的增大,溶液中的 先增大后减小,减小的原因可能是
先增大后减小,减小的原因可能是__________ (写出两条)。


资料:金属离子沉淀的pH
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Mn2+ |
| 开始沉淀 | 1.5 | 6.3 | 7.4 | 7.6 |
| 完全沉淀 | 2.8 | 8.3 | 9.4 | 10.2 |
(2)沉淀池1中,先加MnO2充分反应后再加氨水。写出加MnO2时发生反应的离子方程式:
(3)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是
(4)图为MnSO4和(NH4)2SO4的溶解度曲线。从“含MnSO4的溶液”中提取“MnSO4晶体”的操作为

(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下。
i.称取a g废渣,加酸将锰元素全部溶出成Mn2+,过滤,将滤液定容于100mL容量瓶中;
ii.取25.00 mL溶液于锥形瓶中,加入少量催化剂和过量(NH4)2S2O8溶液,加热、充分反应后,煮沸溶液使过量的(NH4)2S2O8分解。
iii.加入指示剂,用b mol/L (NH4)2Fe(SO4)2溶液滴定。滴定至终点时消耗 (NH4)2Fe(SO4)2溶液的体积为c mL,MnO4-重新变成Mn2+。
①补全步骤ⅱ中反应的离子方程式:
2Mn2++ S2O
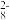 +_____ = MnO
+_____ = MnO + +__+
+ +__+ ②废渣中锰元素的质量分数为
(6)废渣长期露置于空气,其中的锰元素逐渐转化为MnO2。研究者用下图装置提取MnO2中的锰元素。图中“H·”代表氢自由基。实验测得电解时间相同时,随外加电流的增大,溶液中的
 先增大后减小,减小的原因可能是
先增大后减小,减小的原因可能是
您最近一年使用:0次
2021-05-20更新
|
878次组卷
|
11卷引用:湖南省武冈市第一中学2021-2022学年高三下学期5月月考化学试题
湖南省武冈市第一中学2021-2022学年高三下学期5月月考化学试题北京市海淀区2021届高三一模化学试题福建省厦门英才学校2021届高三4模考试化学试题河北省武邑中学2021届高考七模化学试题(已下线)微专题18 金属及其化合物制备流程(Mn)-备战2022年高考化学考点微专题北京市第一七一中学2021-2022学年高二上学期12月月考化学试题陕西省西安市长安区2021-2022学年高三上学期期末质量检测化学试题北京市顺义牛栏山第一中学2022-2023学年高二下学期3月月考化学试题北京市第一六六中学2023-2024学年高三上学期期中考试化学试题北京市中国人民大学附属中学2021-2022学年高三下学期开学考试化学试卷北京市第八中学2023-2024学年高三上学期12月月考化学试题
名校
4 . NiSO4·6H2O是一种绿色易溶于水的晶体,广泛应用于化学镀镍、生产电池、医药工业、催化行业以及印染工业等行业中。由一种废料(主要成分是铁镍合金,还含有铜、镁、硅的氧化物)为原料制取NiSO4·6H2O步骤如图:
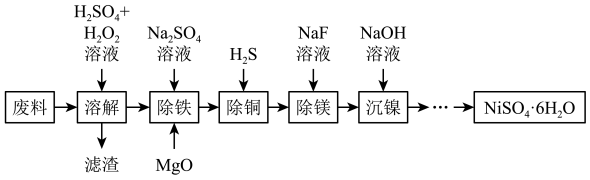
已知:①镍能溶于稀酸但溶解不完全,通常表现为+2价;
②常温下Ksp(MgF2)=6.4×10-9,Ka(HF)=6.3×10-4;
(1)NiSO4中阴离子的空间构型为___ 。
(2)“溶解”时加入H2O2溶液的目的是___ 。
(3)“除铁”时生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出其离子方程式___ 。
(4)向“除铜”后的滤液中加入NaF溶液,使Mg2+转化为MgF2沉淀除去。若溶液的pH偏低,将会导致MgF2沉淀不完全,其原因是___ 。
(5)“沉镍”后所得滤液中,可循环使用的主要溶质为___ (填化学式)。
(6)NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的化学方程式为___ 。
(7)在制备NiSO4·6H2O晶体时,常用无水乙醇代替蒸馏水做洗涤剂,原因是__ 。

已知:①镍能溶于稀酸但溶解不完全,通常表现为+2价;
②常温下Ksp(MgF2)=6.4×10-9,Ka(HF)=6.3×10-4;
(1)NiSO4中阴离子的空间构型为
(2)“溶解”时加入H2O2溶液的目的是
(3)“除铁”时生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出其离子方程式
(4)向“除铜”后的滤液中加入NaF溶液,使Mg2+转化为MgF2沉淀除去。若溶液的pH偏低,将会导致MgF2沉淀不完全,其原因是
(5)“沉镍”后所得滤液中,可循环使用的主要溶质为
(6)NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的化学方程式为
(7)在制备NiSO4·6H2O晶体时,常用无水乙醇代替蒸馏水做洗涤剂,原因是
您最近一年使用:0次
2021-05-20更新
|
239次组卷
|
2卷引用:湖南省娄底市第一中学2022届高三下学期第三次模拟考试化学试题
名校
5 . 通过佛尔哈德法可以测定三氯氧磷(POCl3)样品中Cl元素的含量,实验步骤如下:
Ⅰ.取mg样品于锥形瓶中,加入足量的NaOH溶液,待完全反应后加稀硝酸至溶液显酸性;
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液50.00mL,使Cl-完全沉淀;
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
Ⅳ.加入指示剂,用cmol·mol-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12。
下列说法正确的是
Ⅰ.取mg样品于锥形瓶中,加入足量的NaOH溶液,待完全反应后加稀硝酸至溶液显酸性;
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液50.00mL,使Cl-完全沉淀;
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
Ⅳ.加入指示剂,用cmol·mol-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12。
下列说法正确的是
| A.滴定选用的指示剂为甲基橙 |
B.本次实验测得Cl元素的质量分数为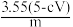 % % |
| C.硝基苯的作用为防止沉淀被氧化 |
| D.若取消步骤Ⅲ,测定结果偏大 |
您最近一年使用:0次
2021-05-20更新
|
689次组卷
|
4卷引用:湖南省娄底市第一中学2022届高三下学期第三次模拟考试化学试题
湖南省娄底市第一中学2022届高三下学期第三次模拟考试化学试题辽宁省葫芦岛市2021届高三第二次模拟考试化学试题(已下线)考点26 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)2023年高考山东卷化学真题变式题(选择题6-10)
名校
解题方法
6 . 室温下,通过下列实验探究NH4HCO3溶液的性质。
下列有关说法正确的是
| 实验 | 实验操作 | 实验现象 |
| 1 | 用pH试纸测定0.1mol·L-1NH4HCO3溶液的pH | pH约为8 |
| 2 | 向0.1mol·L-1NH4HCO3溶液中加入过量0.lmol·L-1Ba(OH)2溶液 | 析出白色沉淀 |
| 3 | 常温下,将等体积等物质的量浓度NH4HCO3与NaCl溶液混合 | 析出晶体 |
| 4 | 向0.1mol·L-1NH4HCO3溶液中加入0.lmol·L-1AlCl3溶液 | 有气泡产生 |
A.0.1mol·L-1NH4HCO3溶液中存在c(NH )+c(NH3·H2O)+c(H+)=c(HCO )+c(NH3·H2O)+c(H+)=c(HCO )+c(CO )+c(CO )+c(H2CO3)+c(OH-) )+c(H2CO3)+c(OH-) |
B.实验2反应静置后的上层清液中有c(Ba2+)·c(CO )<Ksp(BaCO3) )<Ksp(BaCO3) |
C.实验3静置后的上层清液中有c(H+)+c(NH )>c(OH-)+c(HCO )>c(OH-)+c(HCO )+2c(CO )+2c(CO ) ) |
| D.实验4中产生的气体是NH3 |
您最近一年使用:0次
2021-05-16更新
|
464次组卷
|
6卷引用:湖南省郴州市宜章县第一中学2021-2022学年高三下学期4月月考化学试题
解题方法
7 . 一种从废旧锂电池(主要含LiCoO2,及少量Al、Cu)中制备钴酸锂的工艺流程如下:
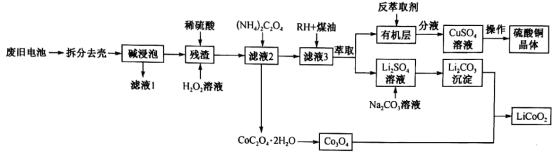
(1)碱浸泡用来除去废旧电池中的_________ ,为提高该物质的去除率可采取的措施有_______ (任写两条)。
(2)向“残渣”中加入稀硫酸和H2O2,放出大量气泡,写出LiCoO2与H2O2反应的化学方程式:_________ 。
(3)设溶液中c(Co2+)=0.1mol⋅L-1,为沉淀Co2+,向“滤液2”中加入 (NH4)2C2O4,而不用Na2C2O4。利用如下数据说明原因:________ 。[已知:25℃时0.1mol/L (NH4)2C2O4溶液pH约为6.4;0.1mol⋅L-1 Na2C2O4溶液pH约为8.35;Ksp[Co(OH)2]=6.0×10−13]
(4)H萃取Cu2+的原理可表示为:Cu2++2HR⇌CuR2+2H+。实验室进行萃取实验用到的两种玻璃仪器是______ 、_____ ;向有机层中加入反萃取剂
________ (填化学式)可将Cu2+反萃取至水层。

(5)已知Li2CO3溶解度随着温度变化曲线如图。加入Na2CO3溶液后应进行的操作是________ 。

(1)碱浸泡用来除去废旧电池中的
(2)向“残渣”中加入稀硫酸和H2O2,放出大量气泡,写出LiCoO2与H2O2反应的化学方程式:
(3)设溶液中c(Co2+)=0.1mol⋅L-1,为沉淀Co2+,向“滤液2”中加入 (NH4)2C2O4,而不用Na2C2O4。利用如下数据说明原因:
(4)H萃取Cu2+的原理可表示为:Cu2++2HR⇌CuR2+2H+。实验室进行萃取实验用到的两种玻璃仪器是

(5)已知Li2CO3溶解度随着温度变化曲线如图。加入Na2CO3溶液后应进行的操作是
您最近一年使用:0次
8 . 如图是以一种以绿柱石(主要含有BeO、 、
、 、
、 和FeO等)为原料制取单质铍的工艺流程。已知常温下,
和FeO等)为原料制取单质铍的工艺流程。已知常温下, 在pH>10时会溶解。下列相关说法错误的是
在pH>10时会溶解。下列相关说法错误的是

 、
、 、
、 和FeO等)为原料制取单质铍的工艺流程。已知常温下,
和FeO等)为原料制取单质铍的工艺流程。已知常温下, 在pH>10时会溶解。下列相关说法错误的是
在pH>10时会溶解。下列相关说法错误的是
A.“除铁”过程应先加适量 ,再加适量氨水调节pH ,再加适量氨水调节pH |
| B.“沉铍”过程中,氨水也可改用过量的NaOH溶液 |
C.其中“分解”过程中发生的反应之一可表示为 |
D.用镁热还原法制取铍时Ar气可以改为 |
您最近一年使用:0次
2021-05-15更新
|
482次组卷
|
2卷引用:湖南省衡阳市2021届高中毕业联考(二)(二模)化学试题
解题方法
9 . 下列实验操作和现象不能推出相应结论的是
| 选项 | 实验操作和现象 | 结论 |
| A | 常温下向相同物质的量浓度的NaCl和NaBr的混合溶液中滴入少量 溶液,产生淡黄色沉淀 溶液,产生淡黄色沉淀 |  |
| B | 常温下测得 溶液的pH约为5 溶液的pH约为5 |  |
| C | 将 溶液加入 溶液加入 溶液中,有白色沉淀生成 溶液中,有白色沉淀生成 |  结合 结合 能力比 能力比 强 强 |
| D | 向某钾盐中滴加浓盐酸,产生的气体通入品红溶液,品红溶液褪色 | 该钾盐为 或 或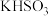 或二者混合物 或二者混合物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
10 . 下列反应对应的离子方程式正确的是
A.硫酸铜溶液使PbS转变为更难溶的CuS: |
B.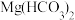 溶液中加足量的烧碱液: 溶液中加足量的烧碱液: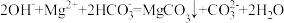 |
C.漂白粉溶液吸收少量二氧化硫气体: |
D.双氧水与酸性高锰酸钾溶液反应: |
您最近一年使用:0次
2021-05-15更新
|
592次组卷
|
3卷引用:湖南省衡阳市2021届高中毕业联考(二)(二模)化学试题
湖南省衡阳市2021届高中毕业联考(二)(二模)化学试题(已下线)专题04 离子反应-2022年高考化学二轮复习重点专题常考点突破练福建省厦外石狮分校、泉港一中两校联考2022-2023学年高三上学期第二次月考化学试题



