解题方法
1 . 回答下列问题
(1)已知:20℃时,Ksp(AgCl)=1.1×10-10,Ksp(AgBr)=2.0×10-13。将AgCl和AgBr的饱和溶液等体积混合,再逐滴加入足量浓AgNO3溶液,充分反应后,下列说法正确的是_______
(2)现向含AgBr的饱和溶液中:
①加入固体AgNO3,则c(Ag+)_______ (填“变大”“变小”或“不变”,下同);
②加入更多的AgBr固体,则c(Ag+)_______ ;
③加入NaBr固体,则 c(Ag+)_______ 。
(3)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=_______ mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。
(4)若在0.1 mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______ mol·L-1
(1)已知:20℃时,Ksp(AgCl)=1.1×10-10,Ksp(AgBr)=2.0×10-13。将AgCl和AgBr的饱和溶液等体积混合,再逐滴加入足量浓AgNO3溶液,充分反应后,下列说法正确的是_______
| A.只有AgBr沉淀生成 |
| B.AgCl与AgBr沉淀等量生成 |
| C.AgCl与AgBr沉淀都有,但是以AgCl为主 |
| D.AgCl与AgBr沉淀都有,但是以AgBr为主 |
①加入固体AgNO3,则c(Ag+)
②加入更多的AgBr固体,则c(Ag+)
③加入NaBr固体,则 c(Ag+)
(3)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=
(4)若在0.1 mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是
您最近一年使用:0次
解题方法
2 . 下列说法中正确的是
| A.互为手性异构体的分子互为镜像,且分子组成相同,性质也相同 |
| B.由酸性 FCH2COOH>CH3COOH,可知酸性 ClCH2COOH>CH3COOH |
| C.由 AgCl 和 AgBr 都能溶于氨水中,而 AgI 不能溶解在氨水中,可知 AgI 在水中的溶解度最大 |
| D.除 HF 外,其他卤化氢沸点随着相对分子质量的增大而升高,是因为氢键的键能逐渐增大所致 |
您最近一年使用:0次
解题方法
3 . 在化学分析中,以AgNO3标准溶液滴定溶液中的Cl-时,采用K2CrO4为指示剂,利用Ag+与CrO 反应生成砖红色沉淀指示滴定终点。当溶液中的Cl-恰好沉淀完全时(浓度等于1.0×10-5mol/L),(已知25℃时Ag2CrO4、AgCl的Ksp分别为2.0×10-12和1.8×10-10)。求:
反应生成砖红色沉淀指示滴定终点。当溶液中的Cl-恰好沉淀完全时(浓度等于1.0×10-5mol/L),(已知25℃时Ag2CrO4、AgCl的Ksp分别为2.0×10-12和1.8×10-10)。求:
(1)溶液中c(Ag+)=_______ 。
(2)溶液中c(CrO )=
)=_______ (写出具体计算过程)。
 反应生成砖红色沉淀指示滴定终点。当溶液中的Cl-恰好沉淀完全时(浓度等于1.0×10-5mol/L),(已知25℃时Ag2CrO4、AgCl的Ksp分别为2.0×10-12和1.8×10-10)。求:
反应生成砖红色沉淀指示滴定终点。当溶液中的Cl-恰好沉淀完全时(浓度等于1.0×10-5mol/L),(已知25℃时Ag2CrO4、AgCl的Ksp分别为2.0×10-12和1.8×10-10)。求:(1)溶液中c(Ag+)=
(2)溶液中c(CrO
 )=
)=
您最近一年使用:0次
名校
4 . 已知25℃物质的溶度积常数为:FeS:Ksp=6.3×10-18;CuS:Ksp=1.3×10-36;ZnS:Ksp=1.6×10-24。下列说法错误的是
| A.相同温度下,CuS的溶解度小于ZnS的溶解度 |
| B.除去工业废水中的Cu2+,可以选用FeS做沉淀剂 |
| C.足量CuSO4溶解在0.1mol/L的H2S溶液中,Cu2+能达到的最小浓度为1.3×10-35mol/L |
| D.在ZnS的饱和溶液中,加入FeCl2溶液,一定不产生FeS沉淀 |
您最近一年使用:0次
2022-09-16更新
|
151次组卷
|
2卷引用:陕西省黄陵中学2021-2022学年高二上学期期中考试化学试题
5 . 已知:AgX(X=Cl、Br)溶液中,p(Ag+)=-1gc(Ag+),p(X-)=-lgc(X-)。t℃时,p(X-)与p(Ag+)的相互关系如图。下列说法不正确的是
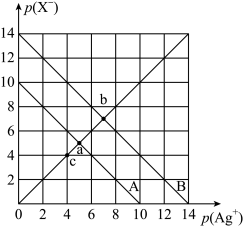

| A.A线表示的是AgBr |
| B.t℃时,c点浓度溶液中会有AgCl固体析出 |
| C.取a、b两点处溶液等体积混合,向溶液中加入足量浓硝酸银溶液,生成的沉淀n(AgBr)>n(AgCl) |
D.t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)的平衡常数K=104 AgBr(s)+Cl-(aq)的平衡常数K=104 |
您最近一年使用:0次
解题方法
6 . 已知常温下,AgBr的Ksp=4.9×10﹣13 mol2•L﹣2、AgI的Ksp=8.3×10﹣17mol2•L﹣2。
(1)现向含有AgI的饱和溶液中:
①加入AgNO3固体,则c(I﹣)_______ (填“变大”“变小”或“不变”,下同)。
②若改加更多的AgI固体,则c(Ag+)_______ 。
③若改加AgBr固体,则c(I﹣)_______ ,c(Ag+)_______ 。
(2)现向含有NaBr、KI均为0.002mol•L﹣1的溶液中加入等体积、浓度为4×10﹣3mol•L﹣1的AgNO3溶液,则产生的沉淀是_______ (填化学式);若向其中再加入适量的NaI固体,则可发生沉淀转化的总反应的离子方程式为_______ 。
(1)现向含有AgI的饱和溶液中:
①加入AgNO3固体,则c(I﹣)
②若改加更多的AgI固体,则c(Ag+)
③若改加AgBr固体,则c(I﹣)
(2)现向含有NaBr、KI均为0.002mol•L﹣1的溶液中加入等体积、浓度为4×10﹣3mol•L﹣1的AgNO3溶液,则产生的沉淀是
您最近一年使用:0次
7 . NaNbO3是一种很好的压电和介电材料,一种以铌铁矿(主要成分为SiO2、Nb2O3、MnO2和少量的FeO、CaO、MgO)为原料的制取工艺流程如下:
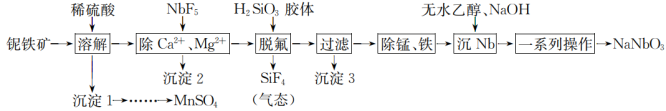
回答下列问题:
(1)为了加速“溶解”,可采取的措施有_______ (写出两种)该过程中MnO2与FeO反应生成MnSO4和Fe2(SO4)3的离子方程式为_______ 。
(2)“除Ca2+、Mg2+时,若溶液酸度过高,沉淀不完全,其原因是_______ ;当溶液中c(Ca2+)= 1×10-6mol·L-1时,溶液中c(Mg2+ )的最大值为_______ mol·L-1 (已知Ksp(CaF2)=2.5×10-11,Ksp(MgF2)= 6.4×10-9)
(3)“脱氟”过程发生反应的化学方程式为_______ 。
(4)“一系列操作”包括过滤、洗涤、干燥,其中证明NaNbO3洗涤干净的操作是_______ 。
(5)电解MnSO4溶液可制备Mn和MnO2,阳极电极反应式为_______ 。

回答下列问题:
(1)为了加速“溶解”,可采取的措施有
(2)“除Ca2+、Mg2+时,若溶液酸度过高,沉淀不完全,其原因是
(3)“脱氟”过程发生反应的化学方程式为
(4)“一系列操作”包括过滤、洗涤、干燥,其中证明NaNbO3洗涤干净的操作是
(5)电解MnSO4溶液可制备Mn和MnO2,阳极电极反应式为
您最近一年使用:0次
名校
8 . 将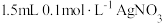 溶液和
溶液和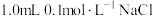 溶液混合,得到浊液a,过滤得到滤液b和白色沉淀c。已知:
溶液混合,得到浊液a,过滤得到滤液b和白色沉淀c。已知: ,
, 。下列分析错误的是
。下列分析错误的是
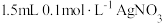 溶液和
溶液和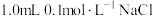 溶液混合,得到浊液a,过滤得到滤液b和白色沉淀c。已知:
溶液混合,得到浊液a,过滤得到滤液b和白色沉淀c。已知: ,
, 。下列分析错误的是
。下列分析错误的是A.浊液a中存在沉淀溶解平衡: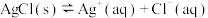 |
B.滤液b中不含 |
C.向滤液b中滴加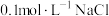 溶液,会出现白色沉淀 溶液,会出现白色沉淀 |
D.向沉淀c中滴加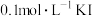 溶液,沉淀变为黄色 溶液,沉淀变为黄色 |
您最近一年使用:0次
2022-08-18更新
|
150次组卷
|
2卷引用:河北省武强中学2021-2022学年高二上学期12月联考化学试题
名校
9 . 下列用途或转化,不能用沉淀溶解平衡原理解释的是
A. 溶液可使PbS转化为CuS 溶液可使PbS转化为CuS |
B.向 饱和溶液中加入少量纯碱,有白色沉淀生成 饱和溶液中加入少量纯碱,有白色沉淀生成 |
C.Fe可除去 溶液中的 溶液中的 杂质 杂质 |
D.向 悬浊液中加入稀盐酸后,悬浊液变澄清 悬浊液中加入稀盐酸后,悬浊液变澄清 |
您最近一年使用:0次
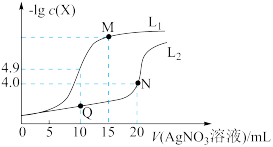
10 . t℃时,将0.1 mol·L-1AgNO3溶液分别滴加到10. 00 mL0.1 mol·L-1KCl、10.00 ml0.1 mol· L-1K2CrO4溶液中,AgNO3溶液体积(V)与-lg c(X)(X为Cl-或 )的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
)的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
 )的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
)的变化关系如图所示(忽略溶液体积变化)。下列说法正确的是
| A.曲线L2表示-lg c(Cl-)与V(AgNO3溶液)的变化关系 |
| B.t℃时,铬酸银的溶度积常数为4.0 ×10-12 |
| C.若仅将c(K2CrO4)改为0.05 mol·L-1,则曲线L2中N点移到Q点 |
D.M点溶液中:c( )>c(K+ )>c(Ag+ )>c(OH- )>c(H+ ) )>c(K+ )>c(Ag+ )>c(OH- )>c(H+ ) |
您最近一年使用:0次
2022-08-10更新
|
147次组卷
|
2卷引用:山西省怀仁市第一中学2021-2022学年高二上学期期中理科综合化学试题



