名校
解题方法
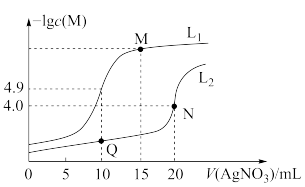
1 . 某温度下,分别向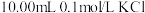 和
和 溶液中滴加
溶液中滴加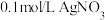 溶液,滴加过程中
溶液,滴加过程中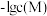 (M为
(M为 或
或 )与
)与 溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法
溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法不正确 的是
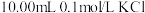 和
和 溶液中滴加
溶液中滴加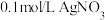 溶液,滴加过程中
溶液,滴加过程中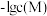 (M为
(M为 或
或 )与
)与 溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法
溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法
A.曲线 表示 表示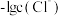 与 与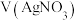 的变化关系 的变化关系 |
B.M点溶液中: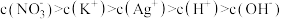 |
C.该温度下,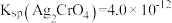 |
D.相同实验条件下,若改为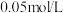 的 的 和 和 溶液,则曲线 溶液,则曲线 中N点移到Q点 中N点移到Q点 |
您最近一年使用:0次
2022-01-11更新
|
1340次组卷
|
19卷引用:湖南省邵阳市2021-2022学年高三上学期第一次联考化学试题
湖南省邵阳市2021-2022学年高三上学期第一次联考化学试题2020届高三化学化学二轮复习——常考题型:沉淀溶解平衡的曲线分析【精编25题】福建省厦门市2020届高三毕业班五月质量检查理综化学试题福建省厦门市2020届高三高考化学模拟(5月份)理综化学试题(已下线)专题10 水溶液中的离子平衡-2020年高考真题和模拟题化学分项汇编河北省石家庄市2019届高三毕业班模拟考试(一)化学试题福建省福州第三中学2021-2022学年高三上学期第六次质量检测化学试题(已下线)专项13 水溶液中的离子平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)广东省广州市第六中学2022届高三第三次模拟考试化学试题(已下线)第24讲 沉淀溶解平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)化学(湖南A卷)-学易金卷:2023年高考化学第一次模拟考试卷(已下线)化学(湖北A卷)-学易金卷:2023年高考第一次模拟考试卷(已下线)化学(山东B卷)-学易金卷:2023年高考第一次模拟考试卷湖南省长沙市明达中学2022-2023学年高三下学期2月月考化学试题(已下线)第八章 水溶液中的离子反应与平衡 第53讲 沉淀溶解平衡图像的分析(已下线)2022年福建省高考真题变式题(选择题6-10)湖南省岳阳市第一中学2023届高三下学期第七次月考化学试题(已下线)第5讲 难溶电解质的溶解平衡陕西省西安交通大学附属中学2023-2024年高二上学期第一次月考化学试题
2 . 下列操作、现象和结论都正确的是
| 操作 | 现象 | 结论 | |
| A | 在AgCl浊液中滴加少量KI稀溶液 | 产生黄色沉淀 | Ksp(AgC1)>Ksp(AgI) |
| B | 在酸性KMnO4溶液中滴加HOCH2CH=CH2(丙烯醇) | 溶液褪色 | 证明丙烯醇中含有碳碳双键 |
| C | 在NaAlO2溶液中滴加NaHCO3溶液 | 产生白色沉淀,同时有气泡产生 | 生成的气体为氢气 |
| D | 在淀粉的水解液中滴加KI溶液 | 溶液不变色 | 淀粉溶液已完全水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-08更新
|
225次组卷
|
2卷引用:河北省名校联盟2021-2022学年高三上学期一轮复习考试化学试题
名校
3 . 已知p(A)=-lgc平(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是
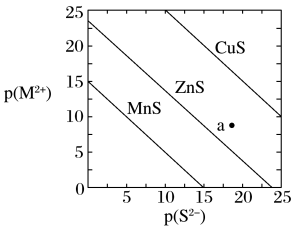

| A.a点有ZnS沉淀生成 |
| B.可用MnS除去MnCl2溶液中混有的少量ZnCl2 |
| C.向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c平(S2-)不变 |
D.CuS和MnS共存的悬浊液中,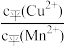 =10-20 =10-20 |
您最近一年使用:0次
2022-01-05更新
|
75次组卷
|
2卷引用:河北省张家口市第一中学2021-2022学年高二上学期12月月考化学试题
解题方法
4 . 某化学实验小组探究氢氧化镁在氯化铵溶液中的溶解实验。已知:常温时,Ksp[Mg(OH)2]=4×10-12,Kb(NH3·H2O)=1.75×10-5,Ka(CH3COOH)=1.75×10-5。
I.氢氧化镁粉末的溶解
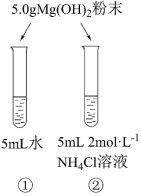
(1)常温下,实验①中有少量的氢氧化镁粉末溶解,向溶液①中滴加酚酞,溶液变为粉红色,则pH=_______ (已知:1g2=0.3)。
(2)实验②中氢氧化镁粉末大量溶解,实验②中反应的离子方程式为_______ ,此反应的平衡常数K=_______ (结果保留两位有效数字)。微热实验②中试管,有刺激性气味气体产生,检验此气体的方法为_______ 。
II.探究氢氧化镁粉末在氯化铵溶液中的溶解原因。
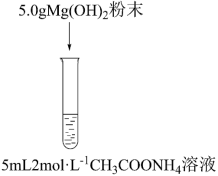
(3)猜想1:NH4Cl溶液中的NH 结合Mg(OH)2溶液中的OH-,使得溶解平衡正移。
结合Mg(OH)2溶液中的OH-,使得溶解平衡正移。
猜想2:_______ 。
将猜想2补充完整,为证明上述猜想,甲同学设计实验③,发现氢氧化镁粉末大量溶解。通过实验③可证明_______ (填“猜想1”或“猜想2”)成立。
(4)乙同学认为实验③中的CH3COO-也可能参与反应,故设计实验④证明上述结论。实验④为_______ (填实验方案)。
I.氢氧化镁粉末的溶解
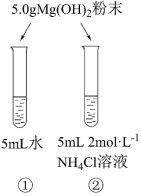
(1)常温下,实验①中有少量的氢氧化镁粉末溶解,向溶液①中滴加酚酞,溶液变为粉红色,则pH=
(2)实验②中氢氧化镁粉末大量溶解,实验②中反应的离子方程式为
II.探究氢氧化镁粉末在氯化铵溶液中的溶解原因。

(3)猜想1:NH4Cl溶液中的NH
 结合Mg(OH)2溶液中的OH-,使得溶解平衡正移。
结合Mg(OH)2溶液中的OH-,使得溶解平衡正移。猜想2:
将猜想2补充完整,为证明上述猜想,甲同学设计实验③,发现氢氧化镁粉末大量溶解。通过实验③可证明
(4)乙同学认为实验③中的CH3COO-也可能参与反应,故设计实验④证明上述结论。实验④为
您最近一年使用:0次
5 . 常温时,草酸的电离常数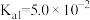 ,
,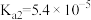 ,CaC2O4的
,CaC2O4的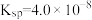 。下列有关说法正确的是
。下列有关说法正确的是
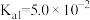 ,
,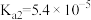 ,CaC2O4的
,CaC2O4的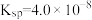 。下列有关说法正确的是
。下列有关说法正确的是| A.草酸钙是弱电解质 |
B.NaHC2O4在水溶液中的电离方程式: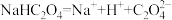 |
C.常温时,0.01mol/L草酸溶液中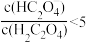 |
D.CaC2O4浊液中存在平衡: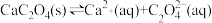 |
您最近一年使用:0次
名校
6 . 根据图甲、乙、丙、丁所得出的结论正确的是
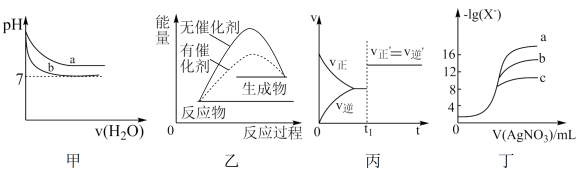

| A.图甲表示pH相同的NaOH溶液与氨水稀释过程pH的变化,曲线b对应氨水 |
| B.图乙表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化 |
C.图丙表示 的反应速率随时间的变化,在t1时改变的条件可能是缩小体积 的反应速率随时间的变化,在t1时改变的条件可能是缩小体积 |
| D.图丁表示用0.0100 mol/L的AgNO3标准溶液滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液时,c为Cl-的滴定曲线(X表示Cl、Br、I) |
您最近一年使用:0次
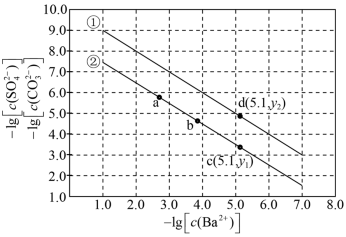
7 . 已知相同温度下,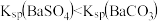 。某温度下,饱和溶液中
。某温度下,饱和溶液中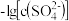 、
、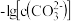 与
与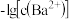 的关系如图所示。下列说法
的关系如图所示。下列说法错误 的是
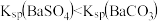 。某温度下,饱和溶液中
。某温度下,饱和溶液中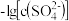 、
、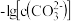 与
与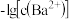 的关系如图所示。下列说法
的关系如图所示。下列说法
| A.曲线①中y2=4.9 |
B.该温度下: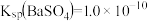 |
C.加适量 固体可使溶液由b点变到c点 固体可使溶液由b点变到c点 |
D.曲线②中a点: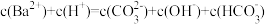 |
您最近一年使用:0次
8 . 某温度下25mL含KCl和KCN的溶液,用0.1000mol·L-1的硝酸银标准溶液对该混合液进行电位滴定(CN-与H+的反应可以忽略),获得电动势(E)和硝酸银标准溶液体积(V)的电位滴定曲线如图所示,曲线上的转折点即为化学计量点。
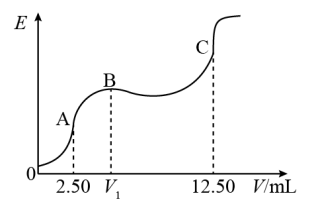
已知:I、Ag+与CN-反应过程为:①Ag++2CN-=[Ag(CN)2]-、②[Ag(CN)2]-+Ag+=2AgCN↓
II、该温度时,Ksp(AgCN)=2×10-16,Ksp(AgCl)=2×10-10。
下列说法不正确的是

已知:I、Ag+与CN-反应过程为:①Ag++2CN-=[Ag(CN)2]-、②[Ag(CN)2]-+Ag+=2AgCN↓
II、该温度时,Ksp(AgCN)=2×10-16,Ksp(AgCl)=2×10-10。
下列说法不正确的是
| A.V1=5.00,B点时生成AgCN |
| B.c(KCN)=0.02000mol·L-1,c(KCl)=0.03000mol·L-1 |
C.反应①的平衡常数为K1,反应②的平衡常数为K2,则K1×K2=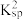 (AgCN) (AgCN) |
D.C点时,溶液中 =106 =106 |
您最近一年使用:0次
名校
9 . 下列各图象与描述相符的是


A.图1表示反应N2+3H2 2NH3ΔH<0在其他条件一定时,反应速率随温度的变化 2NH3ΔH<0在其他条件一定时,反应速率随温度的变化 |
B.图2表示相同质量的BaO2在相同温度、不同体积的恒容密闭容器中发生反应2BaO2(s)  2BaO(s)+O2(g),平衡时各容器中c(O2)随容器体积的变化 2BaO(s)+O2(g),平衡时各容器中c(O2)随容器体积的变化 |
| C.图3表示AgCl的沉淀溶解平衡曲线,其中a、b、c三点的溶解度相同 |
| D.图4表示往醋酸钠溶液中加入醋酸钠晶体,溶液中c(CH3COO-)与c(Na+)的比值 |
您最近一年使用:0次
2021-12-31更新
|
377次组卷
|
2卷引用:福建省师范大学附属中学擎云级2021-2022学年高三上学期12月月考化学试题
10 . 一定温度下,向含Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+)的溶液中滴加Na2S溶液,生成硫化物沉淀所需S2−浓度的对数值lgc(S2−)与lgc(M2+)的关系如图所示。下列判断错误的是
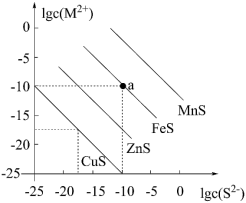

| A.Ksp(FeS)=1.0×10−20 |
| B.向含等物质的量浓度的Fe2+、Cu2+稀溶液中滴加Na2S溶液,Cu2+先沉淀 |
| C.该温度下,a点相对于MnS是过饱和溶液 |
| D.该温度下,a点相对于ZnS是过饱和溶液 |
您最近一年使用:0次
2021-12-31更新
|
601次组卷
|
4卷引用:河北省石家庄市正中实验中学2021-2022学年高二上学期第三次月考化学试题
河北省石家庄市正中实验中学2021-2022学年高二上学期第三次月考化学试题(已下线)专题19 沉淀溶解平衡的图像问题分析-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)专题五 沉淀溶解平衡图象(讲)广东省广州市第八十九中学2023-2024学年高二上学期期中考试化学试题



