名校
1 . 烟气中的 会给环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放。回答下列问题:
会给环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放。回答下列问题:
方法1(双碱法):用NaOH吸收 ,并用CaO使NaOH再生,即NaOH溶液
,并用CaO使NaOH再生,即NaOH溶液
 溶液。
溶液。
(1)过程①的离子方程式为_______ 。
(2)常温下,用NaOH溶液吸收 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡_______ (填“向左”“向右”或“不”)移动。该溶液中由水电离出的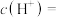
_______  ;
; 溶液显
溶液显_______ (填“酸”、“碱”或“中”)性。(常温下 的电离平衡常数
的电离平衡常数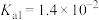 ,
,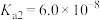 )
)
(3)CaO在水中存在如下转化: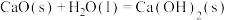 ,
,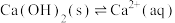
 ,从化学反应原理的角度解释过程②NaOH再生的原理:
,从化学反应原理的角度解释过程②NaOH再生的原理:_______ 。
(4)理论上,该工艺中NaOH只作为启动碱,实际主要消耗的是生石灰。实际吸收过程中,由于存在一定氧气,会发生副反应:_______ (填化学方程式),因副产物_______ (填化学式)在工艺中较难循环再生成NaOH,需要不断向系统中补充NaOH。
方法2:用氨水除去。
(5)已知常温时 的
的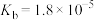 ,若氨水的浓度为
,若氨水的浓度为 ,溶液中
,溶液中
_______  。将
。将 通入该氨水中,当溶液恰好呈中性时,溶液中
通入该氨水中,当溶液恰好呈中性时,溶液中
_______ 。
 会给环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放。回答下列问题:
会给环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放。回答下列问题:方法1(双碱法):用NaOH吸收
 ,并用CaO使NaOH再生,即NaOH溶液
,并用CaO使NaOH再生,即NaOH溶液
 溶液。
溶液。(1)过程①的离子方程式为
(2)常温下,用NaOH溶液吸收
 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡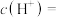
 ;
; 溶液显
溶液显 的电离平衡常数
的电离平衡常数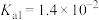 ,
,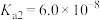 )
)(3)CaO在水中存在如下转化:
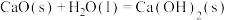 ,
,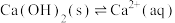
 ,从化学反应原理的角度解释过程②NaOH再生的原理:
,从化学反应原理的角度解释过程②NaOH再生的原理:(4)理论上,该工艺中NaOH只作为启动碱,实际主要消耗的是生石灰。实际吸收过程中,由于存在一定氧气,会发生副反应:
方法2:用氨水除去。
(5)已知常温时
 的
的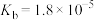 ,若氨水的浓度为
,若氨水的浓度为 ,溶液中
,溶液中
 。将
。将 通入该氨水中,当溶液恰好呈中性时,溶液中
通入该氨水中,当溶液恰好呈中性时,溶液中
您最近一年使用:0次
解题方法
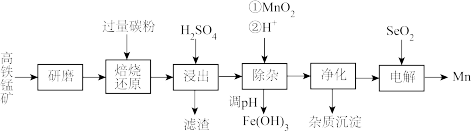
2 . 在钢铁工业中,主要用锰脱硫和脱氧:锰也是作为合金的添加料。一种以高铁锰矿(含 、
、 及少量
及少量 、
、 、
、 、
、 )为原料生产金属锰的工艺流程如图。
)为原料生产金属锰的工艺流程如图。
已知:常温下, 的
的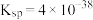 ;
; ;溶液中某离子浓度小于
;溶液中某离子浓度小于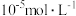 认为该离子沉淀完全。
认为该离子沉淀完全。
回答下列问题:
(1)研磨的目的是_______ 。
(2)“焙烧还原”时,原料中高铁锰矿中 被还原为
被还原为 ,还有能被还原的成分为
,还有能被还原的成分为_______ 、_______ 。(填化学式)
(3)下表数据是焙烧后 元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为
元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为_______  。
。
(4)“浸出”产生两种“滤渣”的成分为_______ 、_______ (填化学式):该步骤中,工业上往往需再加入少量固体 以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因
以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因_______ 。
(5)常温下,“除杂”时 参加的反应的离子方程式为
参加的反应的离子方程式为_______ ;再逐步调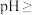
_______ 至 完全沉淀。
完全沉淀。
(6)研究表明,加入适量的 有利于
有利于 在电极上析出,电解过程中
在电极上析出,电解过程中 与水反应生成的
与水反应生成的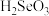 (二元弱酸)在阴极放电生成
(二元弱酸)在阴极放电生成 单质,该电极反应式为
单质,该电极反应式为_______ 。
 、
、 及少量
及少量 、
、 、
、 、
、 )为原料生产金属锰的工艺流程如图。
)为原料生产金属锰的工艺流程如图。
已知:常温下,
 的
的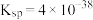 ;
; ;溶液中某离子浓度小于
;溶液中某离子浓度小于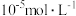 认为该离子沉淀完全。
认为该离子沉淀完全。回答下列问题:
(1)研磨的目的是
(2)“焙烧还原”时,原料中高铁锰矿中
 被还原为
被还原为 ,还有能被还原的成分为
,还有能被还原的成分为(3)下表数据是焙烧后
 元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为
元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为 。
。还原温度/ | 焙烧后 元素在主要含锰物质中的分布/% 元素在主要含锰物质中的分布/% | ||
 | 高价锰( ) ) | 低价锰( ) ) | |
| 600 800 1000 1100 1200 | 40.92 10.56 6.01 痕量 痕量 | 34.76 6.63 2.70 0.46 0.30 | 24.32 82.81 91.29 98.76 97.94 |
 以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因
以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因(5)常温下,“除杂”时
 参加的反应的离子方程式为
参加的反应的离子方程式为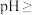
 完全沉淀。
完全沉淀。(6)研究表明,加入适量的
 有利于
有利于 在电极上析出,电解过程中
在电极上析出,电解过程中 与水反应生成的
与水反应生成的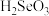 (二元弱酸)在阴极放电生成
(二元弱酸)在阴极放电生成 单质,该电极反应式为
单质,该电极反应式为
您最近一年使用:0次
名校
3 . 在FeS悬浊液中,存在平衡FeS(s) ⇌Fe2+(aq)+S2-(aq)。欲使FeS固体质量减少,Fe2+浓度不变,可向悬浊液中加入的试剂是
| A.CuSO4溶液 | B.盐酸 | C.蒸馏水 | D.Na2S |
您最近一年使用:0次
2022-04-14更新
|
753次组卷
|
5卷引用:辽宁省沈阳市第一二〇中学2021-2022学年高二上学期第二次质量检测化学试题
辽宁省沈阳市第一二〇中学2021-2022学年高二上学期第二次质量检测化学试题四川省资阳市外国语实验学校2021-2022学年高二下学期期中考试化学试题(已下线)3.4.1 沉淀溶解平衡-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)课时1难溶电解质的沉淀溶解平衡随堂练习上海市华东师范大学第三附属中学2023-2024学年高二上学期期中考试(等级考) 化学试题
名校
4 .  、
、 都是造成水体污染的因素,可以利用沉淀法除去。如图a、b分别是Mg3(AsO4)2、Mg3(PO4)2的沉淀溶解平衡曲线。下列说法错误的是
都是造成水体污染的因素,可以利用沉淀法除去。如图a、b分别是Mg3(AsO4)2、Mg3(PO4)2的沉淀溶解平衡曲线。下列说法错误的是
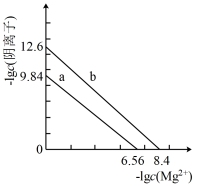
 、
、 都是造成水体污染的因素,可以利用沉淀法除去。如图a、b分别是Mg3(AsO4)2、Mg3(PO4)2的沉淀溶解平衡曲线。下列说法错误的是
都是造成水体污染的因素,可以利用沉淀法除去。如图a、b分别是Mg3(AsO4)2、Mg3(PO4)2的沉淀溶解平衡曲线。下列说法错误的是
| A.Ksp[Mg3(AsO4)2]=10-19.68 |
B.若Mg3(AsO4)2(s)+2 (aq) (aq) Mg3(PO4)2(s)+2 Mg3(PO4)2(s)+2 (aq)成立,则平衡常数K=104.52 (aq)成立,则平衡常数K=104.52 |
C.向浓度相等的Na3AsO4、Na3PO4的废水中同时滴加相同浓度的Mg(NO3)2溶液, 先沉淀 先沉淀 |
D.要使废水中 、 、 离子浓度不大于10-6mol·L-1,则Mg2+浓度至少为10-2.56mol·L-1 离子浓度不大于10-6mol·L-1,则Mg2+浓度至少为10-2.56mol·L-1 |
您最近一年使用:0次
5 . 已知相同温度下,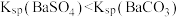 。某温度下,饱和溶液中
。某温度下,饱和溶液中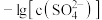 、
、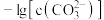 与
与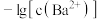 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
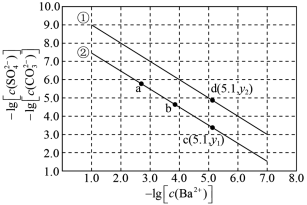
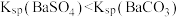 。某温度下,饱和溶液中
。某温度下,饱和溶液中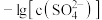 、
、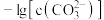 与
与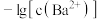 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是
| A.曲线①表示硫酸钡的沉淀溶解曲线 |
B.该温度下: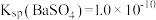 |
| C.加适量BaCl2固体可使溶液由b点变到c点 |
| D.曲线①中的y2 = 4.9 |
您最近一年使用:0次
名校
解题方法
6 . I.某酸H2A在水中的电离方程式是:H2A=H++HA-,HA-⇌H++A2-。回答下列问题:
(1)Na2A溶液显______ (填“酸性”“中性”或“碱性”),用离子方程式表示其原因________ 。
(2)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是_______。
II.痛风是以关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下;
①HUr(尿酸,aq)⇌Ur-(尿酸根,aq)+H+(aq)(37℃时,Ka=4.0×10-6)
②NaUr(s)⇌Ur-(aq)+Na+(aq)
(3)37℃时,1.0L水中最多可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为________ 。
(4)关节炎发作多在脚趾和手指的关节处,当天气变冷时,关节炎变得严重,这说明温度降低时,尿酸钠的Ksp________ (填“增大”“减小”或“不变”),生成尿酸钠晶体的反应是_____ (填“放热”或“吸热”)反应。
(5)37℃时,某尿酸结石病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol·L-1,其中尿酸分子的浓度为5.0×10-4mol·L-1,该病人尿液的c(H+)为_______ ,pH______ 7(填“>”“=”或“<”)。
(1)Na2A溶液显
(2)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是_______。
| A.c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1 | B.c(OH-)=c(H+)+c(HA-)+2c(H2A) |
| C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-) | D.c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |
II.痛风是以关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下;
①HUr(尿酸,aq)⇌Ur-(尿酸根,aq)+H+(aq)(37℃时,Ka=4.0×10-6)
②NaUr(s)⇌Ur-(aq)+Na+(aq)
(3)37℃时,1.0L水中最多可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为
(4)关节炎发作多在脚趾和手指的关节处,当天气变冷时,关节炎变得严重,这说明温度降低时,尿酸钠的Ksp
(5)37℃时,某尿酸结石病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol·L-1,其中尿酸分子的浓度为5.0×10-4mol·L-1,该病人尿液的c(H+)为
您最近一年使用:0次
名校
7 . 湿法提银工艺中,浸出的Ag+需加入Cl-进行沉淀。25℃时,平衡体系中含Ag微粒的分布系数δ[如δ(AgCl2-)=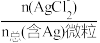 ]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgC1)]=-9.75。下列叙述正确的是
]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgC1)]=-9.75。下列叙述正确的是
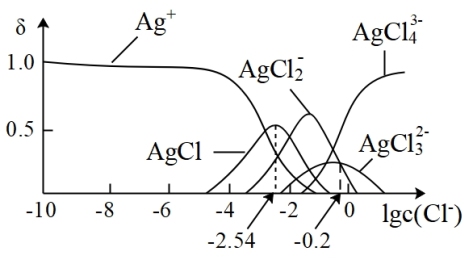
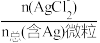 ]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgC1)]=-9.75。下列叙述正确的是
]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgC1)]=-9.75。下列叙述正确的是
| A.沉淀最彻底时,溶液中c(Ag+)=10-7.21mol/L |
| B.AgCl溶解程度随c(Cl-)增大而不断减小 |
C.当c(Cl-)=10-2mol·L-1时,溶液中c(AgCl )>c(AgC1 )>c(AgC1 )>c(Ag+) )>c(Ag+) |
D.25℃时,AgCl +Cl- +Cl- AgCl AgCl 的平衡常数K=10-0.2 的平衡常数K=10-0.2 |
您最近一年使用:0次
2022-03-23更新
|
305次组卷
|
22卷引用:四川省宜宾市2021-2022学年高三上学期第一次诊断检测理综化学试题
四川省宜宾市2021-2022学年高三上学期第一次诊断检测理综化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】16江西省丰城中学2021-2022学年上学期高三创新实验班第四次月考化学试题安徽省六校教育研究会2021-2022学年高三下学期第二次联考理综化学试题(已下线)专题19 沉淀溶解平衡的图像问题分析-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)陕西省渭南市2022届高考第一次模拟考试化学试题陕西省渭南市2021-2022学年高三下学期第一次模拟考试化学试题山西省运城市2021-2022学年高二上学期期末调研测试化学试题陕西省汉中市2022届高三下学期第五次校级联考理科综合化学试题安徽师范大学附属中学2021-2022学年高三上学期第七次测试理综化学试题四川省成都外国语学校2022届高三第二次模拟考试理综化学试题黑龙江省哈尔滨市第六中学2022届高三下学期第一次模拟考试理综化学试题(已下线)押江苏卷第13题 水溶液中的离子平衡 -备战2022年高考化学临考题号押题(江苏卷)山东省潍坊市2022届高三下学期5月模拟考试(一)化学试题(已下线)2022年山东省高考真题变式题(不定项选择题)陕西省西安市长安区2021-2022学年高三上学期期末质量检测化学试题(已下线)学科特色3 电解质溶液图像(已下线)专题12 电解质溶液中的四大平衡常数(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练宁夏回族自治区中卫市2023届高三一模理科综合化学试题四川省成都列五中学2023-2024学年高三上学期阶段性考试(一)理综化学试题四川省泸县第五中学2023-2024学年高三上学期10月月考理综化学试题黑龙江省大庆外国语学校2023-2024学年高二下学期开学质量检测化学试卷
名校
解题方法
8 . Ⅰ.(化学与生活)材料是人类赖以生存和发展的重要物质基础。
(1)生产水泥的主要原料是___________ 和___________ (填名称)。
(2)有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料,而是一种___________ 。(选填“橡胶”或“纤维”或“塑料”)
(3)上海世博会中国馆用到一种涂料一氟碳涂层聚酯(FEP),它的单体为CF3—CF=CF2,这种涂料具有___________ (选填“热塑性”或“热固性”)。
(4)由聚氯乙烯等塑料垃圾引起的污染称为“___________ ”。
(5)玻璃钢具有耐腐蚀、质量轻、强度高的性能,它属于___________ 材料(选填“合金”或“复合”)。
Ⅱ.(化学反应原理)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(6)A为0.1mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小的顺序为___________ 。
(7)B为0.1mol·L-1的Na2CO3溶液,实验测得该溶液的pH___________ 7(填“>”“=”或“<”)
(8)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入盐酸,目的是___________ ;若把该溶液加热蒸干,得到的固体物质为___________ (填化学式)。
(9)D为含有足量AgCl固体的饱和溶液,请写出AgCl在水中存在溶解平衡的表达式:___________ 。
(1)生产水泥的主要原料是
(2)有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料,而是一种
(3)上海世博会中国馆用到一种涂料一氟碳涂层聚酯(FEP),它的单体为CF3—CF=CF2,这种涂料具有
(4)由聚氯乙烯等塑料垃圾引起的污染称为“
(5)玻璃钢具有耐腐蚀、质量轻、强度高的性能,它属于
Ⅱ.(化学反应原理)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(6)A为0.1mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小的顺序为
(7)B为0.1mol·L-1的Na2CO3溶液,实验测得该溶液的pH
(8)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入盐酸,目的是
(9)D为含有足量AgCl固体的饱和溶液,请写出AgCl在水中存在溶解平衡的表达式:
您最近一年使用:0次
9 . 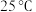 时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法正确的是
时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法正确的是
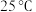 时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法正确的是
时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法正确的是 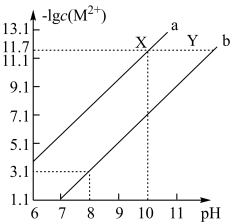
| A.曲线a表示Fe(OH)2饱和溶液中的变化关系 |
| B.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO |
| C.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=104.6∶1 |
| D.向X点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液 |
您最近一年使用:0次
2022-03-21更新
|
613次组卷
|
13卷引用:黑龙江省哈尔滨市第一六二中学2021-2022学年高三上学期第三次月考化学试题
黑龙江省哈尔滨市第一六二中学2021-2022学年高三上学期第三次月考化学试题河南省商丘市2018届高三上学期期末考试化学试题福建省厦门市双十中学2018届高三第三次理t科综合考试化学试题【全国百强校】河南省南阳市第一中学2017-2018学年高二下学期第四次月考化学试题四川省广安市友谊中学2018-2019学年高二上学期12月月考化学试题百所名校联考-仿真(四) 标准仿真预测卷山东省东营市一中2019-2020学年高二下学期期中考试化学试题(已下线)练习14 难溶电解质的沉淀溶解平衡-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)黑龙江省大庆市实验中学2021-2022学年高二下学期开学考试化学试题陕西省安康中学2021-2022学年高二上学期期末考试化学试题(已下线)2022年福建省高考真题变式题(选择题6-10)(已下线)T13-溶液中的离子平衡天津市第七中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
10 . 下列方程式书写错误的是
| A.Al(OH)3⇌A13++3OH- | B.Al(OH)3(s)⇌Al3+(aq)+3OH-(aq) |
C.BaSO4(s)⇌Ba2+(aq)+ (aq) (aq) | D.BaSO4⇌Ba2++ |
您最近一年使用:0次
2022-03-19更新
|
1944次组卷
|
7卷引用:河北省保定市部分学校2021-2022学年高二上学期第三次月考化学试题



