名校
1 . 元素周期表可以有多种表示方法,如图为八角形元素周期表,八角形的每个顶角对应一种元素。下列说法错误的是
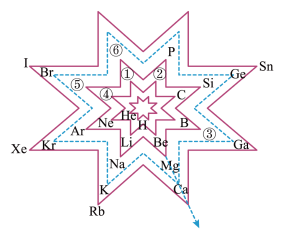
| A.图中沿虚线箭头方向,元素单质的还原性逐渐增强 |
| B.元素③基态原子中,成对电子与未成对电子的数目比为12:1 |
| C.元素第一电离能大小关系:②>①>④ |
| D.最简单气态氢化物的稳定性:⑤>⑥ |
您最近一年使用:0次
2023-10-28更新
|
294次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三上学期适应性月考(四)理综化学试题
名校
2 . X、Y、Z、W是原子序数依次增大的短周期主族元素,X与W位于同主族,Y原子的最外层电子数是内层电子数的3倍,X、Y、W形成的一种化合物M结构式如图所示。下列说法中错误的是


| A.上述四种元素的电负性最大的是Z | B.化合物M的晶体类型为离子晶体 |
| C.Z单质可以与水反应生成Y单质 | D.简单离子半径: |
您最近一年使用:0次
3 . 短周期主族元素X、Y、Z、W的原子序数依次增大,基态 Y 原子有3个未成对电子,基态Z原子的价电子数等于其电子层数,这四种元素可形成离子化合物| 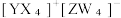 下列叙述正确的是
下列叙述正确的是
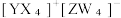 下列叙述正确的是
下列叙述正确的是| A.氧化性:Y2>W2 | B.电负性:Y>X>Z |
| C.YW3的空间结构为平面三角形 | D.第一电离能:Y<W |
您最近一年使用:0次
2023-10-17更新
|
476次组卷
|
4卷引用:云南省部分名校2023-2024学年高三上学期10月联考理科综合化学试题
名校
4 . 完成下列问题:
(1)写出 的电子式:
的电子式:_______ ,它的阳离子价层电子对数为_______ 。
(2)Cu的基态原子结构示意图为_______ ,Cu的价层电子排布图为_______ , 的价层电子排布式为
的价层电子排布式为_______ , 和
和 较稳定的是
较稳定的是_______ (填离子符号),原因是_______ 。
(3)乙炔和乙烯分子,它们的 键个数之比为
键个数之比为_______ ,乙烯分子中C原子杂化轨道类型为_______ 。
(1)写出
 的电子式:
的电子式:(2)Cu的基态原子结构示意图为
 的价层电子排布式为
的价层电子排布式为 和
和 较稳定的是
较稳定的是(3)乙炔和乙烯分子,它们的
 键个数之比为
键个数之比为
您最近一年使用:0次
名校
解题方法
5 . 图表为元素周期表的一部分,请参照元素①~⑩在表中的位置,回答下列问题:
(1)元素⑩在周期表中的位置是_______ ,其基态原子价电子轨道表示式为_______ ,该元素对应基态原子具有_______ 种能量不同的电子,具有_______ 种运动状态不同的电子。
(2)④、⑤、⑥的简单离子半径由大到小的顺序为_______ (用离子符号和“>”表示)。
(3)②③④⑧⑨的简单气态氢化物中,最稳定的是_______ (用化学式表示,下同),最高价氧化物对应水化物中,酸性最强的是_______ 。
(4)⑤的最高价氧化物对应的水化物与⑦的最高价氧化物对应的水化物发生反应的离子方程式为_______ 。
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||||||||||||
| ⑩ | |||||||||||||||||
(2)④、⑤、⑥的简单离子半径由大到小的顺序为
(3)②③④⑧⑨的简单气态氢化物中,最稳定的是
(4)⑤的最高价氧化物对应的水化物与⑦的最高价氧化物对应的水化物发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
6 . 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据相关信息,回答下列问题:
(1)写出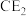 的电子式:
的电子式:_______ 。
(2)B元素基态原子中能量最高的电子,其电子云在空间有_______ 个取向。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为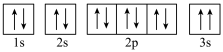 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了_______ 。
(4)G元素位于_______ 区,该元素的核外电子排布式为_______ 。
(5)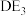 中心原子的杂化方式为
中心原子的杂化方式为_______ ,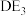 分子空间结构为
分子空间结构为_______ 。
(6)检验F元素的方法是_______ ,请用原子结构的知识解释产生此现象的原因_______ 。
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子总数比s电子总数少1 |
 核外电子排布与Ne相同 核外电子排布与Ne相同 |
| 基态D原子价电子层的p轨道半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)写出
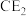 的电子式:
的电子式:(2)B元素基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了(4)G元素位于
(5)
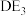 中心原子的杂化方式为
中心原子的杂化方式为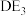 分子空间结构为
分子空间结构为(6)检验F元素的方法是
您最近一年使用:0次
名校
7 . 由短周期元素构成的一种对中枢神经有抑制作用的药物结构如图所示。W的电子只有一种自旋取向,Z的原子核s能级上的电子总数与p能级上的电子总数相等,但第一电离能都低于同周期相邻元素,X、Y、Z位于同一周期,且原子序数依次增大。下列说法正确的是
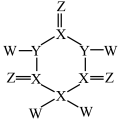

| A.简单气态氢化物稳定性:Y<Z | B.电负性:W<X<Z<Y |
| C.X的单质一定是分子晶体 | D.XZ2中X的杂化轨道类型为sp3 |
您最近一年使用:0次
解题方法
8 . 磷酸锌常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰( 主要含ZnO,还含少量FeO、Al2O3、 CuO 及SiO2)为原料制取磷酸锌的工艺流程如图所示:
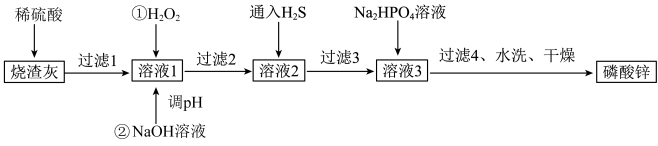
已知:①Zn3(PO4)2在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
回答下列问题:
(1)基态锌原子的价电子排布式为_____________ 。
(2)加入H2O2的作用是___________________________ 。
(3)经过滤2得到滤渣的主要成分是Fe( OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是___________ 。
(4)通入H2S的目的是除去Cu2+,写出该反应的离子方程式:_________________ 。
(5)洗涤磷酸锌沉淀时应选用________ (填“冷水”或“热水”),洗涤沉淀的操作是________________ 。
(6)图是碳化硅的晶胞结构,其晶体类型属于___________ 晶体。若碳化硅晶胞边长为a pm,阿伏加德罗常数的值为NA,则碳化硅晶体的密度为______________ g·cm-3 (列出计算式即可)。

已知:①Zn3(PO4)2在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
| 金属离子 | Al3+ | Fe3+ | Cu2+ | Zn2+ |
| 开始沉淀的pH | 3.0 | 2.2 | 5.4. | 6.5 |
| 完全沉淀的pH | 5.0 | 3.6 | 6.7 | 8.5 |
(1)基态锌原子的价电子排布式为
(2)加入H2O2的作用是
(3)经过滤2得到滤渣的主要成分是Fe( OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是
(4)通入H2S的目的是除去Cu2+,写出该反应的离子方程式:
(5)洗涤磷酸锌沉淀时应选用
(6)图是碳化硅的晶胞结构,其晶体类型属于

您最近一年使用:0次
9 . 氮及其化合物在工农业生产中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一
Ⅰ.一定条件下,用 催化还原可消除NO污染。
催化还原可消除NO污染。
已知:
①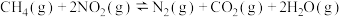
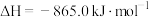
②
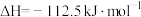
(1) 和
和 完全反应,每生成2.24L(标准状况)NO时,吸收8.9kJ的热量,则
完全反应,每生成2.24L(标准状况)NO时,吸收8.9kJ的热量,则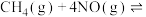
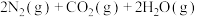

___________  ;一定温度下,往一体积不变的密闭容器中加入适量的
;一定温度下,往一体积不变的密闭容器中加入适量的 和NO,下列条件能判断该反应到达平衡状态的有
和NO,下列条件能判断该反应到达平衡状态的有___________ (填序号)。
A.混合气体的平均相对分子质量不变
B.
C.单位时间里有4n mol C—H断开同时有4n mol O—H断开
D.混合气体的压强不变
E.混合气体的密度不变
(2)将2mol NO(g)、1mol (g)和2mol He(g)通入反应器,在温度T、压强p条件下进行反应②和
(g)和2mol He(g)通入反应器,在温度T、压强p条件下进行反应②和 。平衡时,若
。平衡时,若 、
、 与
与 三者的物质的量相等,则NO转化率为
三者的物质的量相等,则NO转化率为___________ ,反应②平衡常数
___________ (用含p的代数式表示)。
Ⅱ.利用如图所示原理去除NO:
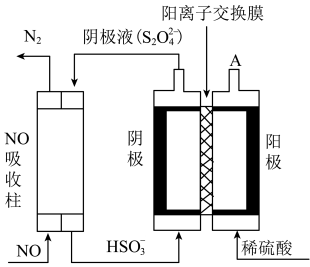
(3)基态N原子中,电子占据的最高能级为___________ 能级,该能级轨道的形状为___________ ;电解池中阴极反应式为___________ 。
(4)A口每产生224mL (体积已换算成标准状况,不考虑
(体积已换算成标准状况,不考虑 的溶解),可处理NO的物质的量为
的溶解),可处理NO的物质的量为___________ mol。
Ⅰ.一定条件下,用
 催化还原可消除NO污染。
催化还原可消除NO污染。已知:
①
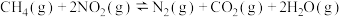
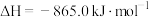
②

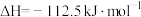
(1)
 和
和 完全反应,每生成2.24L(标准状况)NO时,吸收8.9kJ的热量,则
完全反应,每生成2.24L(标准状况)NO时,吸收8.9kJ的热量,则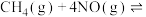
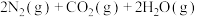

 ;一定温度下,往一体积不变的密闭容器中加入适量的
;一定温度下,往一体积不变的密闭容器中加入适量的 和NO,下列条件能判断该反应到达平衡状态的有
和NO,下列条件能判断该反应到达平衡状态的有A.混合气体的平均相对分子质量不变
B.

C.单位时间里有4n mol C—H断开同时有4n mol O—H断开
D.混合气体的压强不变
E.混合气体的密度不变
(2)将2mol NO(g)、1mol
 (g)和2mol He(g)通入反应器,在温度T、压强p条件下进行反应②和
(g)和2mol He(g)通入反应器,在温度T、压强p条件下进行反应②和 。平衡时,若
。平衡时,若 、
、 与
与 三者的物质的量相等,则NO转化率为
三者的物质的量相等,则NO转化率为
Ⅱ.利用如图所示原理去除NO:

(3)基态N原子中,电子占据的最高能级为
(4)A口每产生224mL
 (体积已换算成标准状况,不考虑
(体积已换算成标准状况,不考虑 的溶解),可处理NO的物质的量为
的溶解),可处理NO的物质的量为
您最近一年使用:0次
2023-09-20更新
|
325次组卷
|
2卷引用:云南大理市辖区2023-2024学年高三上学期毕业生区域性规模化统一检测理综化学试题
10 . 金属铜、铁在日常生活中应用广泛,根据下列说法回答下列问题。
(1) 的制备反应为
的制备反应为 。
。
上述氧化过程中, (II)
(II)_____ (答简化电子排布式)变为 III)
III)_____ (答外围电子排布图),基态 (III)电子占据
(III)电子占据_____ 个不同轨道。
(2)对上述反应式中的短周期元素按照电负性由小到大排序为_____
(3)配合物 的配位数为6,其配体
的配位数为6,其配体 中的
中的 的杂化方式为
的杂化方式为_____ 杂化。
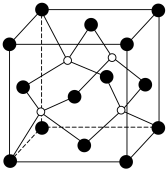
(4)铜原子与氯原子形成化合物的晶胞如图所示(黑球代表铜原子,白球表示氯原子)。
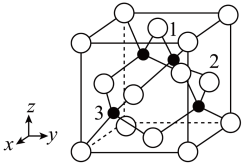
①已知铜和氯的电负性分别为1.9和3.0,则铜与氯形成的化合物属于_____ (填“离子”或“共价”)化合物。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为( ,
, ,1),则原子2和3的坐标分别为
,1),则原子2和3的坐标分别为_____ 、_____ 。
③已知该晶体的密度为 ,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为
,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为_____ pm(只写计算式)。
(1)
 的制备反应为
的制备反应为 。
。上述氧化过程中,
 (II)
(II) III)
III) (III)电子占据
(III)电子占据(2)对上述反应式中的短周期元素按照电负性由小到大排序为
(3)配合物
 的配位数为6,其配体
的配位数为6,其配体 中的
中的 的杂化方式为
的杂化方式为(4)铜原子与氯原子形成化合物的晶胞如图所示(黑球代表铜原子,白球表示氯原子)。

①已知铜和氯的电负性分别为1.9和3.0,则铜与氯形成的化合物属于
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为(
 ,
, ,1),则原子2和3的坐标分别为
,1),则原子2和3的坐标分别为③已知该晶体的密度为
 ,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为
,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为
您最近一年使用:0次



