名校
解题方法
1 . 氮元素是重要的非金属元素,可形成多种铵盐、氮化物、叠氮化物及配合物等。
(1)基态氮原子价电子的轨道表示式(价电子排布图)为___________ ;第二周期元素原子中第一电离能大于氮原子的有___________ 种, 中阴离子的空间构型为
中阴离子的空间构型为___________ 。
(2)C、N、O、S四种元素中,电负性最大的是___________ 。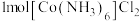 中含有σ键的数目为
中含有σ键的数目为___________ ;已知 比
比 的沸点低得多,试解释原因
的沸点低得多,试解释原因___________ 。
(3)含有多个配位原子的配体与同一中心离子(或原子)通过整合配位成环而形成的配合物为螯合物。一种 配合物的结构如图所示,1mol该螯合物中通过螯合作用形成的配位键有
配合物的结构如图所示,1mol该螯合物中通过螯合作用形成的配位键有___________ mol。 作简单立方堆积,两个立方体共用的面中心存在一个
作简单立方堆积,两个立方体共用的面中心存在一个 ,
, 位于立方体的体心,相邻的
位于立方体的体心,相邻的 的距离均为apm,阿伏加德罗常数的值为
的距离均为apm,阿伏加德罗常数的值为 ,该物质的化学式为
,该物质的化学式为___________ ,该晶体的密度为___________  。
。 可以与
可以与 、
、 等形成配合物。与
等形成配合物。与 互为等电子体且为非极性分子的化学式为
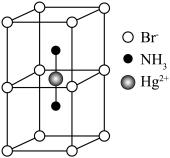
互为等电子体且为非极性分子的化学式为___________ 。在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比为___________ ,两种晶体中空间利用率较高的是___________ 。(填“图1”或“图2”)
(1)基态氮原子价电子的轨道表示式(价电子排布图)为
 中阴离子的空间构型为
中阴离子的空间构型为(2)C、N、O、S四种元素中,电负性最大的是
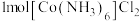 中含有σ键的数目为
中含有σ键的数目为 比
比 的沸点低得多,试解释原因
的沸点低得多,试解释原因(3)含有多个配位原子的配体与同一中心离子(或原子)通过整合配位成环而形成的配合物为螯合物。一种
 配合物的结构如图所示,1mol该螯合物中通过螯合作用形成的配位键有
配合物的结构如图所示,1mol该螯合物中通过螯合作用形成的配位键有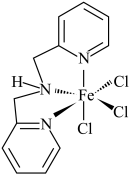
 作简单立方堆积,两个立方体共用的面中心存在一个
作简单立方堆积,两个立方体共用的面中心存在一个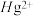 ,
, 位于立方体的体心,相邻的
位于立方体的体心,相邻的 的距离均为apm,阿伏加德罗常数的值为
的距离均为apm,阿伏加德罗常数的值为 ,该物质的化学式为
,该物质的化学式为 。
。
 可以与
可以与 、
、 等形成配合物。与
等形成配合物。与 互为等电子体且为非极性分子的化学式为
互为等电子体且为非极性分子的化学式为
您最近一年使用:0次
名校
2 . 五氧化二钒(V2O5)广泛用于冶金、化工等行业,一种以富钒炉渣(其中钒以FeO•V2O3、V2O5的形式存在,还有少量的SiO2、Al2O3等)为原料制备V2O5的流程如图所示:
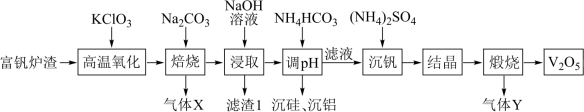
已知:①钒有多种价态,其中+5价最稳定;②V2O5在碱性条件下转化为 。
。
回答下列问题:
(1)基态V原子的价电子轨道表示式为_______ 。
(2)“滤渣1”的主要成分是一种红色固体,它的用途是_______ (写出一种即可)。
(3)“高温氧化”发生反应的化学方程式为_______ 。
(4)“调pH”步骤得到含铝沉淀的离子方程式为_______ 。
(5)“结晶”步骤得到的NH4VO3需进行水洗,证明NH4VO3已洗涤干净的实验操作及现象为_______ 。
(6)实验室“煅烧”使用的硅酸盐质仪器有酒精灯、泥三角和_______ 。
(7)钒的一种配合物的结构简式为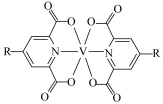 ,1mol该配合物中配体的数目为
,1mol该配合物中配体的数目为_______ (NA为阿伏加德罗常数的值)。

已知:①钒有多种价态,其中+5价最稳定;②V2O5在碱性条件下转化为
 。
。回答下列问题:
(1)基态V原子的价电子轨道表示式为
(2)“滤渣1”的主要成分是一种红色固体,它的用途是
(3)“高温氧化”发生反应的化学方程式为
(4)“调pH”步骤得到含铝沉淀的离子方程式为
(5)“结晶”步骤得到的NH4VO3需进行水洗,证明NH4VO3已洗涤干净的实验操作及现象为
(6)实验室“煅烧”使用的硅酸盐质仪器有酒精灯、泥三角和
(7)钒的一种配合物的结构简式为
 ,1mol该配合物中配体的数目为
,1mol该配合物中配体的数目为
您最近一年使用:0次
名校
3 . 我国科学家在研究点击化学过程中,意外发现一种新化合物,其结构式如图所示,其中X、Y、Z和W是原子序数依次增大的短周期元素,Y与W是同一主族元素。下列说法正确的是


A.第一电离能: |
| B.X的氢化物中只存在极性键 |
| C.电解Z的简单氢化物的水溶液可制得Z单质 |
| D.W的最高价含氧酸根的空间构型为三角锥形 |
您最近一年使用:0次
2024-04-03更新
|
168次组卷
|
2卷引用:2024届云南省曲靖市高三上学期第一次复习检测理综试卷-高中化学
4 . 褪黑素是迄今发现的最强的内源性自由基清除剂。褪黑素的基本功能就是参与抗氧化系统,防止细胞产生氧化损伤,在这方面,它的功效超过了已知的所有体内物质。某研究小组以乙炔为原料,设计合成褪黑素,合成路线如下(部分反应条件已省略):

已知:无水乙酸钠在碱石灰作用下发生反应:
回答下列问题:
(1)B→C的反应类型为___________ ,C中含氧官能团的名称为___________ ,C分子是否为手性分子:___________ (填“是”或“否”)。
(2)已知: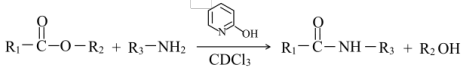 ,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间
,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间电负性差值大小 解释原因___________ 。
(3)E→F过程中,反应i的化学方程式为:___________ 。
(4)J的结构简式为___________ ,其中氮原子的杂化轨道类型为___________ 。
(5)写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式___________ 。
i.含有3个六元环,其中1个是苯环;
ii.含有 结构,不含
结构,不含 键;
键;
iii.含有4种不同化学环境的氢原子。
(6)综合上述信息并结合所学知识,在下图方框中填写合适的物质(写结构简式)。①________ ;②_________ ;③___________ 。


已知:无水乙酸钠在碱石灰作用下发生反应:

回答下列问题:
(1)B→C的反应类型为
(2)已知:
 ,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间
,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间| 元素 | H | C | O |
| 电负性 | 2.1 | 2.5 | 3.5 |
(3)E→F过程中,反应i的化学方程式为:
(4)J的结构简式为
(5)写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式
i.含有3个六元环,其中1个是苯环;
ii.含有
 结构,不含
结构,不含 键;
键;iii.含有4种不同化学环境的氢原子。
(6)综合上述信息并结合所学知识,在下图方框中填写合适的物质(写结构简式)。①

您最近一年使用:0次
解题方法
5 . 我国科学家在嫦娥五号月壤样品中发现一种新矿物“嫦娥石”,其中含有原子序数依次增大的短周期主族元素X、Y、Z、R。X在地壳中含量最多,Y的电子层数是其最外层电子数的3倍,基态Z原子无未成对电子,基态R原子的p轨道半充满。下列说法错误的是
| A.Y的简单离子半径比Z的简单离子半径大 |
| B.R的简单氢化物的VSEPR模型为三角锥形 |
| C.Z的第一电离能大于同周期相邻元素 |
| D.X、R的简单氢化物的稳定性前者强于后者 |
您最近一年使用:0次
6 . 某种双核钴配合物阳离子的结构如图。X的第一电离能在第二周期主族元素中位居第二,Y的核外电子只有一种运动状态,Z的一种同素异形体是极性分子。下列说法错误的是
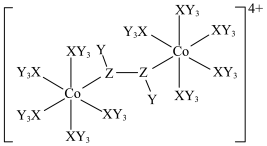
| A.简单氢化物的稳定性:Z>X |
| B.电负性:Z>X>Y |
| C.Co位于元素周期表ds区,在该阳离子中呈+2价 |
| D.从结构推测该配合物阳离子不稳定,且具有一定的氧化性 |
您最近一年使用:0次
2024-04-02更新
|
575次组卷
|
4卷引用:2024届东北三省三校高三下学期第二次联合模拟考试理综重组卷-高中化学
解题方法
7 . 科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种新型超分子,其分子结构如下图所示(Y和Y之间重复单元的W、X未全部标出),W、X、Z分别位于不同周期,Z是同周期中金属性最强的元素,下列说法正确的是


A.简单气态氢化物的沸点: |
B.第一电离能: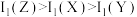 |
C.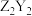 只含有离子键 只含有离子键 |
D.原子半径: |
您最近一年使用:0次
8 . 硒化锌(ZnSe)常用作荧光粉、电子工业掺杂材料和高纯试剂,也是一种重要的半导体材料。其中以锌矿(主要成分是ZnS,含少量 、CuS、NiS、
、CuS、NiS、 等)为原料制备ZnSe的工艺流程如下图所示:
等)为原料制备ZnSe的工艺流程如下图所示:
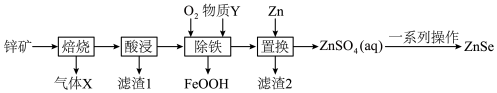
已知:pH较高时,FeOOH沉淀会转化成胶体。
(1)Se元素在周期表中的位置是_______ ,基态Zn原子的价层电子排布式为_______ 。
(2)写出气体X的一种用途_______ 。
(3)浸出液中含有 ,“除铁”步骤中通入氧气时发生反应的离子方程式为
,“除铁”步骤中通入氧气时发生反应的离子方程式为_______ ,同时需补充适量物质Y,Y是_______ (写出一种即可)。“除铁”最佳pH为3.0,如果pH过高,会导致溶液中 的含量降低,其主要原因是
的含量降低,其主要原因是_______ 。
(4)“置换”时滤渣2的主要成分为_______ 。也可以在酸性含 的溶液中加入锌粉和
的溶液中加入锌粉和 ,生成
,生成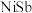 ,其离子方程式为
,其离子方程式为_______ 。
(5) 晶体与NaCl晶体的结构相似,
晶体与NaCl晶体的结构相似, 晶胞为正方体,边长为apm。其结构如图所示:
晶胞为正方体,边长为apm。其结构如图所示:
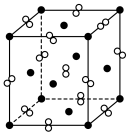
晶胞的密度ρ=_______ g·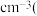 列出计算式,阿伏加德罗常数的值为
列出计算式,阿伏加德罗常数的值为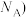 。
。
 、CuS、NiS、
、CuS、NiS、 等)为原料制备ZnSe的工艺流程如下图所示:
等)为原料制备ZnSe的工艺流程如下图所示:
已知:pH较高时,FeOOH沉淀会转化成胶体。
(1)Se元素在周期表中的位置是
(2)写出气体X的一种用途
(3)浸出液中含有
 ,“除铁”步骤中通入氧气时发生反应的离子方程式为
,“除铁”步骤中通入氧气时发生反应的离子方程式为 的含量降低,其主要原因是
的含量降低,其主要原因是(4)“置换”时滤渣2的主要成分为
 的溶液中加入锌粉和
的溶液中加入锌粉和 ,生成
,生成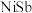 ,其离子方程式为
,其离子方程式为(5)
 晶体与NaCl晶体的结构相似,
晶体与NaCl晶体的结构相似, 晶胞为正方体,边长为apm。其结构如图所示:
晶胞为正方体,边长为apm。其结构如图所示:
晶胞的密度ρ=
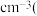 列出计算式,阿伏加德罗常数的值为
列出计算式,阿伏加德罗常数的值为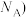 。
。
您最近一年使用:0次
9 . 元素X的价电子排布为(n+1)sn(n+1)pn+2,元素Y位于第四周期的ds区,其基态原子不存在不成对电子。X与Y所形成化合物晶体的晶胞如图所示。下列说法错误的是
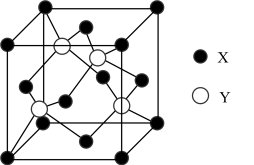

| A.X元素可形成多种同素异形体 | B.晶胞中含有4个X原子 |
| C.X、Y形成的晶体属于原子晶体 | D.X与Y所形成化合物晶体的化学式为YX |
您最近一年使用:0次
名校
解题方法
10 . 下列叙述正确的是
| A.第三能层某能级的符号为3f |
| B.同一能层中的不同能级的能量高低相同 |
| C.每个能层最多可容纳的电子数是2n2 |
| D.3d能级最多容纳5个电子 |
您最近一年使用:0次
2024-03-28更新
|
94次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高二下学期3月月考化学试题



