名校
解题方法
1 . X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)Y在元素周期表中的位置为________ 。
(2)Z、Q、R的简单离子半径由小到大的顺序为________ (用化学用语表示,下同);写出Q、R最高价氧化物的水化物相互反应的化学方程式:________ ;Q、R简单离子中氧化性比较小的是_______ 。
(3)上述五种元素的某些元素可形成既含离子键又含非极性共价键的化合物,写出其中一种化合物的电子式________ 。
(4)Z、X两元素按原子数目比1:1和1:2构成分子A和B,A的结构式为_______ 。
(5)QX的电子式为_______ 。
(6)下列事实能说明Z元素的非金属性比S元素的非金属性强的是_______ (填序号)。
a.Z单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molZ单质比1molS得电子多
c.Z和S两元素的简单氢化物受热分解,前者的分解温度高
(7)制备单质R时,电解熔点很高的R的氧化物而不电解熔点相对低的R的氯化物的原因是_______ 。
(1)Y在元素周期表中的位置为
(2)Z、Q、R的简单离子半径由小到大的顺序为
(3)上述五种元素的某些元素可形成既含离子键又含非极性共价键的化合物,写出其中一种化合物的电子式
(4)Z、X两元素按原子数目比1:1和1:2构成分子A和B,A的结构式为
(5)QX的电子式为
(6)下列事实能说明Z元素的非金属性比S元素的非金属性强的是
a.Z单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molZ单质比1molS得电子多
c.Z和S两元素的简单氢化物受热分解,前者的分解温度高
(7)制备单质R时,电解熔点很高的R的氧化物而不电解熔点相对低的R的氯化物的原因是
您最近一年使用:0次
2023-08-28更新
|
70次组卷
|
2卷引用:河南省焦作市博爱县第一中学2023-2024学年高三上学期8月月考化学试题
名校
解题方法
2 . X、Y、Z、M、Q、R是元素周期表前四周期元素,且原子序数依次增大,根据下表相关信息完成以下问题:
(1)请写出Q元素基态原子的价电子排布图:_______ 。
(2)X、Y、Z、M四种元素的原子半径由小到大的顺序是_______ (用元素符号表示)。
(3)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是_______ 。
(4)X、Y、Q三种元素简单气态氢化物稳定性由大到小_______ (用物质符号表示)。
(5)Z的氯化物比M的氯化物熔点高原因是_______ 。
(6)实验发现M的氯化物处于熔融状态时常以二聚态(M2Cl6)形式存在。其球棍模型如图。

①该分子中M原子采取_______ 杂化。
②M2Cl6与过量NaOH溶液反应生成Na[M(OH)4],[M(OH)4]-中存在的化学键类型有_______ (填标号)。
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
| 元素 | 相关信息 |
| X | 原子核外有6种不同运动状态的电子 |
| Y | 基态原子中s电子总数与p电子总数相等 |
| Z | 原子半径在同周期元素中最大 |
| M | 逐级电离能(kJ·mol-1)依次为578、1817、2745、11575、14830、18376 |
| Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
| R | 基态原子核外有4个未成对电子 |
(2)X、Y、Z、M四种元素的原子半径由小到大的顺序是
(3)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是
(4)X、Y、Q三种元素简单气态氢化物稳定性由大到小
(5)Z的氯化物比M的氯化物熔点高原因是
(6)实验发现M的氯化物处于熔融状态时常以二聚态(M2Cl6)形式存在。其球棍模型如图。

①该分子中M原子采取
②M2Cl6与过量NaOH溶液反应生成Na[M(OH)4],[M(OH)4]-中存在的化学键类型有
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
您最近一年使用:0次
2023-08-26更新
|
246次组卷
|
2卷引用:辽宁省大连市第八中学2022-2023学年高三上学期10月月考化学试题
2023高三·全国·专题练习
3 . 现有部分元素的原子结构特点如下表所示:
(1)画出G原子结构示意图:____________________ 。
(2)元素X与元素Z相比,非金属性较强的是_________________ (填元素名称),写出一个能表示X、Z非金属性强弱关系的化学方程式:_________ 。
(3)X、Y、Z、G四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为___ 。
(4)元素X和元素Y以原子个数比为1∶1形成的化合物Q,元素G和元素Y化合形成的化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的,且在自然界中稳定存在的物质,写出该反应的化学方程式:________ 。
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
G | 最外层电子数是次外层电子数的2.5倍 |
(2)元素X与元素Z相比,非金属性较强的是
(3)X、Y、Z、G四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为
(4)元素X和元素Y以原子个数比为1∶1形成的化合物Q,元素G和元素Y化合形成的化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的,且在自然界中稳定存在的物质,写出该反应的化学方程式:
您最近一年使用:0次
解题方法
4 . Li3OX(图a)和Li2OHX(图b)的晶胞结构,如图所示。
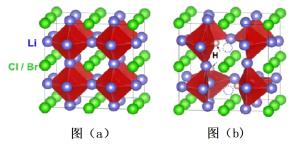
请回答下列问题:
(1)基态氯原子的价层电子排布式为_____ 。基态溴原子核外电子有_____ 种不同的空间运动状态。
(2)离子半径,r(Li+)=76pm,r(H-)=208pm,H-半径大于Li+的原因是_____ 。
(3)下列含锂的粒子中,失去1个电子需要的能量最低的是_____。
(4)已知几种元素的电负性数据如下:
①PBr3分子的空间结构是_____ 。在H2O、HCl、HBr、PH3中,共价键极性最弱的是_____ (填化学式)。。
②已知PCl5分子中P原子的s、p、d轨道参与杂化。试解释存在PCl5,不存在NCl5的主要原因可能是_____ 。
③在LiH、Li2O、LiCl、LiBr中,离子键百分率最高的是_____ (填化学式)。
(5)1个图b(Li2OHCl)晶胞的质量为_____ g(只列计算式)。
(6)如图a,晶胞参数为Apm,NA为阿伏加德罗常数的值。Li3OBr晶体密度为_____ g·cm-3(只列计算式)。

请回答下列问题:
(1)基态氯原子的价层电子排布式为
(2)离子半径,r(Li+)=76pm,r(H-)=208pm,H-半径大于Li+的原因是
(3)下列含锂的粒子中,失去1个电子需要的能量最低的是_____。
| A.1s22s1 | B.1s2 | C.1s12s1 | D.1s23s1 |
| 元素 | O | H | Cl | Br | P |
| 电负性 | 3.5 | 2.1 | 3.0 | 2.8 | 2.1 |
②已知PCl5分子中P原子的s、p、d轨道参与杂化。试解释存在PCl5,不存在NCl5的主要原因可能是
③在LiH、Li2O、LiCl、LiBr中,离子键百分率最高的是
(5)1个图b(Li2OHCl)晶胞的质量为
(6)如图a,晶胞参数为Apm,NA为阿伏加德罗常数的值。Li3OBr晶体密度为
您最近一年使用:0次
解题方法
5 .  是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
(1) 与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为
与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为___________ 。
(2) 可形成
可形成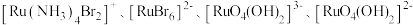 四种配离子且配离子中不存在非极性键,其中
四种配离子且配离子中不存在非极性键,其中 离子半径最小的配离子是
离子半径最小的配离子是___________ ,具有对称结构的 中
中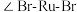 为
为___________ 。图1中通过螯合作用形成配位键的N原子的杂化方式为___________ , 离子配体中N原子与中心
离子配体中N原子与中心 离子配位的原因是
离子配位的原因是___________ 。

(3) 的晶体结构如图2所示。
的晶体结构如图2所示。
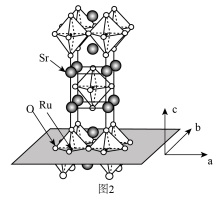
① 和
和 的电负性:
的电负性:
___________  (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为
(填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为___________ 形。
②用 表示阿伏伽德罗常数的值,晶胞参数为
表示阿伏伽德罗常数的值,晶胞参数为 ,
, ,则其密度为
,则其密度为___________  (列出计算式即可)。
(列出计算式即可)。
 是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:(1)
 与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为
与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为(2)
 可形成
可形成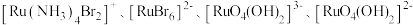 四种配离子且配离子中不存在非极性键,其中
四种配离子且配离子中不存在非极性键,其中 离子半径最小的配离子是
离子半径最小的配离子是 中
中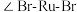 为
为 离子配体中N原子与中心
离子配体中N原子与中心 离子配位的原因是
离子配位的原因是
(3)
 的晶体结构如图2所示。
的晶体结构如图2所示。
①
 和
和 的电负性:
的电负性:
 (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为
(填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为②用
 表示阿伏伽德罗常数的值,晶胞参数为
表示阿伏伽德罗常数的值,晶胞参数为 ,
, ,则其密度为
,则其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
名校
解题方法
6 . W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,请用对应的的化学用语回答下列问题:
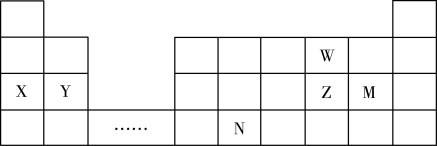
(1)N元素在周期表中的位置___________ ,根据周期表,推测N原子序数为___________
(2)比较Y、Z、W三种元素形成简单离子的半径由大到小的顺序___________ (用元素符号表示)
(3)M最高价氧化物的水化物在水中的电离方程式:___________
(4)以下说法正确的是___________
(5)由X、W元素构成的原子个数比为1:1的化合物所含化学键类型为___________ ,将一定量此化合物投入到足量的水中,产生2.24L气体(标准状况下),转移电子的物质的量为________ 。

(1)N元素在周期表中的位置
(2)比较Y、Z、W三种元素形成简单离子的半径由大到小的顺序
(3)M最高价氧化物的水化物在水中的电离方程式:
(4)以下说法正确的是___________
| A.单质的还原性:X>Y,可以用X与YM2溶液发生反应置换出Y来证明 |
| B.Y与同周期的ⅢA元素的原子序数相差1 |
| C.硅主要用于半导体器件的研制,目前用硅研发出的太阳能光伏电池,如我校的路灯 |
| D.元素N位于金属与非金属的分界线附近,可以推断N元素的单质可与氨水反应放出氢气 |
您最近一年使用:0次
解题方法
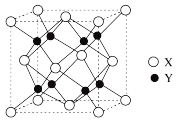
7 . 硼化合物在工农业和医药方面用途广泛。请回答:
(1) B(OH)3分子的空间结构(以B为中心)名称是_______ ,硼原子的杂化轨道类型是_______ 。B(OH)3的水溶液呈酸性的原因是_______
(2)Li、Be、B在元素周期表上处于相邻位置,正确的是_______。
(3)B与La形成的某化合物晶体结构如下图。立方体的每一个顶点上都有一个由硼原子框架形成的八面体,八面体又以顶点互相连接。该化合物的化学式为_______ ,该晶体中La的配位数是_______ 。

(1) B(OH)3分子的空间结构(以B为中心)名称是
(2)Li、Be、B在元素周期表上处于相邻位置,正确的是_______。
A.基态原子半径: | B.电负性: |
C.第一电离能: | D.第二电离能: |

您最近一年使用:0次
名校
解题方法
8 . 三卤化氮( )如
)如 、
、 等有广泛的用途。
等有广泛的用途。 是液晶显示器生产过程中常用的化学清洗剂,
是液晶显示器生产过程中常用的化学清洗剂, 可用于面粉的漂白和杀菌。回答下面问题:
可用于面粉的漂白和杀菌。回答下面问题:
(1)锑是制造液晶显示器的一种原材料,基态锑的价层电子排布式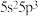 ,可知锑在元素周期表的位置是
,可知锑在元素周期表的位置是___________ 。基态锑原子中有___________ 个未成对电子,这些未成对电子具有___________ (填“相同”或“不同”)的自旋状态。
(2)元素F、O、N位于同一周期,其第一电离能由大到小的顺序是___________ ,原子半径由大到小的顺序是___________ 。
(3)液晶显示器材料因含微量杂质元素铬(Cr)而呈浅红色。基态铬原子的价层电子排布式为___________ 。液晶在放电过程中会产生 和
和 离子,其中N原子的杂化类型分别是
离子,其中N原子的杂化类型分别是___________ ,键角:
___________  (填“<”或“=”或“>”)。
(填“<”或“=”或“>”)。
(4)已知热稳定性 高于
高于 ,解释其原因是
,解释其原因是___________ 。常温常压下 为无色气体,
为无色气体, 为黄色油状液体,
为黄色油状液体, 和
和 价层电子对互斥模型均为
价层电子对互斥模型均为___________ , 和
和 的分子空间构型均为
的分子空间构型均为___________ 。
(5) 的晶胞结构如图所示,X代表的离子是
的晶胞结构如图所示,X代表的离子是___________ ;若该立方晶胞参数为apm, 的摩尔质量用
的摩尔质量用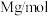 ,阿伏加德罗常数用
,阿伏加德罗常数用 来表示,则
来表示,则 晶体的密度=
晶体的密度=___________  (写出表达式)。
(写出表达式)。
 )如
)如 、
、 等有广泛的用途。
等有广泛的用途。 是液晶显示器生产过程中常用的化学清洗剂,
是液晶显示器生产过程中常用的化学清洗剂, 可用于面粉的漂白和杀菌。回答下面问题:
可用于面粉的漂白和杀菌。回答下面问题:(1)锑是制造液晶显示器的一种原材料,基态锑的价层电子排布式
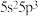 ,可知锑在元素周期表的位置是
,可知锑在元素周期表的位置是(2)元素F、O、N位于同一周期,其第一电离能由大到小的顺序是
(3)液晶显示器材料因含微量杂质元素铬(Cr)而呈浅红色。基态铬原子的价层电子排布式为
 和
和 离子,其中N原子的杂化类型分别是
离子,其中N原子的杂化类型分别是
 (填“<”或“=”或“>”)。
(填“<”或“=”或“>”)。(4)已知热稳定性
 高于
高于 ,解释其原因是
,解释其原因是 为无色气体,
为无色气体, 为黄色油状液体,
为黄色油状液体, 和
和 价层电子对互斥模型均为
价层电子对互斥模型均为 和
和 的分子空间构型均为
的分子空间构型均为(5)
 的晶胞结构如图所示,X代表的离子是
的晶胞结构如图所示,X代表的离子是 的摩尔质量用
的摩尔质量用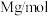 ,阿伏加德罗常数用
,阿伏加德罗常数用 来表示,则
来表示,则 晶体的密度=
晶体的密度= (写出表达式)。
(写出表达式)。
您最近一年使用:0次
2023-05-14更新
|
93次组卷
|
3卷引用:河北省石家庄市河北师范大学附属实验中学2024届高三上学期10月月考化学试题
解题方法
9 . 锂离子电池是目前广泛应用的二次电池。由于锂资源储量有限,科学家将目光转向钾离子电池。
(1) 用作钾离子电池的电解液溶剂,可由
用作钾离子电池的电解液溶剂,可由 与有机物X经加成反应得到。
与有机物X经加成反应得到。
① 中碳原子杂化方式为
中碳原子杂化方式为_______ 。
②X的结构简式为_______ 。
(2)由于离子半径:
_______  (填“>”或“<”),在充、放电过程中,
(填“>”或“<”),在充、放电过程中, 的嵌入、脱出会破坏锂离子电池正极材料的结构,应研发新的正极材料。
的嵌入、脱出会破坏锂离子电池正极材料的结构,应研发新的正极材料。
(3)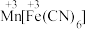 可用作钾离子电池的正极材料,其晶胞结构如下图所示。
可用作钾离子电池的正极材料,其晶胞结构如下图所示。

①距离 最近的
最近的 有
有_______ 个。
②第三电离能 :
: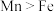 ,结合原子结构解释原因:
,结合原子结构解释原因:_______ 。
③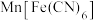 放电后转化为
放电后转化为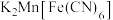 ,充电时物质的变化如下:
,充电时物质的变化如下: 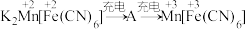 。充电时生成A的电极反应式:
。充电时生成A的电极反应式:_______ (请标注A中 和
和 的化合价)。
的化合价)。
(1)
 用作钾离子电池的电解液溶剂,可由
用作钾离子电池的电解液溶剂,可由 与有机物X经加成反应得到。
与有机物X经加成反应得到。①
 中碳原子杂化方式为
中碳原子杂化方式为②X的结构简式为
(2)由于离子半径:

 (填“>”或“<”),在充、放电过程中,
(填“>”或“<”),在充、放电过程中, 的嵌入、脱出会破坏锂离子电池正极材料的结构,应研发新的正极材料。
的嵌入、脱出会破坏锂离子电池正极材料的结构,应研发新的正极材料。(3)
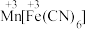 可用作钾离子电池的正极材料,其晶胞结构如下图所示。
可用作钾离子电池的正极材料,其晶胞结构如下图所示。
①距离
 最近的
最近的 有
有②第三电离能
 :
: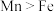 ,结合原子结构解释原因:
,结合原子结构解释原因:③
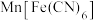 放电后转化为
放电后转化为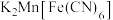 ,充电时物质的变化如下:
,充电时物质的变化如下: 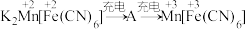 。充电时生成A的电极反应式:
。充电时生成A的电极反应式: 和
和 的化合价)。
的化合价)。
您最近一年使用:0次
解题方法
10 . 一种新型硫酸盐功能电解液由2mol·L-1Na2SO4和0.3mol·L-1MgSO4混合组成,电化学测试表明该电解液构建的Na2Ni[Fe(CN)6]、NaTi2(PO4)3/C电池可以稳定循环500次以上。
请回答下列问题:
(1)MgSO4中三种原子的半径由大到小的顺序是___________ (用元素符号表示),其中电负性最大的元素是___________ (填名称)。
(2)第一电离能N>O的原因是___________ 。
(3)Na2Ni[Fe(CN)6]中,基态Fe2+核外电子的空间运动状态有___________ 种,[Fe(CN)6]4-中σ键和π键的数目之比为___________ 。
(4)NaTi2(PO4)3中, 中磷原子的杂化类型是
中磷原子的杂化类型是___________ 。
(5)N、O两种元素形成的简单氢化物的熔点:NH3___________ H2O(填“>”“<”或“=”),其原因是___________ 。
(6)NiaMgbFec的立方晶胞结构如图所示。已知晶胞的边长为npm,设NA为阿伏加德罗常数的值。

①a:b:c=___________ 。
②该晶体密度是___________ g·cm-3(用含n、NA的代数式表示)。
请回答下列问题:
(1)MgSO4中三种原子的半径由大到小的顺序是
(2)第一电离能N>O的原因是
(3)Na2Ni[Fe(CN)6]中,基态Fe2+核外电子的空间运动状态有
(4)NaTi2(PO4)3中,
 中磷原子的杂化类型是
中磷原子的杂化类型是(5)N、O两种元素形成的简单氢化物的熔点:NH3
(6)NiaMgbFec的立方晶胞结构如图所示。已知晶胞的边长为npm,设NA为阿伏加德罗常数的值。

①a:b:c=
②该晶体密度是
您最近一年使用:0次
2023-04-26更新
|
279次组卷
|
3卷引用:河南省名校大联考2023届高三下学期三模考试理综化学试题
河南省名校大联考2023届高三下学期三模考试理综化学试题(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)新疆疏附县第一中学2023-2024学年高三上学期开学摸底测试化学试题



