解题方法
1 . 发蓝工艺是将钢铁浸入热的NaNO2碱性溶液中,在其表面形成一层四氧化三铁薄膜。其中铁经历了如下转化:

其中②的化学方程式为:Na2FeO2+NaNO2+H2O Na2Fe2O4+NH3↑+NaOH(未配平)。
Na2Fe2O4+NH3↑+NaOH(未配平)。
完成下列填空:
(1)Na原子核外有_______ 种能量不同的电子,其中能量最高的电子所占的电子亚层符号为_______ 。将反应②中涉及的短周期元素,按原子半径由大到小顺序排列。_______
(2)NH3分子的结构式为_______ 。从原子结构的角度解释氮元素的非金属性比氧元素弱的原因。_______
(3)配平反应②的化学方程式______ 。若反应生成11.2 L(标准状态)氨气,则电子转移的数目为_______ 。
(4)反应③中Na2FeO2与Na2Fe2O4的物质的量之比为_______ 。写出Fe→Fe3O4的置换反应的化学方程式_______

其中②的化学方程式为:Na2FeO2+NaNO2+H2O
 Na2Fe2O4+NH3↑+NaOH(未配平)。
Na2Fe2O4+NH3↑+NaOH(未配平)。完成下列填空:
(1)Na原子核外有
(2)NH3分子的结构式为
(3)配平反应②的化学方程式
(4)反应③中Na2FeO2与Na2Fe2O4的物质的量之比为
您最近一年使用:0次
名校
解题方法
2 . 铝、硅、磷三种元素的单质及其化合物在生产生活中有广泛应用。
(1)基态硅原子的价电子的轨道表达式_______ ;第三周期元素中第一电离能介于铝和磷元素之间的有_______ (填元素符号)。
(2)比较铝、磷元素的简单离子半径_______ (用相关化学符号表示)。
(3)下列关于三种元素的化合物的叙述正确的是_______ 。
①三种元素的最高价氧化物均能与水直接化合
②三种元素的最高价氧化物均存在晶体形式,且晶体类型不同
③ 、
、 均既能与酸又能与碱反应,均属于两性氧化物
均既能与酸又能与碱反应,均属于两性氧化物
(4) 与
与 比较,沸点较高的是
比较,沸点较高的是_______ ,两种分子中键角较大的是_______ ,其中 的分子构型为
的分子构型为_______ 。
(5)三种单质的晶胞结构如下
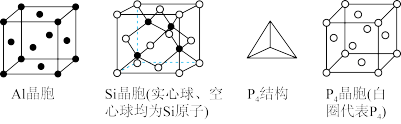
这三种晶胞中的原子的个数比为_______ 。
(6)①工业由粗硅制高纯硅的化学方程式_______ 。
②利用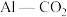 电池(工作原理如下图所示)能有效地将
电池(工作原理如下图所示)能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝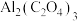 ,根据图示,下列表述正确的是
,根据图示,下列表述正确的是_______ 。

A.该电池的使用可有效利用
B.电池工作时,电流从铝电极流向多孔碳电极
C. 在整个反应过程中的作用是催化剂
在整个反应过程中的作用是催化剂
D.含 的离子液体是熔融态的
的离子液体是熔融态的
(1)基态硅原子的价电子的轨道表达式
(2)比较铝、磷元素的简单离子半径
(3)下列关于三种元素的化合物的叙述正确的是
①三种元素的最高价氧化物均能与水直接化合
②三种元素的最高价氧化物均存在晶体形式,且晶体类型不同
③
 、
、 均既能与酸又能与碱反应,均属于两性氧化物
均既能与酸又能与碱反应,均属于两性氧化物(4)
 与
与 比较,沸点较高的是
比较,沸点较高的是 的分子构型为
的分子构型为(5)三种单质的晶胞结构如下

这三种晶胞中的原子的个数比为
(6)①工业由粗硅制高纯硅的化学方程式
②利用
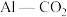 电池(工作原理如下图所示)能有效地将
电池(工作原理如下图所示)能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝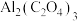 ,根据图示,下列表述正确的是
,根据图示,下列表述正确的是
A.该电池的使用可有效利用

B.电池工作时,电流从铝电极流向多孔碳电极
C.
 在整个反应过程中的作用是催化剂
在整个反应过程中的作用是催化剂D.含
 的离子液体是熔融态的
的离子液体是熔融态的
您最近一年使用:0次
2022-06-20更新
|
475次组卷
|
2卷引用:天津市耀华中学2022届高三下学期一模化学试题
名校
解题方法
3 . 下表列出了①~⑩十种元素在周期表中的位置:
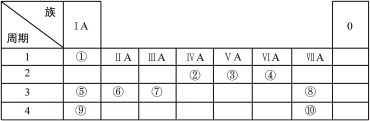
请按要求回答下列问题:
(1)元素⑤的离子结构示意图为_______ ;元素②的最高价氧化物的电子式是_______ 。
(2)⑤、⑥、⑨三种元素原子半径由大到小的顺序是_______ (填元素符号);这三种元素最高价氧化物对应水化物中碱性最强的是_______ (填化学式)。
(3)③、④元素的简单氢化物的稳定性较弱的是_______ (填化学式)。
(4)①、②、④三种元素形成的有机物的分子结构模型如下图所示,写出该有机物的结构简式:_______ ;

①与②所形成的最简单的烯烃与溴的四氯化碳溶液反应的化学方程式:_______ 。
(5)元素⑦的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式;_______ 。
(6)写出元素⑨的单质与水反应的化学方程式:_______ 。
(7)请从原子结构的角度解释,元素⑧非金属性比元素⑩强的原因:_______ 。

请按要求回答下列问题:
(1)元素⑤的离子结构示意图为
(2)⑤、⑥、⑨三种元素原子半径由大到小的顺序是
(3)③、④元素的简单氢化物的稳定性较弱的是
(4)①、②、④三种元素形成的有机物的分子结构模型如下图所示,写出该有机物的结构简式:

①与②所形成的最简单的烯烃与溴的四氯化碳溶液反应的化学方程式:
(5)元素⑦的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式;
(6)写出元素⑨的单质与水反应的化学方程式:
(7)请从原子结构的角度解释,元素⑧非金属性比元素⑩强的原因:
您最近一年使用:0次
2022-06-17更新
|
174次组卷
|
2卷引用:新疆塔城地区第二中学2022-2023学年高三上学期11月月考化学(A)试题
名校
4 . 硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。某些硅酸盐具有筛选分子的功能,一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期。两元素原子的质子数之和为24。
(1)该硅酸盐中同周期元素原子半径由大到小的顺序为_______ ;写出M原子核外能量最高的电子的电子排布式为_______ ;
(2)常温下,不能与R单质发生反应的是_______ (选填序号);
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.Na2CO3溶液
(3)写出M、R两种元素的最高价氧化物对应的水化物反应的离子方程式_______ 。
(4) 氮化硅(Si3N4)陶瓷材料硬度大、熔点高。Si3N4晶体中只有极性共价键,则氮原子的化合价为_______ 。
(5)C3N4的结构与Si3N4相似。请比较二者熔点高低并说明理由:_______ 。
(6)可由下列反应制得Si3N4,配平该反应并标出电子转移的数目和方向:_______ 。
_______SiO2+_______C+_______N2 _______Si3N4+_______CO
_______Si3N4+_______CO
(7)如果上述反应在10L的密闭容器中进行,一段时间后测得气体密度增加了2.8g/L,则制得的Si3N4质量为_______ 。
(1)该硅酸盐中同周期元素原子半径由大到小的顺序为
(2)常温下,不能与R单质发生反应的是
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.Na2CO3溶液
(3)写出M、R两种元素的最高价氧化物对应的水化物反应的离子方程式
(4) 氮化硅(Si3N4)陶瓷材料硬度大、熔点高。Si3N4晶体中只有极性共价键,则氮原子的化合价为
(5)C3N4的结构与Si3N4相似。请比较二者熔点高低并说明理由:
(6)可由下列反应制得Si3N4,配平该反应并标出电子转移的数目和方向:
_______SiO2+_______C+_______N2
 _______Si3N4+_______CO
_______Si3N4+_______CO(7)如果上述反应在10L的密闭容器中进行,一段时间后测得气体密度增加了2.8g/L,则制得的Si3N4质量为
您最近一年使用:0次
21-22高一上·甘肃庆阳·期末
解题方法
5 . 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题。
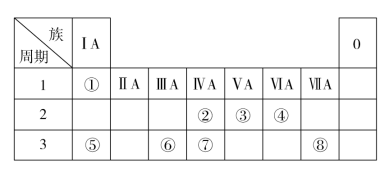
(1)地壳中含量居于第二位的元素在周期表中的位置是____ 。
(2)④和⑤可形成既含离子键又含共价键的离子化合物,写出该化合物的电子式:____ ;用电子式表示①和⑧组成的化合物的形成过程:____ 。
(3)③④⑧的简单气态氢化物的稳定性中大到小是____ (用化学式表示);③④⑤⑥的简单离子的半径由大到小是____ (用化学符号表示)。
(4)⑤⑥的最高价氧化物的水化物可发生反应,其反应的化学方程式为____ 。
(5)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是____ (填字母序号)。
(6)已知X为第四周期第IIA族元素,其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为____ 。

(1)地壳中含量居于第二位的元素在周期表中的位置是
(2)④和⑤可形成既含离子键又含共价键的离子化合物,写出该化合物的电子式:
(3)③④⑧的简单气态氢化物的稳定性中大到小是
(4)⑤⑥的最高价氧化物的水化物可发生反应,其反应的化学方程式为
(5)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是
| A.最高正化合价为+6 |
| B.气态氢化物比H2S稳定 |
| C.最高价氧化物对应水化物的酸性比硫酸弱 |
| D.单质在常温下可与氢气化合 |
(6)已知X为第四周期第IIA族元素,其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为
您最近一年使用:0次
名校
解题方法
6 . 亚硝酰氯NOCl常用于合成洗涤剂、触媒及用作中间体,其熔点为-64.5℃,沸点-5.5℃,遇水易水解为两种酸。某学习小组在实验室用 与NO制备NOCl并测定其纯度,进行如下实验(部分夹持装置已略去)。
与NO制备NOCl并测定其纯度,进行如下实验(部分夹持装置已略去)。
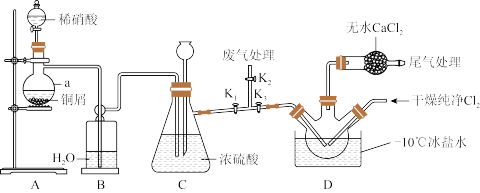
(1)实验室用 制取
制取 的离子方程式为
的离子方程式为_______ 。
(2)装置A中仪器a的名称为_______ ,装置C中长颈漏斗的作用是_______ 。
(3)若不用装置D中的干燥管,对实验有何影响_______ (用化学方程式表示)。
(4)N、O、Cl的简单离子中半径最小的是_______ (填离子符号),简单氢化物的熔沸点由高到低的顺序是_______ (用化学式表示)。
(5)通过以下实验测定NOCl样品的纯度。取D中所得液体10g溶于适量的NaOH溶液中,配制成250mL溶液;取出25.00mL于锥形瓶中,用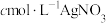 。标准溶液滴定,滴定终点时(只生成AgCl沉淀)消耗标准溶液的体积为20.00mL。则亚硝酰氯(NOCL)样品的纯度为
。标准溶液滴定,滴定终点时(只生成AgCl沉淀)消耗标准溶液的体积为20.00mL。则亚硝酰氯(NOCL)样品的纯度为_______ 。
 与NO制备NOCl并测定其纯度,进行如下实验(部分夹持装置已略去)。
与NO制备NOCl并测定其纯度,进行如下实验(部分夹持装置已略去)。
(1)实验室用
 制取
制取 的离子方程式为
的离子方程式为(2)装置A中仪器a的名称为
(3)若不用装置D中的干燥管,对实验有何影响
(4)N、O、Cl的简单离子中半径最小的是
(5)通过以下实验测定NOCl样品的纯度。取D中所得液体10g溶于适量的NaOH溶液中,配制成250mL溶液;取出25.00mL于锥形瓶中,用
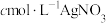 。标准溶液滴定,滴定终点时(只生成AgCl沉淀)消耗标准溶液的体积为20.00mL。则亚硝酰氯(NOCL)样品的纯度为
。标准溶液滴定,滴定终点时(只生成AgCl沉淀)消耗标准溶液的体积为20.00mL。则亚硝酰氯(NOCL)样品的纯度为
您最近一年使用:0次
2022-05-29更新
|
305次组卷
|
3卷引用:新疆生产建设兵团第六师五家渠高级中学2022-2023学年高三2月月考化学试题
解题方法
7 . 下表列出了①~⑨九种元素在周期表中的位置元素,完成下列各小题。
(1)第3周期中金属性最强的元素是_______ (填元素名称)。
(2)⑧原子结构示意图为_______ 。
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是_______ (填化学式)。
(4)①、②和③原子半径由小到大的顺序是_______ 。
(5)第3周期中气态氢化物最稳定的是_______ (填化学式)。
(6)⑦是带来人类文明的重要元素之一,其氧化物化学式是_______ ,常用于制造_______ (填一种高性能的现代通信材料的名称)。
(7)⑥是大自然赐予人类的宝物。它其中的一个用途是作为铝热剂,该反应的化学方程式为_______ 。
(8)②元素形成的一种氢化物的化学式是_______ ,俗话说“雷雨发庄稼”,请写出二氧化氮溶于水的化学反应方程式_______ 。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)⑧原子结构示意图为
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是
(4)①、②和③原子半径由小到大的顺序是
(5)第3周期中气态氢化物最稳定的是
(6)⑦是带来人类文明的重要元素之一,其氧化物化学式是
(7)⑥是大自然赐予人类的宝物。它其中的一个用途是作为铝热剂,该反应的化学方程式为
(8)②元素形成的一种氢化物的化学式是
您最近一年使用:0次
名校
8 . 因在航空、核能、电池等高技术领域的重要作用——锂被称为“21世纪的能源金属”。
(1)锂在元素周期表中的位置_______ 。锂的很多化学性质与镁相似,请依据元素周期律进行解释:_______ 。
(2)氢化锂(LiH)是离子化合物,写出其电子式_______ ,LiH中阴离子半径大于阳离子半径,其原因是_______ 。
工业上用 制取锂的化合物及金属锂。
制取锂的化合物及金属锂。
(3)碳原子核外电子有_______ 种不同能量的电子,其中有两个电子的能量最高且能量相等,这两个电子所处的轨道是_______ 。
(4)用 、氨水和液溴制备
、氨水和液溴制备 的流程如下:
的流程如下:

①合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:_______ 。
_______ +_______
+_______ _______
_______
 _______
_______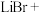 _______
_______
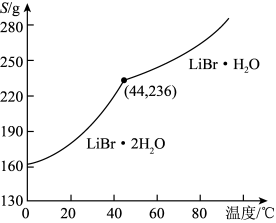
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到 晶体的实验步骤:
晶体的实验步骤:_______ 、过滤、用乙醇洗涤,干燥。
(1)锂在元素周期表中的位置
(2)氢化锂(LiH)是离子化合物,写出其电子式
工业上用
 制取锂的化合物及金属锂。
制取锂的化合物及金属锂。(3)碳原子核外电子有
(4)用
 、氨水和液溴制备
、氨水和液溴制备 的流程如下:
的流程如下:
①合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:
_______
 +_______
+_______ _______
_______
 _______
_______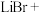 _______
_______②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到
 晶体的实验步骤:
晶体的实验步骤:
您最近一年使用:0次
9 . 卤族元素在自然界中主要以卤化物形式存在,完成下列填空:
(1)工业电解铝以铝土矿(Al2O3)为原料,冰晶石(Na3AlF4)为助熔剂。
①铝土矿中 的晶体类型
的晶体类型_______ ;
②比较 的简单离子半径大小
的简单离子半径大小_______ ;
③ 最外层电子的电子云形状为
最外层电子的电子云形状为_______ 。
(2)从海水中获取的 主要用于氯碱工业,写出阳极的电极反应
主要用于氯碱工业,写出阳极的电极反应_______ 。
(3)采用“空气吹出法”从浓海水中吹出 ,并用纯碱吸收。纯碱吸收
,并用纯碱吸收。纯碱吸收 的主要反应为:
的主要反应为: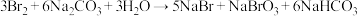 ,吸收
,吸收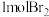 时,转移电子为
时,转移电子为_______ mol。
(4)工业生产纯碱的方法是:向饱和食盐水中通入 和
和 ,即有
,即有 晶体析出。结合速率与平衡理论解释
晶体析出。结合速率与平衡理论解释 析出的原因
析出的原因_______ 。
(5)向碘水溶液中通入过量的 ,发生反应:
,发生反应: ,配平上述方程式
,配平上述方程式_______ 。
(1)工业电解铝以铝土矿(Al2O3)为原料,冰晶石(Na3AlF4)为助熔剂。
①铝土矿中
 的晶体类型
的晶体类型②比较
 的简单离子半径大小
的简单离子半径大小③
 最外层电子的电子云形状为
最外层电子的电子云形状为(2)从海水中获取的
 主要用于氯碱工业,写出阳极的电极反应
主要用于氯碱工业,写出阳极的电极反应(3)采用“空气吹出法”从浓海水中吹出
 ,并用纯碱吸收。纯碱吸收
,并用纯碱吸收。纯碱吸收 的主要反应为:
的主要反应为: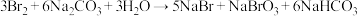 ,吸收
,吸收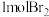 时,转移电子为
时,转移电子为(4)工业生产纯碱的方法是:向饱和食盐水中通入
 和
和 ,即有
,即有 晶体析出。结合速率与平衡理论解释
晶体析出。结合速率与平衡理论解释 析出的原因
析出的原因(5)向碘水溶液中通入过量的
 ,发生反应:
,发生反应: ,配平上述方程式
,配平上述方程式
您最近一年使用:0次
解题方法
10 . 黄血盐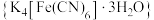 是一种食盐添加剂,具有抗结块作用,其配体CN-可参与形成多种配合物,例如:硝普钠
是一种食盐添加剂,具有抗结块作用,其配体CN-可参与形成多种配合物,例如:硝普钠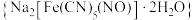 、赤血盐
、赤血盐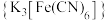 等。
等。
(1)基态铁原子核外电子排布式为_______ 。
(2)赤血盐中主族元素的电负性由大到小的顺序为_______ 。
(3)比较中心金属离子半径大小:黄血盐_______ 赤血盐(填“>”或“<”)。
(4)已知硝普钠和黄血盐的中心金属离子半径相等,硝普钠中铁的配位数是_______ ,配体为CN-、_______ 。
(5)碘酸钾也是一种食盐添加剂,其阴离子碘酸根( )的中心原子的杂化方式为
)的中心原子的杂化方式为_______ , 的空间构型是
的空间构型是_______ 。
(6)赤血盐与Fe2+反应可生成蓝色沉淀滕氏蓝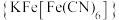 。滕氏蓝晶体中含有的作用力包括
。滕氏蓝晶体中含有的作用力包括_______ (填标号)。
A.极性共价键 B.非极性共价键 C.离子键 D.金属键 E.氢键
(7)滕氏蓝的晶胞由8个如图所示的小立方体构成(K+未标出)。
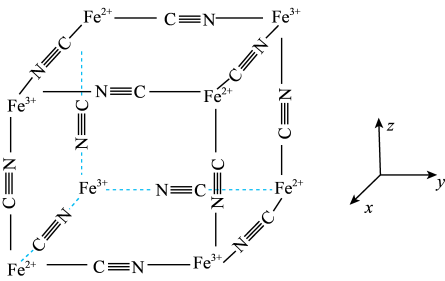
①已知K+位于小立方体的体心,但不是每个小立方体的体心都含有K+。根据化学式推断,一个滕氏蓝晶胞中含有的K+的个数为_______ 。
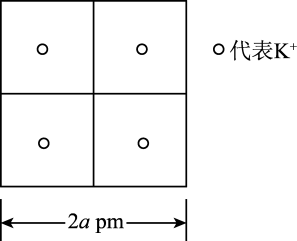
②滕氏蓝的晶胞沿x、y或z轴任意一个方向投影的K+的位置如图所示。晶胞中两个K+之间的最短距离为_______ pm,滕氏蓝晶体的密度为_______ g/cm3(列出计算式)。(已知:滕氏蓝的式量为Mr,阿伏加德罗常数的值为NA)
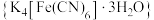 是一种食盐添加剂,具有抗结块作用,其配体CN-可参与形成多种配合物,例如:硝普钠
是一种食盐添加剂,具有抗结块作用,其配体CN-可参与形成多种配合物,例如:硝普钠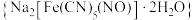 、赤血盐
、赤血盐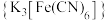 等。
等。(1)基态铁原子核外电子排布式为
(2)赤血盐中主族元素的电负性由大到小的顺序为
(3)比较中心金属离子半径大小:黄血盐
(4)已知硝普钠和黄血盐的中心金属离子半径相等,硝普钠中铁的配位数是
(5)碘酸钾也是一种食盐添加剂,其阴离子碘酸根(
 )的中心原子的杂化方式为
)的中心原子的杂化方式为 的空间构型是
的空间构型是(6)赤血盐与Fe2+反应可生成蓝色沉淀滕氏蓝
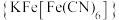 。滕氏蓝晶体中含有的作用力包括
。滕氏蓝晶体中含有的作用力包括A.极性共价键 B.非极性共价键 C.离子键 D.金属键 E.氢键
(7)滕氏蓝的晶胞由8个如图所示的小立方体构成(K+未标出)。

①已知K+位于小立方体的体心,但不是每个小立方体的体心都含有K+。根据化学式推断,一个滕氏蓝晶胞中含有的K+的个数为
②滕氏蓝的晶胞沿x、y或z轴任意一个方向投影的K+的位置如图所示。晶胞中两个K+之间的最短距离为

您最近一年使用:0次



