名校
解题方法
1 . 我国科研人员发现了一种新型超导体 ,由
,由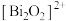 和
和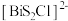 交替堆叠构成。已知
交替堆叠构成。已知 位于第六周期VA族,下列有关说法错误的是
位于第六周期VA族,下列有关说法错误的是
 ,由
,由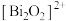 和
和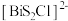 交替堆叠构成。已知
交替堆叠构成。已知 位于第六周期VA族,下列有关说法错误的是
位于第六周期VA族,下列有关说法错误的是A. 的价电子排布式为 的价电子排布式为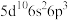 |
B.有关元素的电负性: |
C. 属于含共价键的离子化合物 属于含共价键的离子化合物 |
| D.该新型超导体的组成元素全部位于元素周期表p区 |
您最近一年使用:0次
2020-05-12更新
|
830次组卷
|
16卷引用:山东省青岛市2020届高三4月统一质量检测(一模)化学试题
山东省青岛市2020届高三4月统一质量检测(一模)化学试题山东省青岛市即墨区第一中学2022-2023学年高三上学期10月月考化学试题山东省烟台市中英文学校2021届高三上学期期末考试化学试题福建省泉州实验中学2021届高三3月测试(二)化学试题(已下线)2021年高考化学押题预测卷(湖北卷)03(含考试版、答题卡、参考答案、全解全析)山东省潍坊第四中学2022届高三上学期第一次过程检测化学试题河北省石家庄市第二十三中学2021-2022学年高二下学期期中考试化学试题专题1~2 综合检测(提升卷)第二节综合拔高练山西省临汾市尧都区山西师范大学实验中学2021-2022学年高二下学期第一次月考化学考试试题山东省济宁市育才中学2022-2023学年高二上学期第二次学情检测化学试题广东省深圳市盐田高级中学2021-2022学年高二下学期4月考试化学试题广东省潮阳一中、宝安中学等七校联考2022-2023学年高三上学期第二次(11月)联考化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五高级中学(前郭五中)2023-2024学年高三上学期第三次考试 化学试卷 河南省郑州市宇华实验学校2023-2024学年高三上学期1月期末化学试题新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高二下学期第一次月考化学试卷
解题方法
2 . 氧、硫形成的化合物种类繁多,日常生活中应用广泛。如硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应的化学方程式如下:AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr。回答下列问题:
(1)已知银(Ag)位于元素周期表第五周期,与Cu同族,则基态Ag的价电子排布式为____________ 。
(2)下列关于物质结构与性质的说法,正确的是_________
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.Br、S、O三种元素的电负性顺序为 O>Br>S
C.Na 的第一电离能小于 Mg,但其第二电离能却远大于 Mg
D.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S
(3)依据VSEPR理论推测S2O32-的空间构型为_______________________ ,中心原子S的杂化方式为_____ ,[Ag(S2O3)2]3-中存在的化学键有______________ (填字母序号)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键
(4)第一电子亲和能(E1)是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ·mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如下表:
表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因__________ 。
(5)某种离子型铁的氧化物晶胞如下图所示,它由A、B组成。则该氧化物的化学式为:________ ,已知该晶体的晶胞参数为anm,阿伏伽德罗常数的值为NA,则密度ρ为____________ g·cm-3(用含a和NA 的代数式表示)。

(1)已知银(Ag)位于元素周期表第五周期,与Cu同族,则基态Ag的价电子排布式为
(2)下列关于物质结构与性质的说法,正确的是
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.Br、S、O三种元素的电负性顺序为 O>Br>S
C.Na 的第一电离能小于 Mg,但其第二电离能却远大于 Mg
D.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S
(3)依据VSEPR理论推测S2O32-的空间构型为
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键
(4)第一电子亲和能(E1)是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ·mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如下表:
| 元素 | Al | Si | P | S | Cl |
| E1(kJ·mol-1) | 42.5 | 134 | 72.0 | 200 | 349 |
表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因
(5)某种离子型铁的氧化物晶胞如下图所示,它由A、B组成。则该氧化物的化学式为:

您最近一年使用:0次
名校
解题方法
3 . 铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表的第______ 族,其基态原子中未成对电子个数为________ 。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为_________________________________ ,所含非金属元素的电负性由大到小的顺序是_____________________________ 。
(3)尿素[CO(NH2)2]分子中,碳原子为_______ 杂化,分子中σ键与π键的数目之比为_________ 。
(4)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为__________ 。
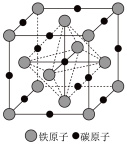
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为____________ 。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子的距离为__________ pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。
(1)钴位于元素周期表的第
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为
(3)尿素[CO(NH2)2]分子中,碳原子为
(4)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为

(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为
您最近一年使用:0次
解题方法
4 . 前36号元素A、B、C、D、E原子序数依次增大,A与B是同一周期紧邻元素,B与D同一主族,B元素氢化物的水溶液可用于玻璃的雕刻。C元素是同周期元素中第一电离能最小的元素,C与E的最外层电子数相同,E元素内层均排满电子。
(1)基态原子E的电子排布式为___________ ;依据电子排布周期表划分为5个区,该元素位于周期表的_________ 区。
(2)元素A、B、D电负性由大到小的顺序为___________ 。
(3)D2A分子中,中心原子的杂化方式为___________ 。分子键角大小关系,AB2分子_____ D2A分子(填“大于”,“小于”或“等于”),原因_________________________ 。
(4)单质C经常用于储氢,储氢后形成晶体结构如图所示:

该晶体中与C离子近邻的氢离子有_______ 个。这些氢离子,构成的空间构型为_______ 。已知C离子与氢离子之间最近的核间距为a pm,则该晶体的密度为_____ g·cm-3。
(1)基态原子E的电子排布式为
(2)元素A、B、D电负性由大到小的顺序为
(3)D2A分子中,中心原子的杂化方式为
(4)单质C经常用于储氢,储氢后形成晶体结构如图所示:

该晶体中与C离子近邻的氢离子有
您最近一年使用:0次
5 . [2016·新课标I]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]_______________ ,有__________ 个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是______________________________ 。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______________________________ 。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________________________ 。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________ ,微粒之间存在的作用力是_______________ 。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为_______________ 。_____ g·cm−3(列出计算式即可)。
(1)基态Ge原子的核外电子排布式为[Ar]
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为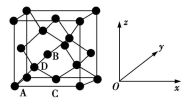
您最近一年使用:0次
2016-12-09更新
|
7016次组卷
|
32卷引用:山东省青岛一中2023-2024学年高二下学期第二次月考化学试卷
山东省青岛一中2023-2024学年高二下学期第二次月考化学试卷 2016年全国普通高等学校招生统一考试化学(新课标1卷精编版)2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷河南省郑州市八校2016-2017学年高二下学期期中联考化学试题2017届山东省潍坊市实验中学高三下学期第四次单元过关测试理科综合化学试卷云南民族大学附属中学2017-2018学年高二下学期第一次月考化学试题(已下线)《考前20天终极攻略》5月30日 物质结构与性质(已下线)解密21 物质的结构与性质(教师版)——备战2018年高考化学之高频考点解密云南省澄江县第一中学2019届高三9月月考理科综合化学试题云南省玉溪市峨山一中2019届高三9月上学期月考化学试题云南省玉溪市新平县第一中学2019届高三第一次月考理综化学试题云南省新平一中2019届高三上学期12月考试化学试题2016年全国普通高等学校招生统一考试化学(全国1卷参考版)广东省深圳外国语学校2019届高三第一次月考理综化学试题鲁科版高中化学选修3模块综合测评卷新疆乌鲁木齐县柴窝堡林场中学2019届高三四月调研考试理综化学试题百所名校联考-物质结构与性质云南省玉溪市江川二中2019-2020学年高三上学期期中考试化学试题贵州省三都水族自治县高级中学2019-2020学年高三上学期期末考试理综化学试题贵州省剑河县第二中学2019-2020学年高三上学期期末考试化学试题宁夏石嘴山市第三中学2019-2020学年高二下学期期中考试化学试题湖南省衡阳市2020年高中毕业班教学质量监测卷理科综合化学宁夏海原县第一中学2019-2020学年高二下学期第一次月考化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021届高三下学期5月月考化学试题云南省陆良县2019届高三毕业班第二次教学质量摸底考化学试题广东省深圳市罗湖区2022届高三上学期第一次质量检测化学试题贵州省威宁县第八中学2021-2022学年高三上学期第一次月考化学试题陕西省武功县2021-2022学年高三上学期第二次质量检测理科综合化学试题 陕西省汉中市2022届高三下学期第五次校级联考理科综合化学试题云南省曲靖市宣威市第七中学2021-2022学年高三下学期3月考试化学试题湖南省岳阳市汨罗市第二中学2022届高三下学期期中考试化学试题山东省德州市2021-2022学年高二下学期物质结构与性质模块综合测评化学试题



