1 . W、X、Y、Z为分属不同周期的主族元素,原子序数依次增大且小于20,四种元素形成的化合物M结构如图,农业上常用作肥料。下列说法错误的是


| A.电负性:X>Y>W>Z |
| B.X、Y分别与W形成的简单化合物的沸点:X>Y |
| C.化合物M既能与酸反应又能与碱反应 |
| D.W与X或Z均可形成既含有离子键又含有非极性共价键的离子化合物 |
您最近一年使用:0次
解题方法
2 . 下列有关化学键说法正确的是
| A.氢键是一种特殊的化学键,它能够影响物质的熔沸点 |
| B.О的电负性大于S的电负性,所以键的极性H—O键>H—S键 |
| C.BF3和NH3化学键的类型和分子的极性都相同 |
| D.s电子与s电子间形成的一定是σ键,p电子与p电子间只能形成π键 |
您最近一年使用:0次
名校
解题方法
3 . 近日,科学家研究利用CaF2晶体释放出的Ca2+和F-脱除硅烷,拓展了金属氟化物材料的生物医学功能。下列说法错误的是


| A.F、Si和Ca 电负性依次减小,原子半径依次增大 |
| B.OF2与 SiO2中含有化学键类型和氧原子杂化方式均相同 |
C.图中A处原子分数坐标为(0,0,0),则B 处原子分数坐标为 |
D.脱除硅烷反应速率依赖于晶体提供自由氟离子的能力,脱硅能力 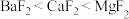 |
您最近一年使用:0次
2021-03-18更新
|
1471次组卷
|
12卷引用:山东省青岛市2021届高三3月统一质量检测化学试题
山东省青岛市2021届高三3月统一质量检测化学试题(已下线)押山东卷第04题 物质结构与性质选择题-备战2021年高考化学临考题号押题(山东卷)山东省临沂市第一中学2020-2021学年高二下学期6月月考化学试题(已下线)专题讲座(十二) 晶胞参数、坐标参数的分析与应用(精练)-2022年一轮复习讲练测(已下线)专题13 物质结构与性质基础-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省泰安第四中学2020-2021学年高二下学期4月月考化学试题辽宁省协作体2021-2022学年下学期高三第一次模拟考试化学试题(已下线)押新高考卷08题 物质结构与性质-备战2022年高考化学临考题号押题(新高考通版)辽宁省阜新市实验中学2021-2022学年高三下学期第一次模拟考试化学试题湖南省常德市第一中学2022-2023学年高三下学期第六次月考化学试题湖南省株洲市醴陵市第一中学2023届高三月考(五)化学试题湖南省长沙市第一中学2023-2024学年高三上学期月考卷(四)化学试题
解题方法
4 . 周期表前四周期的元素a、b、c、d、e的原子序数依次增大。a的核外电子总数与其周期数相同;基态b原子的核外电子占据3个能级,且最高能级轨道为半充满状态;基态c原子的最外层电子数是内层电子数的3倍;d的原子序数是c的2倍;基态e原子3d轨道上有4个单电子。回答下列问题:
(1)b、c、d电负性最大的是___________ (填元素符号)。
(2)b的单质分子中 键与π键的个数比为
键与π键的个数比为___________ 。
(3)a与c可形成两种二元化合物,两种物质可以任意比互溶。其中一种不稳定,可分解产生c的单质,该化合物分子中c原子的杂化方式为___________ ;这两种物质的互溶物中,存在的化学键有___________ (填序号)。
①极性共价键 ②非极性共价键 ③离子键 ④金属键 ⑤氢键 ⑥范德华力
(4)这些元素形成的含氧酸根离子中,中心原子的价电子对数为4的是___________ (填离子符号,下同);平面三角形结构的是___________ ,试从结构特点判断该酸分子与酸根离子的稳定性:酸分子___________ 酸根离子(填“>”或“<”)。
(5)元素e位于周期表中___________ 区;e的一种常见氯化物中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在,结构式为 ,请补写e的元素符号并用“→”表示出其中的配位键
,请补写e的元素符号并用“→”表示出其中的配位键___________ 。
(1)b、c、d电负性最大的是
(2)b的单质分子中
 键与π键的个数比为
键与π键的个数比为(3)a与c可形成两种二元化合物,两种物质可以任意比互溶。其中一种不稳定,可分解产生c的单质,该化合物分子中c原子的杂化方式为
①极性共价键 ②非极性共价键 ③离子键 ④金属键 ⑤氢键 ⑥范德华力
(4)这些元素形成的含氧酸根离子中,中心原子的价电子对数为4的是
(5)元素e位于周期表中
 ,请补写e的元素符号并用“→”表示出其中的配位键
,请补写e的元素符号并用“→”表示出其中的配位键
您最近一年使用:0次
2021-02-15更新
|
177次组卷
|
2卷引用:山东省青岛市胶州市实验中学2022-2023学年高二下学期3月月考化学试题
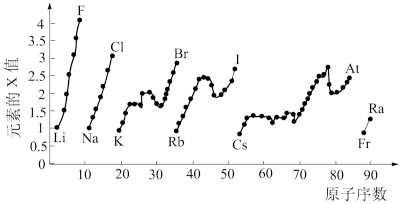
5 . 如图表示元素周期表中部分元素的某种性质(X值)随原子序数变化的关系示意图。______ (填元素符号)。
(2)同主族内不同元素的X值变化的特点是______ ;同周期内,随着原子序数的增大,X值的变化总趋势是______ 。元素周期表中X值的这种变化特点体现了元素性质的______ 变化规律。
(3)预测S元素与 元素x值的大小关系为
元素x值的大小关系为______ ,x值最小的元素在元素周期表中的位置是______ (放射性元素除外)。
(4)X值较小的元素集中在元素周期表的______ (填标号)。
a.左下角 b.右上角 c.分界线附近
(5)下列关于元素性质的说法正确的是______ (填标号)。
a.X值可反映元素最高正化合价的变化规律
b.X值可反映元素在化合物中吸引电子的能力
c.X值的大小可用来判断元素金属性和非金属性的强弱
(2)同主族内不同元素的X值变化的特点是
(3)预测S元素与
 元素x值的大小关系为
元素x值的大小关系为(4)X值较小的元素集中在元素周期表的
a.左下角 b.右上角 c.分界线附近
(5)下列关于元素性质的说法正确的是
a.X值可反映元素最高正化合价的变化规律
b.X值可反映元素在化合物中吸引电子的能力
c.X值的大小可用来判断元素金属性和非金属性的强弱
您最近一年使用:0次
2021-02-15更新
|
237次组卷
|
2卷引用:山东省青岛一中2023-2024学年高一下学期4月月考化学试卷
名校
解题方法
6 . 图甲和图乙表示的是元素的某种性质随原子序数的变化。下列说法正确的是
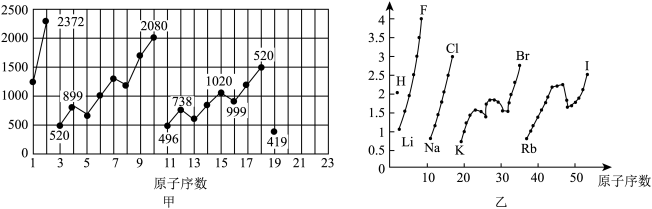
| A.图乙不可能表示元素的电负性随原子序数的变化关系 |
| B.图甲可能表示的是元素单质的熔点随原子序数的变化关系 |
| C.图乙可能表示的是元素原子的半径随原子序数的变化关系 |
| D.图甲可能表示的是元素原子的第一电离能随原子序数的变化关系 |
您最近一年使用:0次
2021-02-08更新
|
761次组卷
|
20卷引用:山东省青岛一中2023-2024学年高一下学期4月月考化学试卷
山东省青岛一中2023-2024学年高一下学期4月月考化学试卷2014-2015福建省四地六校高二下学期第一次联考化学试卷2016-2017学年河南省郑州外国语学校高二下学期月考(一)化学试卷黑龙江省牡丹江市第一高级中学2016-2017学年高二下学期期中考试化学试题福建省福清市华侨中学2018-2019学年高二年上学期期中考化学试题【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二下学期期中考试化学试题2020届高三化学二轮物质结构题型专攻——元素性质的递变规律【选择提升专练】辽宁省朝阳市凌源市实验中学2019-2020学年高二下学期4月份月考化学试题山东省临沂市罗庄区2019-2020学年高二下学期期中考试化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 综合检测卷鲁科版2019选择性必修2第1章综合检测卷广东省东莞市光明中学2021-2022学年高二上学期第一次月考化学试题河北省邯郸市大名县第一中学2021-2022学年高二上学期第二次月考化学试题福建省龙岩第一中学2021-2022学年高二下学期第一次月考化学试题陕西省西安市铁一中学2020-2021学年高二下学期期中考试化学试题重庆市朝阳中学2021-2022学年高二下学期第一次月考化学试题第一章 本章达标检测2河北大名县第一中学2022-2023学年高二上学期12月份网上测试化学试题河南省焦作市第一中学2022-2023学年高二下学期3月份教学质量检测 化学试题四川省眉山北外附属东坡外国语学校2023-2024学年高二下学期开学化学试题
名校
解题方法
7 . 我国科学家团队采用自激发缺陷诱导的方法获得白光,合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2[Sn(OH)6][B(OH)4]2。
(1)基态50Sn原子的价电子排布式为______ 。Ba、Sn、O三种元素的电负性由大到小的顺序为______ 。
(2)Na2[B4O5(OH)4]·8H2O(硼砂)的阴离子的结构式如图所示。则硼原子的杂化方式为______ ;硼砂中存在的作用力有______ (填标号)。
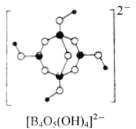
a.氢键 b.离子键 c.共价键 d.配位键
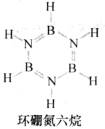
(3)环硼氮六烷(结构如图)在热水中比冷水中溶解度显著增大的主要原因是______ 。
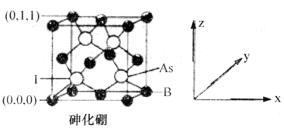
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的坐标为______ 。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为______ g·cm-3。(列出含a、NA的计算式即可)。
(1)基态50Sn原子的价电子排布式为
(2)Na2[B4O5(OH)4]·8H2O(硼砂)的阴离子的结构式如图所示。则硼原子的杂化方式为

a.氢键 b.离子键 c.共价键 d.配位键
(3)环硼氮六烷(结构如图)在热水中比冷水中溶解度显著增大的主要原因是

(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的坐标为

您最近一年使用:0次
2021-02-04更新
|
274次组卷
|
2卷引用:山东省青岛市2021届高三上学期期末教学质量检测考试化学试题
解题方法
8 . 短周期主族元素X、Y、Z、W的原子序数依次增大,最外层电子数满足Z=X+Y;化合物Y2X4的电子总数为18个;基态Z原子的电子总数是其最高能级电子数的2倍,且最高能级有两个未成对电子;W的氢化物水溶液及最高价氧化物对应水化物均为强酸。下列叙述错误的是
| A.X、Y、W三种元素能形成离子化合物 | B.X2Y—YX2的水溶液呈碱性 |
| C.元素的电负性:Y<Z | D.Y2Z分子中只含σ键,不含π键 |
您最近一年使用:0次
2021-02-04更新
|
438次组卷
|
3卷引用:山东省青岛市2021届高三上学期期末教学质量检测考试化学试题
9 . (1)基态 原子的核外电子排布式为
原子的核外电子排布式为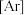
______ ,有______ 个未成对电子,光催化还原 制备
制备 反应中,带状纳米
反应中,带状纳米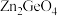 是该反应的良好催化剂,
是该反应的良好催化剂, 、
、 、
、 电负性由大到小的顺序是
电负性由大到小的顺序是____________ 。
(2)镍元素基态原子的电子排布式为____________ , 能级上的未成对电子数为
能级上的未成对电子数为____________ 。
(3)基态 原子的核外电子排布式为
原子的核外电子排布式为____________ ,根据元素周期律,原子半径
____________ (填“大于”或“小于”) ,第一电离能
,第一电离能
____________ (填“大于”或“小于”) 。
。
(4) 基态 核外电子排布式为
核外电子排布式为____________ 。
 原子的核外电子排布式为
原子的核外电子排布式为
 制备
制备 反应中,带状纳米
反应中,带状纳米 是该反应的良好催化剂,
是该反应的良好催化剂, 、
、 、
、 电负性由大到小的顺序是
电负性由大到小的顺序是(2)镍元素基态原子的电子排布式为
 能级上的未成对电子数为
能级上的未成对电子数为(3)基态
 原子的核外电子排布式为
原子的核外电子排布式为
 ,第一电离能
,第一电离能
 。
。(4) 基态
 核外电子排布式为
核外电子排布式为
您最近一年使用:0次
2021-02-01更新
|
1210次组卷
|
4卷引用:山东省青岛一中2023-2024学年高一下学期4月月考化学试卷
10 . 以下有关元素性质的说法不正确的是( )
| A.具有下列电子排布式的原子中:①1s22s22p63s23p2,②1s22s22p3,③1s22s22p2,④1s22s22p63s23p4,原子半径最大的是① |
| B.下列价电子排布式的原子中:①3s23p1,②3s23p2,③3s23p3,④3s23p4,第一电离能最大的是③ |
| C.①Na、K、Rb,②N、P、As,③O、S、Se,④Na、P、Cl中,元素的电负性随原子序数增大而递增的是④ |
| D.某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
您最近一年使用:0次
2020-08-21更新
|
1220次组卷
|
37卷引用:山东省青岛一中2023-2024学年高一下学期4月月考化学试卷
山东省青岛一中2023-2024学年高一下学期4月月考化学试卷(已下线)2010-2011学年江西省新建二中高二下学期期末考试化学试卷(已下线)2014年高考化学苏教版总复习 12-1 原子结构与元素的性质练习卷2015-2016学年辽宁省沈阳二中高二下期中化学试卷黑龙江省牡丹江市第一高级中学2016-2017学年高二下学期期中考试化学试题山西省怀仁县第一中学2016-2017学年高二下学期第三次(5月)月考化学试题河南省洛阳名校2017-2018学年高二上学期第二次联考化学试题【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期中考试(理)化学试题山西省沁县中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】吉林省延边第二中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二下学期期中考试化学试题吉林省白山市第七中学2018-2019学年高二下学期期中考试化学试题(已下线)2019年6月16日 《每日一题》选修3-每周一测甘肃省临泽一中2018-2019学年高二下学期期末模拟化学试题(已下线)2019年11月22日 《每日一题》2020年高考化学一轮复习——电离能和电负性江苏省南京师范大学苏州实验学校2019-2020学年高二上学期期中考试化学试题(已下线)专题11.3 晶体结构与性质(练)-《2020年高考一轮复习讲练测》辽宁省实验中学东戴河分校2019-2020学年高二12月月考化学试题2020届高三化学二轮物质结构题型专攻——元素性质的递变规律【选择基础专练】第1章 原子结构——B拓展区综合拓展(鲁科版选修3)甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(普通班)辽宁省大连市大连海湾高级中学2019-2020学年高二下学期第一次质量检测化学试题山东省潍坊昌乐县第二中学2020届高三上学期期末化学模拟试题二(已下线)山东省邹城市2018-2019学年高二上学期12月月考化学试卷(人教版2019)选择性必修2 第一章 原子结构与性质 综合检测卷鲁科版2019选择性必修2第1章综合检测卷高二选择性必修2(人教版2019)第一章 原子结构与性质 第二节综合训练(已下线)第一单元 原子结构(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)河南省开封市五县2020-2021学年高二下学期月考化学试题四川省汉源县第二中学2019-2020学年高二下学期第二次月考化学试题安徽省六安第一中学2021-2022学年高二上学期期末考试化学试题第二节 原子结构与元素的性质 第2课时 元素周期律——原子半径、电离能、电负性的递变规律福建省建瓯市芝华中学2021-2022学年高二下学期第一次阶段考化学试题四川省绵阳中学2022-2023学年高二上学期第一次月考化学试题河南省焦作市第一中学2022-2023学年高二下学期3月份教学质量检测 化学试题福建省建瓯市芝华中学2023-2024学年高二下学期第一次阶段考试化学试题新疆乌鲁木齐市第三十一中学2023-2024学年高二下学期3月月考 化学试题



