名校
解题方法
1 . (1)基态溴原子的核外电子排布式为________ ,其核外电子所占用的最高能级电子云形状为_________ 。
(2)尿素(H2NCONH2)分子中,原子杂化轨道类型有_____ ,σ键与π键数目之比为______ 。
(3)铍与铝元素性质相似。下列有关铍与铝的叙述正确的是_____ (填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液都呈酸性
(4) NH3分子中∠HNH键角为107°,而配离子[Zn(NH3)6]2+中∠HNH的键角为109.5°。配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是_______ 。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
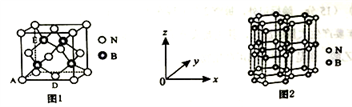
①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0, 0),D为(0.5,0.5, 0),则E原子的坐标参数为________ 。
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的表达式为___ pm.
(2)尿素(H2NCONH2)分子中,原子杂化轨道类型有
(3)铍与铝元素性质相似。下列有关铍与铝的叙述正确的是
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液都呈酸性
(4) NH3分子中∠HNH键角为107°,而配离子[Zn(NH3)6]2+中∠HNH的键角为109.5°。配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0, 0),D为(0.5,0.5, 0),则E原子的坐标参数为
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3,则层与层之间距离的表达式为
您最近一年使用:0次
名校
解题方法
2 . 碳、氧、氮、镁、铬、铁、铜是几种重要的元素,请回答下列问题:
(1) 在第二周期的元素中,第一电离能介于B 与N之间的元素有_________ 种。
(2)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是____________________ 。
(3)Fe 与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ键与π键个数比为______________ 。请写出一个与CO互为等电子体的离子:____________________ 。
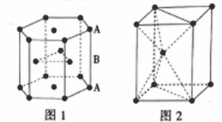
(4)金属铬是一种银白色,极硬,耐腐蚀的金属,铬的化合物种类繁多,如:Cr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+。
①K2Cr2O7具有很强的氧化性,能直接将CH3CH2OH 氧化成CH3COOH,试写出基态铬原子的价层电子排布式:_______________ ;CH3COOH 分子中碳原子的杂化类型为_________________ ;乙醇和丙烷相对分子质量相近,但乙醇的熔、沸点比丙烷高很多,试解释其主要原因:____________________________________ 。
②该配离子[Cr(H2O)3(NH3)3]3+中,中心离子的配位数为_______ ,NH3的VSEPR模型为_______ 。
③图为Cu-Cr形成的一种合金的晶胞(假设晶体中原子之间彼此相切),单独属于该晶胞的Cu原子共有三个,其原子坐标可分别表示为:( ,0,0)、 (0,
,0,0)、 (0, ,0)、
,0)、_______ ;已知晶胞中Cr 和Cu原子间的最近距离为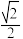 a pm,则该晶体的密度为
a pm,则该晶体的密度为_______ g·cm-3 (用含a的代数式表示,设N A为阿伏伽德罗常数的值)。
(1) 在第二周期的元素中,第一电离能介于B 与N之间的元素有
(2)查阅相关资料发现MgO的熔点比CuO的熔点高得多,其原因是
(3)Fe 与CO能形成一种重要的催化剂Fe(CO)5,该分子中σ键与π键个数比为
(4)金属铬是一种银白色,极硬,耐腐蚀的金属,铬的化合物种类繁多,如:Cr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+。
①K2Cr2O7具有很强的氧化性,能直接将CH3CH2OH 氧化成CH3COOH,试写出基态铬原子的价层电子排布式:
②该配离子[Cr(H2O)3(NH3)3]3+中,中心离子的配位数为
③图为Cu-Cr形成的一种合金的晶胞(假设晶体中原子之间彼此相切),单独属于该晶胞的Cu原子共有三个,其原子坐标可分别表示为:(
 ,0,0)、 (0,
,0,0)、 (0, ,0)、
,0)、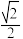 a pm,则该晶体的密度为
a pm,则该晶体的密度为
您最近一年使用:0次
名校
解题方法
3 . 硼系高温超导材料都具有良好的应用前景。回答下列问题:
(1)B的基态原子价电子排布式为____________________ 。BF3的立体构型是_____________________ 。
H3BO3为一元酸,与足量NaOH溶液反应得到[B(OH)4 ]-,[B(OH)4]-中B的杂化轨道类型为__________________________ 。
(2)NaBH4被认为是有机化学上的“万能还原剂”,NaBH4的电子式为_________________ ,其中三种元素的电负性由大到小的顺序是__________________________ 。
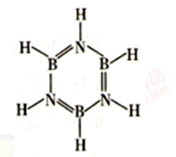
(3)硼与氮形成类似苯的化合物硼氮苯(B3N3H6),俗称无机苯(如图)。硼氮苯属于____________ (填“极性”或“非极性”)分子,其间位上的二氯代物有______________ 种.
(4)NH4BF4 (氟硼酸铵)是合成氮化硼纳米管的原料之一。1mol NH4BF4含有_________ mol 配位键。
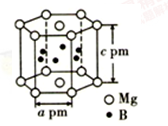
(5)硼与镁形成的高温超导材料晶体结构如图所示(B在六棱柱柱体内)。该六方晶胞中镁原子与硼原子的数量比为_____________ ,晶体密度d=_______________ g·cm-3
(1)B的基态原子价电子排布式为
H3BO3为一元酸,与足量NaOH溶液反应得到[B(OH)4 ]-,[B(OH)4]-中B的杂化轨道类型为
(2)NaBH4被认为是有机化学上的“万能还原剂”,NaBH4的电子式为
(3)硼与氮形成类似苯的化合物硼氮苯(B3N3H6),俗称无机苯(如图)。硼氮苯属于

(4)NH4BF4 (氟硼酸铵)是合成氮化硼纳米管的原料之一。1mol NH4BF4含有
(5)硼与镁形成的高温超导材料晶体结构如图所示(B在六棱柱柱体内)。该六方晶胞中镁原子与硼原子的数量比为

您最近一年使用:0次
名校
4 . 用短线“—”表示共用电子对,用“··”表示未成键孤电子对的式子叫路易斯结构式。R分子的路易斯结构式可以表示为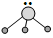 则以下叙述错误的是
则以下叙述错误的是
| A.R为三角锥形 | B.R可以是BF3 |
| C.R是极性分子 | D.键角小于109°28′ |
您最近一年使用:0次
2018-02-10更新
|
721次组卷
|
15卷引用:重庆市松树桥中学2023-2024学年高二下学期第三次月考化学试题
重庆市松树桥中学2023-2024学年高二下学期第三次月考化学试题人教版2017-2018学年高二化学选修三同步训练:第二章 分子结构与性质上海市静安区2014届高三二模化学试题福建省三明第一中学2019-2020学年高二下学期期中考试化学试题辽宁省锦州市渤海大学附属中学、育明高级中学2021届高三上学期第二次月考化学试题(已下线)模块同步卷07 第二章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)江苏省苏州市新区实验中学2020-2021学年高二上学期12月月考化学试题(已下线)第二单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)广东省佛山市第一中学2021-2022学年高二下学期第一次段考试题(3月)化学(选考)试题安徽省六安第一中学2021-2022学年高二上学期期末考试化学试题新疆昌吉州行知学校2021-2022学年高二下学期期中考试化学试题陕西省西安市周至县第四中学2022-2023学年高二下学期期末考试化学试题天津市北辰区南仓中学2023-2024学年高二下学期3月月考化学试题湖北省武汉西藏中学2023-2024学年高二下学期5月期中考试化学试题四川省广元天立学校2024-2025学年高三上学期开学考试化学试卷
5 . 储氢材料是科学研究的热点之一。
(1)无机盐储氢原理:NaHCO3(s)+H2(g)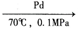 HCOONa+H2O,HCOONa中的化学键类型有
HCOONa+H2O,HCOONa中的化学键类型有____ ;在NaHCO3中,C、H、O的电负性由大到小的顺序为_________ 。
(2)近年来,研究人员发现苯和甲苯都是比较理想的有机液体储氢材料。C6H6(苯)+3H2 C6H12(环己烷);C6H5-CH3(甲苯)+3H2
C6H12(环己烷);C6H5-CH3(甲苯)+3H2 C6H11-CH3(甲基环己烷)
C6H11-CH3(甲基环己烷)
①甲苯分子中碳原子的杂化类型是__________ ;
②能体现环己烷分子的空间构型的键线式为____________ 。
(3)金属钛具有较强的储氢能力。钛的储氢反应为Ti+H2 TiH2。工业上,冶炼钛的原理是钛的氧化物在高温下与焦炭、氯气反应生成TiCl4和CO。
TiH2。工业上,冶炼钛的原理是钛的氧化物在高温下与焦炭、氯气反应生成TiCl4和CO。
①CO能形成Ni(CO)4,沸点为42.2℃,Ni(CO)4的晶体类型为______________ ,CO与N2互为等电子体,标准状况下,VL CO分子形成Ni(CO)4中含o键数目为________ 。
②基态钛原子中电子能量最高的电子排布图为_________
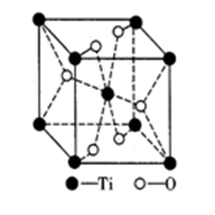
③钛的氧化物晶胞如图所示。该钛的氧化物晶体的化学式为_______ 已知钛的氧化物晶胞参数为a·10-3μm,NA代表阿伏伽德罗常数的值,则该晶体的密度为_______ g·cm-3。
(1)无机盐储氢原理:NaHCO3(s)+H2(g)
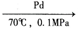 HCOONa+H2O,HCOONa中的化学键类型有
HCOONa+H2O,HCOONa中的化学键类型有(2)近年来,研究人员发现苯和甲苯都是比较理想的有机液体储氢材料。C6H6(苯)+3H2
 C6H12(环己烷);C6H5-CH3(甲苯)+3H2
C6H12(环己烷);C6H5-CH3(甲苯)+3H2 C6H11-CH3(甲基环己烷)
C6H11-CH3(甲基环己烷)①甲苯分子中碳原子的杂化类型是
②能体现环己烷分子的空间构型的键线式为
(3)金属钛具有较强的储氢能力。钛的储氢反应为Ti+H2
 TiH2。工业上,冶炼钛的原理是钛的氧化物在高温下与焦炭、氯气反应生成TiCl4和CO。
TiH2。工业上,冶炼钛的原理是钛的氧化物在高温下与焦炭、氯气反应生成TiCl4和CO。①CO能形成Ni(CO)4,沸点为42.2℃,Ni(CO)4的晶体类型为
②基态钛原子中电子能量最高的电子排布图为
③钛的氧化物晶胞如图所示。该钛的氧化物晶体的化学式为

您最近一年使用:0次
名校
解题方法
6 . 硅、磷、硫、氯都是第三周期的非金属元素,它们在工农业生产中都有重要的用途。
(1)基态硅原子的电子排布图为_______________ ;硫的基态原子能量最高的电子云在空间有________________ 个伸展方向,原子轨道呈________________ 形。
(2)硅、磷、硫的第一电离能由大到小的顺序为________________ 。
(3)单质磷与Cl2反应,可以生产PC13和PC15。其中各原子均满足8电子稳定结构的化合物中,P原子的杂化轨道类型为________________ ,其分子的空间构型为________________ 。
(4)H3PO4为三元中强酸,与Fe3+形成H3[Fe(PO4)2],此性质常用于掩蔽溶液中的Fe3+。基态Fe3+核外电子排布式为__________ ;PO43-作为___________ 为Fe3+提供________________ 。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,下图为其晶胞,硼原子与磷原子最近的距离为a cm。 用Mg/mol表示磷化硼的摩尔质量,NA表示阿伏伽德罗常数的值,则磷化硼晶体的密度为_________ g/cm3。

(1)基态硅原子的电子排布图为
(2)硅、磷、硫的第一电离能由大到小的顺序为
(3)单质磷与Cl2反应,可以生产PC13和PC15。其中各原子均满足8电子稳定结构的化合物中,P原子的杂化轨道类型为
(4)H3PO4为三元中强酸,与Fe3+形成H3[Fe(PO4)2],此性质常用于掩蔽溶液中的Fe3+。基态Fe3+核外电子排布式为
(5)磷化硼(BP)是一种超硬耐磨涂层材料,下图为其晶胞,硼原子与磷原子最近的距离为a cm。 用Mg/mol表示磷化硼的摩尔质量,NA表示阿伏伽德罗常数的值,则磷化硼晶体的密度为

您最近一年使用:0次
2017-11-01更新
|
387次组卷
|
2卷引用:重庆市第一中学2018届高三上学期期中考试化学试题
名校
7 . 硼、碳、氮、氟、硫、铁等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态铁原子的价层电子排布式为_____ ;Fe3+比Fe2+稳定的原因是_____ 。
(2)第二周期中,元素的第一电离能处于B与N之间的元素有_____ 种。
(3)NF3是微电子工业中优良的等离子刻蚀气体,在NF3中,N原子的杂化轨道类型为_____ 。NF3和NH3相比,________ 键角更大,因为_________________ 。
(4)与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为___ ,层间作用力为_____ 。
(5)S和Fe形成的某化合物,其晶胞如图所示,则该物质的化学式为_____ 。假设该晶胞的密度为ρ g/cm3,用NA表示阿伏伽德罗常数,则该晶胞中距离最近的S原子之间的距离为(列出计算式即可)_____ cm。
(1)基态铁原子的价层电子排布式为
(2)第二周期中,元素的第一电离能处于B与N之间的元素有
(3)NF3是微电子工业中优良的等离子刻蚀气体,在NF3中,N原子的杂化轨道类型为
(4)与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
(5)S和Fe形成的某化合物,其晶胞如图所示,则该物质的化学式为

您最近一年使用:0次
名校
解题方法
8 . 化学与生活密切相关。
I. K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O72-(橙色)+CH3CH2OH Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)
(1)基态Cr 原子的价电子轨道表达式为_________________ 。
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为___________ ,碳原子的轨道杂化类型为_____ ,所含σ键与π键的数目之比为_______ 。
(3)已知Cr3+等过渡元素水合离子的颜色如下表所示:
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为_________________________ 。
II. ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。
(4)Fe[Zn(OH)Cl2]2的水溶液中不存在的微粒间作用力有____________ (填选项字母);溶液中[Zn(OH)Cl2]—的结构式为_____________________ 。
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
III.锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。
(5)锌的堆积方式为_____________________ ,配位数为_______ 。
(6)若锌原子的半径为a pm,阿伏伽德罗常数的值为NA,则锌晶体的密度为_______ g/cm3 (用含a的代数式表示)。
I. K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O72-(橙色)+CH3CH2OH
 Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)(1)基态Cr 原子的价电子轨道表达式为
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为
(3)已知Cr3+等过渡元素水合离子的颜色如下表所示:
| 离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
| 水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为
II. ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。
(4)Fe[Zn(OH)Cl2]2的水溶液中不存在的微粒间作用力有
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
III.锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。

(5)锌的堆积方式为
(6)若锌原子的半径为a pm,阿伏伽德罗常数的值为NA,则锌晶体的密度为
您最近一年使用:0次
2017-05-08更新
|
373次组卷
|
3卷引用:【全国百强校】重庆南开中学2019届高三下学期适应性考试理科综合化学试题
名校
解题方法
9 . X、Y、Z、W、Q五种元素的原子序数依次增大且分别位于周期表的二、三、四周期,X和Y的原子序数相差1,基态Y原子中有3个未成对电子:基态Z2-与基态W+的电子层结构相同,W为前四周期电负性最小的元素;Q位于周期表的第12列。
请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___________ 形象化描述。
(2)基态X 原子的价层电子排布图为____________ 。基态W原子中有___________ 对自旋方向相反的电子。
(3)基态Y原子和基态Z原子的第一电离能:Y___________ (填“>”或“<")Z。
(4)Fe3+常用X、Y、Z、W组成的一种化合物检验。与该化合物中的阴离子互为等电子体的—种分子为__________ (填分子式)。
(5)Y的最高价含氧酸分子中,中心原子的杂化轨道类型为__________ ;其酸根离子的空间构型为______ 。
(6)相同压强下,Y的最简单氢化物的熔点低于W的氢化物的熔点,原因为_______________ 。
(7)Z与Q形成的一种晶体的晶胞如图所示,Z的配位数为_____________ 。若晶体密度为ρg·cm-1,阿伏伽德罗常数的值为NA,则晶胞参数为____________ nm(用含ρ、NA的代数式表示)。
请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
(2)基态X 原子的价层电子排布图为
(3)基态Y原子和基态Z原子的第一电离能:Y
(4)Fe3+常用X、Y、Z、W组成的一种化合物检验。与该化合物中的阴离子互为等电子体的—种分子为
(5)Y的最高价含氧酸分子中,中心原子的杂化轨道类型为
(6)相同压强下,Y的最简单氢化物的熔点低于W的氢化物的熔点,原因为
(7)Z与Q形成的一种晶体的晶胞如图所示,Z的配位数为

您最近一年使用:0次
2017-04-22更新
|
422次组卷
|
2卷引用:重庆市巴蜀中学2017届高三第二次诊断考试模拟理科综合化学试题
解题方法
10 . 自然界中存在大量的金属元素和非金属元素,它们在工农业生产中有着广泛的应用。
(1)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,已知高温下Cu2O比CuO稳定。
①画出基态Cu原子的价电子轨道排布图_______ ;
②从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因_______ 。
(2)CuSO4溶液常用作农药、电镀液等,向CuSO4溶液中滴加足量浓氨水,直至产生的沉淀恰好溶解,再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4·H2O晶体。
①Cu(NH3)4SO4·H2O晶体中存在的化学键有_______ (填字母序号)。
a.离子键 b.极性键 c.非极性键 d.配位键
② 的立体构型是
的立体构型是_______ ,其中S原子的杂化轨道类型是_______ 。
③已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______ 。
(3)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是_______ 。
(4)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),该反应是:
[Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3CO]Ac(醋酸羰基三氨合铜)(I) △H<0
[Cu(NH3)3CO]Ac(醋酸羰基三氨合铜)(I) △H<0
①C、N、O三种元素的第一电离能由小到大的顺序为_______ ;
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为_______ 。
(5)铜的化合物种类很多,如图是氯化亚铜的晶胞结构,已知晶胞的棱长为a cm,则氯化亚铜密度的计算式为: =
=_______ g/cm3(用NA表示阿伏伽德罗常数)。

(1)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,已知高温下Cu2O比CuO稳定。
①画出基态Cu原子的价电子轨道排布图
②从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因
(2)CuSO4溶液常用作农药、电镀液等,向CuSO4溶液中滴加足量浓氨水,直至产生的沉淀恰好溶解,再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4·H2O晶体。
①Cu(NH3)4SO4·H2O晶体中存在的化学键有
a.离子键 b.极性键 c.非极性键 d.配位键
②
 的立体构型是
的立体构型是③已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是
(3)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是
(4)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),该反应是:
[Cu(NH3)2]Ac+CO+NH3
 [Cu(NH3)3CO]Ac(醋酸羰基三氨合铜)(I) △H<0
[Cu(NH3)3CO]Ac(醋酸羰基三氨合铜)(I) △H<0①C、N、O三种元素的第一电离能由小到大的顺序为
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为
(5)铜的化合物种类很多,如图是氯化亚铜的晶胞结构,已知晶胞的棱长为a cm,则氯化亚铜密度的计算式为:
 =
=
您最近一年使用:0次



