解题方法
1 . 铜及其化合物在生活和生产中有着广泛的应用。回答下列问题
(1)基态铜原子价层电子的轨道表达式(电子排布图)为_____ 。
(2)单质铜及镍都是由_____ 键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1958kJ/mol,INi=1753kJ/mol,ICu>INi的原因是_____ 。
(3)Cu2+能与多种物质形成配合物。
①CuSO4溶液与氨水在一定条件下可以生成[Cu(NH3)4]SO4•H2O晶体,该晶体中杂化轨道类型为sp3的原子为_____ ,写出与SO 互为等电子体的一种分子是
互为等电子体的一种分子是_____ 。
②CuSO4溶液与过量KCN可以形成配合物离子[Cu(CN)4]2﹣,1mol该微粒中含有的σ键和π键的数目之比为_____ 。
③CuCl2溶液与乙二胺(H2N﹣CH2﹣CH2﹣NH2)可形成配离子: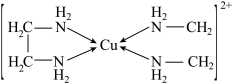 则H、O、N三种元素的电负性从大到小的顺序为
则H、O、N三种元素的电负性从大到小的顺序为_____ ,乙二胺沸点高于1,2﹣二氯乙烷(Cl﹣CH2﹣CH2﹣Cl)的主要原因是_____ 。
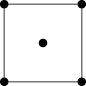
(4)已知铜与氯形成化合物的立方晶胞如图所示(黑点代表铜原子)。
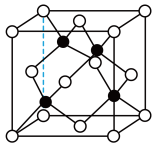
①该晶体的化学式为_____ 。
②已知铜与氯的电负性分别为1.9和3.0,则铜与氯组成的化合物属于_____ (填“共价”或“离子”)化合物。
③已知该晶体的密度为ρg•cm﹣3,阿伏加 德罗常数为NA,该晶体中铜原子和氯原子之间的最短距离为体对角线的 ,则该晶体中铜原子和氯原子之间的最短距离为
,则该晶体中铜原子和氯原子之间的最短距离为_____ pm(写出计算列式)。
(1)基态铜原子价层电子的轨道表达式(电子排布图)为
(2)单质铜及镍都是由
(3)Cu2+能与多种物质形成配合物。
①CuSO4溶液与氨水在一定条件下可以生成[Cu(NH3)4]SO4•H2O晶体,该晶体中杂化轨道类型为sp3的原子为
 互为等电子体的一种分子是
互为等电子体的一种分子是②CuSO4溶液与过量KCN可以形成配合物离子[Cu(CN)4]2﹣,1mol该微粒中含有的σ键和π键的数目之比为
③CuCl2溶液与乙二胺(H2N﹣CH2﹣CH2﹣NH2)可形成配离子:
 则H、O、N三种元素的电负性从大到小的顺序为
则H、O、N三种元素的电负性从大到小的顺序为(4)已知铜与氯形成化合物的立方晶胞如图所示(黑点代表铜原子)。

①该晶体的化学式为
②已知铜与氯的电负性分别为1.9和3.0,则铜与氯组成的化合物属于
③已知该晶体的密度为ρg•cm﹣3,阿伏加 德罗常数为NA,该晶体中铜原子和氯原子之间的最短距离为体对角线的
 ,则该晶体中铜原子和氯原子之间的最短距离为
,则该晶体中铜原子和氯原子之间的最短距离为
您最近一年使用:0次
2020-08-18更新
|
334次组卷
|
2卷引用:重庆市缙云教育联盟2022-2023学年高三上学期第一次诊断性检测 化学试题
名校
解题方法
2 . 2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献, 常用作锂离子电池的正极材料。请回答下列问题:
常用作锂离子电池的正极材料。请回答下列问题:
(1)基态钴原子核外占据最高能级的电子云轮廓图为________ 形。
(2) 中
中 的配位数为4。
的配位数为4。
①配体中 原子的杂化方式为
原子的杂化方式为________ ,该配离子中各元素的第一电离能由小到大的顺序为________ (填元素符号)。
② 的立体构型是
的立体构型是________ ;与 互为等电子体的分子和离子为
互为等电子体的分子和离子为________ (各写一种)。
(3)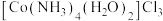 是钴的重要化合物。
是钴的重要化合物。 键角小于
键角小于 的键角,原因是
的键角,原因是________ 。
(4)一氧化钴的晶胞如图所示,在每个 的周围与它距离最近的
的周围与它距离最近的 共有
共有________ 个,若 晶体的密度为
晶体的密度为 ,则晶体中
,则晶体中 与
与 之间的最小距离为
之间的最小距离为________  。(用含
。(用含 和
和 的代数式表示。
的代数式表示。 为阿伏加 德罗常数的值)。
为阿伏加 德罗常数的值)。
 常用作锂离子电池的正极材料。请回答下列问题:
常用作锂离子电池的正极材料。请回答下列问题:(1)基态钴原子核外占据最高能级的电子云轮廓图为
(2)
 中
中 的配位数为4。
的配位数为4。①配体中
 原子的杂化方式为
原子的杂化方式为②
 的立体构型是
的立体构型是 互为等电子体的分子和离子为
互为等电子体的分子和离子为(3)
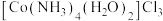 是钴的重要化合物。
是钴的重要化合物。 键角小于
键角小于 的键角,原因是
的键角,原因是(4)一氧化钴的晶胞如图所示,在每个
 的周围与它距离最近的
的周围与它距离最近的 共有
共有 晶体的密度为
晶体的密度为 ,则晶体中
,则晶体中 与
与 之间的最小距离为
之间的最小距离为 。(用含
。(用含 和
和 的代数式表示。
的代数式表示。 为阿伏加 德罗常数的值)。
为阿伏加 德罗常数的值)。
您最近一年使用:0次
2020-07-20更新
|
118次组卷
|
2卷引用:重庆市2020届高三6月调研考试(三诊)理科综合化学试题
3 . 钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为____________ 。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____________ 。
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是__________ ;金属离子与氧离子间的作用力为__________ ,Ca2+的配位数是__________ 。
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子 ,其晶胞如图(b)所示。其中Pb2+与图(a)中
,其晶胞如图(b)所示。其中Pb2+与图(a)中__________ 的空间位置相同,有机碱 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是__________ ;若晶胞参数为a nm,则晶体密度为_________ g·cm-3(列出计算式)。_______ 、_______ 。
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子
 ,其晶胞如图(b)所示。其中Pb2+与图(a)中
,其晶胞如图(b)所示。其中Pb2+与图(a)中 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是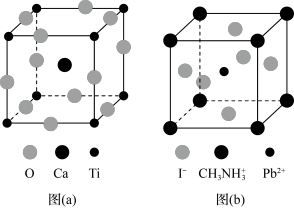
您最近一年使用:0次
2020-07-08更新
|
15501次组卷
|
21卷引用:重庆市万州第二高级中学2021-2022学年高二下学期6月第三次质量检测化学试题
重庆市万州第二高级中学2021-2022学年高二下学期6月第三次质量检测化学试题2020年全国统一考试化学试题(新课标Ⅱ)(已下线)专题17 物质结构与性质(选修)-2020年高考真题和模拟题化学分项汇编(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题河南省开封市铁路中学2020-2021学年高二下学期期中考试化学试题北京一零一中学2021-2022学年高三上学期10月月考化学试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)2020年全国卷Ⅱ化学真题变式题江西省九江市2022届第二次高考模拟统一考试理综化学试题(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)贵州省罗甸县边阳中学2022届高三模拟测试化学试题(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)专题02 物质结构专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)专题20 结构与性质四川省成都锦江区嘉祥外国语高级中学2023-2024学年高三下学期第一次诊断性考试理科综合试题-高中化学
名校
解题方法
4 . 下列各组微粒的空间构型相同的是( )
①NH3和H2O ② 和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和BeCl2 ⑥
和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和BeCl2 ⑥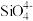 和
和 ⑦BF3和Al2Cl6
⑦BF3和Al2Cl6
①NH3和H2O ②
 和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和BeCl2 ⑥
和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和BeCl2 ⑥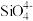 和
和 ⑦BF3和Al2Cl6
⑦BF3和Al2Cl6| A.全部 | B.除④⑥⑦以外 | C.③④⑤⑥ | D.②⑤⑥ |
您最近一年使用:0次
2020-07-02更新
|
1055次组卷
|
31卷引用:重庆市璧山来凤中学2022-2023学年高二下学期第一次月考化学试题
重庆市璧山来凤中学2022-2023学年高二下学期第一次月考化学试题2014-2015福建省福州市八县高二下学期联考化学试卷2015-2016学年河南省孟津一中高二上学期期末化学试卷2015-2016学年山西省大同一中高二下3月月考化学试卷2015-2016学年江苏省启东中学高二下第二次月考化学试卷2014-2015学年陕西西北大学附中高二下期末化学试卷2016-2017学年山西省大同市第一中学高二3月月考化学试卷河南省南阳市第一中学2016-2017学年高二下学期第一次月考(3月)化学试题安徽省合肥市第一中学2016-2017学年高二下学期期中考试化学试题山西省大同市第一中学2016-2017学年高二5月月考化学试题2017-2018学年人教版高中化学选修三 模块综合质量检测山西省阳泉市第二中学2018-2019学年高二下学期期中考试化学试题辽宁省凌源市第二高级中学2019-2020学年高二第四次网上测试化学试题河北省沧州市盐山县盐山中学2019-2020学年高二下学期开学考试化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题辽宁师范大学附属中学2019-2020学年高二下学期期末考试化学试题湖北省武汉市五校联合体2019-2020学年高一下学期期末考试化学试题山西省朔州市怀仁县大地学校2019-2020学年高二下学期期末考试化学试题(已下线)模块同步卷11 综合检测卷(基础卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)福建省建瓯市芝华中学2020-2021学年高二下学期第一阶段考试化学试题福建省龙岩市长汀县三级达标校2020-2021学年高二下学期期中考试化学试题新疆新源县第二中学2019-2020学年高二下学期期末考试化学试题新疆昌吉教育共同体2020-2021学年高二下学期期末质量检测化学试题河北省石家庄市第一中学2020-2021学年高二下学期学情反馈(一)化学试题广西蒙山县第一中学2018-2019学年高二下学期第二次月考化学试题(已下线)考向37 分子结构与性质-备战2022年高考化学一轮复习考点微专题四川省西昌市2020-2021学年高二下学期期中检测化学试题贵州省凯里学院附属中学2021-2022学年高二下学期3月月考化学试题山西省太原市英才学校2021-2022学年高二下学期线上期中化学试题陕西省西安市周至县第四中学2022-2023学年高二下学期期末考试化学试题湖北省武汉西藏中学2023-2024学年高二下学期4月月考化学试题
解题方法
5 . 铝、锌、铁在人类生产和生活中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Fe2+电子排布式为___ ,Zn的基态原子能级最高的电子的电子云轮廓图形状为___ 。
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因___ 。
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键___ mol,其阴离子中心原子的杂化方式是___ ,NH3的沸点高于PH3的原因是___ 。
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:___ 。
(5)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为___ ,其中Fe的配位数为___ 。
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xcm,高为ycm,NA为阿伏加 德罗常数的值,则晶胞的密度为___ g·cm-3(列出计算式即可)。

(1)Fe2+电子排布式为
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
| 离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
| 水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:
(5)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xcm,高为ycm,NA为阿伏加 德罗常数的值,则晶胞的密度为

您最近一年使用:0次
2020-06-28更新
|
1995次组卷
|
4卷引用:重庆市江津中学、实验中学等七校2020届高三下学期6月联考(三诊)理科综合化学试题
重庆市江津中学、实验中学等七校2020届高三下学期6月联考(三诊)理科综合化学试题(已下线)2021年高考化学押题预测卷(广东卷)(01)(已下线)2021年高考全国乙卷化学试题变式题2021年广东省高考化学试卷变式题11-21
名校
解题方法
6 . 硼化镁是迄今发现的临界温度最高的简单的金属化合物超导材料。回答下列问题:
(1)基态硼的电子排布图为__ ,基态镁原子的电子运动状态有__ 种。
(2)BF3的键角(填“大于”、“小于”或“等于”)__ NF3的键角,理由是__ 。
(3)碱土金属的碳酸盐热分解反应模式为:MCO3(s)=MO(s)+CO2(g)。从结构的角度解释:MgCO3的热分解温度小于CaCO3的热分解温度的原因是__ 。
(4)已知硼化镁属六方晶系(如图1所示)a=b≠c,α=β=90°,γ=120°。又知硼化镁是一种插层型离子化合物,镁层和硼层交替排列;镁原子层呈三角形结构,硼原子层具有规则的六角蜂房结构,与石墨相似。硼化镁晶体沿z轴方向的投影如图2所示,黑球代表硼原子,白球代表镁原子。硼化镁的化学式为__ ;B的配位数是__ 。

(5)已知硼化镁的晶格常数为:a=b=0.3086nm,c=0.3524nm,则硼化镁晶体的密度表达式为__ g/cm3(用NA表示阿伏加 德罗常数)。
(1)基态硼的电子排布图为
(2)BF3的键角(填“大于”、“小于”或“等于”)
(3)碱土金属的碳酸盐热分解反应模式为:MCO3(s)=MO(s)+CO2(g)。从结构的角度解释:MgCO3的热分解温度小于CaCO3的热分解温度的原因是
(4)已知硼化镁属六方晶系(如图1所示)a=b≠c,α=β=90°,γ=120°。又知硼化镁是一种插层型离子化合物,镁层和硼层交替排列;镁原子层呈三角形结构,硼原子层具有规则的六角蜂房结构,与石墨相似。硼化镁晶体沿z轴方向的投影如图2所示,黑球代表硼原子,白球代表镁原子。硼化镁的化学式为

(5)已知硼化镁的晶格常数为:a=b=0.3086nm,c=0.3524nm,则硼化镁晶体的密度表达式为
您最近一年使用:0次
2020-06-26更新
|
254次组卷
|
2卷引用:重庆市万州第二高级中学2022-2023学年高三下学期第五次质量检测化学试题
解题方法
7 . 我国化学家合成的铬的化合物,通过烷基铝和[ph3C]+[B(C6F5)4]-活化后,对乙烯聚合表现出较好的催化活性。合成铭的化合物过程中一步反应如下,该反应涉及H、C、N、O、Cl、Cr等多种元素。
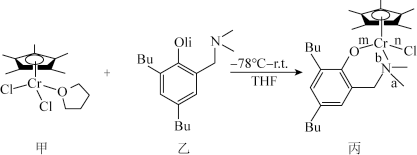
回答下列问题:
(1)下列状态的氯中,电离最外层一个电子所需能量最大的是_____________ (填标号)。
A.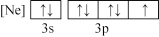 B.
B.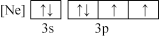
C. D.
D.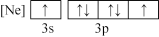
(2)化合物乙中碳原子采取的杂化方式为______ ,化合物丙中a、b、n、m处的化学键是配位键的是______ (填字母)处。
(3)Cr3+具有较强的稳定性,Cr3+的核外电子排布式为______ ;已知没有未成对d电子的过渡金属离子形成的水合离子是无色的,Ti4+、V3+、Ni2+三种离子的水合离子为无颜色的是______ (填离子符号)。
(4)ClO3-的键角小于ClO4-的键角,原因是______ 。
(5)根据结构与性质的关系解释,HNO2的酸性比HNO3弱的原因:______ 。
(6)水在合成铬的化合物的过程中作溶剂。研究表明水能凝结成13种类型的结晶体。其中重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y、z轴的投影图如图所示,晶体中的H2O配位数为_____ 晶胞边长为a pm,则重冰的密度为____ g·cm-3(写出数学表达式,NA为阿伏加 德罗常数)。

回答下列问题:
(1)下列状态的氯中,电离最外层一个电子所需能量最大的是
A.
 B.
B.
C.
 D.
D.
(2)化合物乙中碳原子采取的杂化方式为
(3)Cr3+具有较强的稳定性,Cr3+的核外电子排布式为
(4)ClO3-的键角小于ClO4-的键角,原因是
(5)根据结构与性质的关系解释,HNO2的酸性比HNO3弱的原因:
(6)水在合成铬的化合物的过程中作溶剂。研究表明水能凝结成13种类型的结晶体。其中重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y、z轴的投影图如图所示,晶体中的H2O配位数为

您最近一年使用:0次
2020-06-22更新
|
270次组卷
|
2卷引用:重庆市缙云教育联盟2020-2021学年高一下学期期末质量检测化学试题
8 . 非金属和金属单质以及相关化合物有着广泛的应用,回答下列相关问题:
(1)铜或铜盐的焰色反应为绿色,下列有关原理分析的叙述正确的是______ (填字母)。
a. 电子从基态跃迁到较高的激发态 b. 电子从较高的激发态跃迁到基态
c. 焰色反应的光谱属于吸收光谱 d. 焰色反应的光谱属于发射光谱
(2)In元素基态原子的价电子排布式为________ 。与Cu元素同周期,且基态原子有2个未成对电子的过渡元素是____ (填元素符号)。
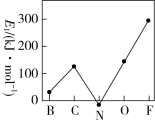
(3)第一电子亲和能(E1)是元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量。第二周期部分元素的E1变化趋势如图所示。试分析碳元素的E1较大的原因:______________ 。
(4)[PtCl4(NH3)2]中H-N-H键之间的夹角____ (填“>”“<”或“=”)NH3分子中H-N-H键之间的夹角,原因是________________ 。
(5)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4。1个Fe(CO)5分子中含有σ键数目为____ ;已知Ni(CO)4分子为正四面体构型,下列溶剂能够溶解Ni(CO)4的是____ (填字母)。
A. 四氯化碳 B.苯 C.水 D.液氨
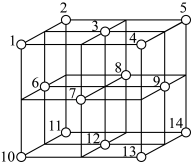
(6)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和由3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为____ 。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18 g·cm-3,则该晶胞参数a=_____ cm(写出计算表达式即可)。
(1)铜或铜盐的焰色反应为绿色,下列有关原理分析的叙述正确的是
a. 电子从基态跃迁到较高的激发态 b. 电子从较高的激发态跃迁到基态
c. 焰色反应的光谱属于吸收光谱 d. 焰色反应的光谱属于发射光谱
(2)In元素基态原子的价电子排布式为
(3)第一电子亲和能(E1)是元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量。第二周期部分元素的E1变化趋势如图所示。试分析碳元素的E1较大的原因:

(4)[PtCl4(NH3)2]中H-N-H键之间的夹角
(5)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4。1个Fe(CO)5分子中含有σ键数目为
A. 四氯化碳 B.苯 C.水 D.液氨
(6)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和由3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为

您最近一年使用:0次
名校
解题方法
9 . 碳元素在无机物和有机物中均充当了重要的角色,请回答下列问题:
(1)基态碳原子的价层电子排布图(轨道表达式)为__ ,其电子占据的能量最高的原子轨道的形状为__ ;C、N、O三种元素第一电离能最大的是__ 。
(2)有机物 中碳原子的轨道杂化类型为
中碳原子的轨道杂化类型为__ ,分子中两种碳碳单键长的大小关系为①__ ②(填“>”、“<”或“=”)。
(3) 和
和 均可以形成氢键,则沸点较高的是
均可以形成氢键,则沸点较高的是__ ,原因是__ 。
(4)石墨的结构及晶胞如图一所示,则石墨的密度为__ g·cm-3(用含a、d、NA的表达式表示)。A的原子坐标为(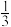 、
、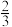 、0),则B的原子坐标为
、0),则B的原子坐标为__ 。

(5)石墨能与熔融的金属K作用,形成一种青铜色的化合物CxK,如图二所示,则x=__ 。
(1)基态碳原子的价层电子排布图(轨道表达式)为
(2)有机物
 中碳原子的轨道杂化类型为
中碳原子的轨道杂化类型为(3)
 和
和 均可以形成氢键,则沸点较高的是
均可以形成氢键,则沸点较高的是(4)石墨的结构及晶胞如图一所示,则石墨的密度为
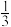 、
、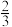 、0),则B的原子坐标为
、0),则B的原子坐标为
(5)石墨能与熔融的金属K作用,形成一种青铜色的化合物CxK,如图二所示,则x=
您最近一年使用:0次
名校
解题方法
10 . 《自然》杂志于2018年3月15日发布,中国留学生曹原用石墨烯实现了常温超导。这一发现将在很多领域发生颠覆性的革命。镓(Ga)、硒(Se)的单质及某些化合物如砷化镓等都是常用的半导体材料,超导和半导体材料都广泛应用于航空航天测控、光纤通讯等领域。请回答下列与碳、砷、镓、硒有关的问题。
(1)基态硒原子的核外价层电子排布式为___ ,与硒同周期的p区元素中第一电离能大于硒的元素有___ 种,SeO3的空间构型是___ 。
(2)化合物[EMIM][AlCl4]具有很高的应用价值,EMIM+结构如图所示。
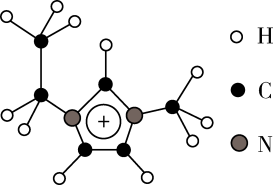
①EMIM+离子中各元素电负性由大到小的顺序是___ 。
②EMIM+离子中碳原子的杂化轨道类型为___ 。
③大π键可用符号π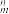 表示,其中m、n分别代表参与形成大π键的原子数和电子数,则EMIM+离子中的大π键应表示
表示,其中m、n分别代表参与形成大π键的原子数和电子数,则EMIM+离子中的大π键应表示___ 。
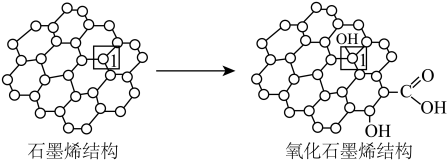
(3)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯如图所示,转化后1号C原子与相邻C原子间键能变小,原因是___ 。
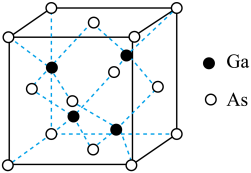
(4)GaAs为原子晶体,密度为ρg•cm-3,其晶胞结构如图所示,Ga和As的原子半径分别为apm和bpm,GaAs晶胞中原子的体积占晶胞体积的百分率为A,则阿伏加 德罗常数的值为NA=___ 。(用字母表示)
(1)基态硒原子的核外价层电子排布式为
(2)化合物[EMIM][AlCl4]具有很高的应用价值,EMIM+结构如图所示。

①EMIM+离子中各元素电负性由大到小的顺序是
②EMIM+离子中碳原子的杂化轨道类型为
③大π键可用符号π
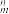 表示,其中m、n分别代表参与形成大π键的原子数和电子数,则EMIM+离子中的大π键应表示
表示,其中m、n分别代表参与形成大π键的原子数和电子数,则EMIM+离子中的大π键应表示(3)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯如图所示,转化后1号C原子与相邻C原子间键能变小,原因是

(4)GaAs为原子晶体,密度为ρg•cm-3,其晶胞结构如图所示,Ga和As的原子半径分别为apm和bpm,GaAs晶胞中原子的体积占晶胞体积的百分率为A,则阿伏加 德罗常数的值为NA=

您最近一年使用:0次
2020-06-08更新
|
197次组卷
|
2卷引用:重庆市2020届高三5月调研(二诊)考试理科综合化学试题



