1 . 硼酸(H3BO3)是一种片层状结构的白色晶体(下图),有油腻感,可做润滑剂。硼酸对人体受伤组织有缓和防腐作用,故可以用于医药和食品防腐等方面。回答下列问题:
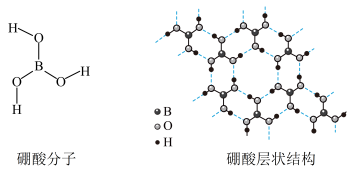
(1)B原子的结构示意图为_____________________ ;
(2)硼酸为一元弱酸,在水中电离方程式为H3BO3+H2O [B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式
[B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式_________________________ ;
(3)下列有关硼酸晶体的说法正确的是__________ ;
A.H3BO3分子的稳定性与氢键有关
B.含1 molH3BO3的晶体中有3 mol氢键
C.分子中B、O最外层均为8e-稳定结构
D.B原子杂化轨道的类型sp2,同层分子间的主要作用力是范德华力
(4)根据对角线规则,与B性质相似的元素是__________ 。
(5)含氧酸的通式为(HO)mROn,根据非羟基氧原子数判断,与H3BO3酸性最接近的是________ ;
A.HClO B.H4SiO4 C.H3PO4 D.HNO2
(6)一种硼酸盐的阴离子为B3O6n-,n=_____________ ;B3O6n-结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出B3O6n-的结构图(注明所带电荷数); _____________ 。

(1)B原子的结构示意图为
(2)硼酸为一元弱酸,在水中电离方程式为H3BO3+H2O
 [B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式
[B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式(3)下列有关硼酸晶体的说法正确的是
A.H3BO3分子的稳定性与氢键有关
B.含1 molH3BO3的晶体中有3 mol氢键
C.分子中B、O最外层均为8e-稳定结构
D.B原子杂化轨道的类型sp2,同层分子间的主要作用力是范德华力
(4)根据对角线规则,与B性质相似的元素是
(5)含氧酸的通式为(HO)mROn,根据非羟基氧原子数判断,与H3BO3酸性最接近的是
A.HClO B.H4SiO4 C.H3PO4 D.HNO2
(6)一种硼酸盐的阴离子为B3O6n-,n=
您最近一年使用:0次
2019-06-14更新
|
115次组卷
|
2卷引用:2015-2016学年重庆市第八中学高二下第三次月考化学试卷
名校
解题方法
2 . N、Fe是两种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态N原子最高能级的电子云轮廓图形状是__________ ,其核外有______ 种不同运动状态的电子。
(2)第一电离能N_____ O(填“>”“<”或“=”),其原因是_______________________ 。
(3)在高压下氮气会发生聚合得到高聚氮。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。高聚氮的晶体类型是__________ ,氮原子的杂化轨道类型为__________ 。
(4)六方氮化硼(BN)与石墨晶体结构类似,硼原子和氮原子交替相连,但石墨可以导电而六方BN却不能导电,其原因是_____________________________ 。
(5)叠氮酸(HN3)在生产生活中有着重要应用。叠氮酸(HN3)可用HNO2氧化肼(N2H4)制得,化学方程式是N2H4 + HNO2=HN3 + 2H2O。下列叙述错误的是_________ 。
A.HN3和N2H4都是由极性键和非极性键构成的非极性分子
B.NaN3的晶格能大于KN3的晶格能
C.HN3分子中四个原子可能在一条直线上
D.叠氮酸(HN3)和水能形成分子间氢键
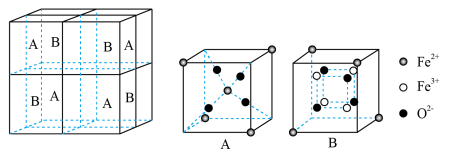
(6)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比是__________ (填最简整数比);已知该晶体的晶胞参数为a nm,阿伏加 德罗常数的值为NA,则该晶体的密度是_______ g cm-3(用含a和NA的代数式表示)。
cm-3(用含a和NA的代数式表示)。
(1)基态N原子最高能级的电子云轮廓图形状是
(2)第一电离能N
(3)在高压下氮气会发生聚合得到高聚氮。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。高聚氮的晶体类型是
(4)六方氮化硼(BN)与石墨晶体结构类似,硼原子和氮原子交替相连,但石墨可以导电而六方BN却不能导电,其原因是
(5)叠氮酸(HN3)在生产生活中有着重要应用。叠氮酸(HN3)可用HNO2氧化肼(N2H4)制得,化学方程式是N2H4 + HNO2=HN3 + 2H2O。下列叙述错误的是
A.HN3和N2H4都是由极性键和非极性键构成的非极性分子
B.NaN3的晶格能大于KN3的晶格能
C.HN3分子中四个原子可能在一条直线上
D.叠氮酸(HN3)和水能形成分子间氢键
(6)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比是
 cm-3(用含a和NA的代数式表示)。
cm-3(用含a和NA的代数式表示)。
您最近一年使用:0次
2019-06-04更新
|
262次组卷
|
2卷引用:【全国百强校】重庆市西南大学附属中学校2019届高三第十次月考理科综合化学试题
名校
解题方法
3 . 微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用,其化合物也应用广泛。
(1)基态B原子的电子排布图为________________________ ,其第一电离能比Be___________ (填“大”或“小”)。
(2)三价B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构简式为___________ (标出配位键),其中心原子的杂化方式为________ ,写出[BH4]-的一种阳离子等电子体_______ 。
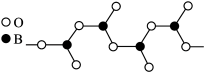
(3)下图表示多硼酸根的一种无限长的链式结构,其化学式可表示为____________ (以n表示硼原子的个数)。
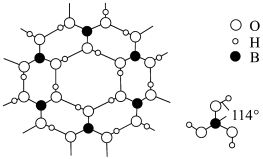
(4)硼酸晶体是片层结构,下图表示的是其中一层的结构。每一层内存在的作用力有_________ 。
(5)三氯化硼的熔点比氯化镁的熔点低,原因是_______________________ 。
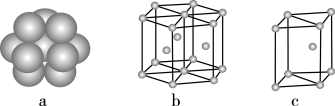
(6)镁单质晶体中原子的堆积模型如下图,它的堆积模型名称为_______ ;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ g·cm-3,已知阿伏加 德罗常数为NA,则镁的摩尔质量的计算式是________________ 。
(1)基态B原子的电子排布图为
(2)三价B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构简式为
(3)下图表示多硼酸根的一种无限长的链式结构,其化学式可表示为
(4)硼酸晶体是片层结构,下图表示的是其中一层的结构。每一层内存在的作用力有
(5)三氯化硼的熔点比氯化镁的熔点低,原因是
(6)镁单质晶体中原子的堆积模型如下图,它的堆积模型名称为
您最近一年使用:0次
2019-06-01更新
|
1238次组卷
|
6卷引用:重庆市第一中学2020届高三上学期期末考试理综化学试题
名校
解题方法
4 . AA705合金(含Al、Zn、Mg和Cu)几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。但这种合金很难被焊接。最近科学家将碳化钛纳米颗粒(大小仅为十亿分之一米)注入AA7075的焊丝内,让这些纳米颗粒充当连接件之间的填充材料。注入了纳米粒子的填充焊丝也可以更容易地连接其他难以焊接的金属和金属合金。回答下列问题:
(1)基态铜原子的价层电子排布式为__________ 。
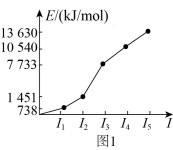
(2)第三周期某元素的前5个电子的电离能如图1所示。该元素是_____ (填元素符号),判断依据是_______ 。
(3)CN—、NH3、H2O和OH—等配体都能与Zn2+形成配离子。1mol [Zn(NH3)4]2+含___ molσ键,中心离子的配位数为_____ 。
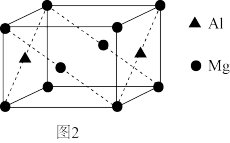
(4)铝镁合金是优质储钠材料,原子位于面心和顶点,其晶胞如图2所示。1个铝原子周围有_____ 个镁原子最近且等距离。
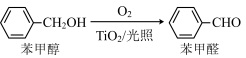
(5)在二氧化钛和光照条件下,苯甲醇可被氧化成苯甲醛:
①苯甲醇中C原子杂化类型是__________ 。
②苯甲醇的沸点高于苯甲醛,其原因是__________ 。
(6)钛晶体有两种晶胞,如图所示。
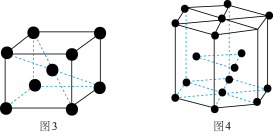
①如图3所示,晶胞的空间利用率为______ (用含п的式子表示)。
②已知图4中六棱柱边长为x cm,高为y cm。该钛晶胞密度为D g·cm-3,NA为______ mol—1(用含x y和D的式子表示)。
(1)基态铜原子的价层电子排布式为
(2)第三周期某元素的前5个电子的电离能如图1所示。该元素是


(3)CN—、NH3、H2O和OH—等配体都能与Zn2+形成配离子。1mol [Zn(NH3)4]2+含
(4)铝镁合金是优质储钠材料,原子位于面心和顶点,其晶胞如图2所示。1个铝原子周围有
(5)在二氧化钛和光照条件下,苯甲醇可被氧化成苯甲醛:

①苯甲醇中C原子杂化类型是
②苯甲醇的沸点高于苯甲醛,其原因是
(6)钛晶体有两种晶胞,如图所示。

①如图3所示,晶胞的空间利用率为
②已知图4中六棱柱边长为x cm,高为y cm。该钛晶胞密度为D g·cm-3,NA为
您最近一年使用:0次
2019-05-31更新
|
1022次组卷
|
8卷引用:重庆市第一中学2020届高三下学期5月月考(全国2)理综化学试题
重庆市第一中学2020届高三下学期5月月考(全国2)理综化学试题【市级联考】福建省福州市2019届高三第三次质量检测理科综合化学试题湖南师范大学附属中学2020届高三第六次月考理综化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(八)广东省广州市天河区2020届高三第二次综合测试理综化学试题(已下线)专题6.4 物质结构与性质(选考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升山东省泰安市2020届高三第二次模拟考试化学试题(已下线)01 物质结构与性质综合题型集训(1) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
名校
解题方法
5 . 根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的立体构型正确的是( )
| 选项 | 分子式 | 中心原子 杂化方式 | 价层电子对 互斥模型 | 分子或离子 的立体构型 |
| A | SO2 | sp | 直线形 | 直线形 |
| B | HCHO | sp2 | 平面三角形 | 三角锥形 |
| C | NF3 | sp2 | 四面体形 | 平面三角形 |
| D | NH4+ | sp3 | 正四面体形 | 正四面体形 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-04-27更新
|
1372次组卷
|
25卷引用:重庆市实验中学校2021-2022学年高二下学期第一次月考化学试题
重庆市实验中学校2021-2022学年高二下学期第一次月考化学试题重庆市二0三中学校2021-2022学年高二下学期3月月考化学试题吉林省乾安县第七中学2018-2019学年高二下学期第一次质量检测化学试题【全国百强校】新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二下学期第一次调研化学试题内蒙古自治区第一机械制造(集团)有限公司第一中学2018-2019学年高二下学期期中考试化学试题山西省运城市永济涑北中学2019-2020学年高二下学期3月月考化学试题天津市第二十中学2019-2020学年高二下学期阶段性检测化学试题湖北省襄阳市第一中学2019-2020学年高二下学期四月月考化学试题河北省邢台市2019-2020学年高二下学期期末考试化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 综合检测卷鲁科版2019选择性必修2第2章综合检测卷福建省南安市柳城中学2020-2021学年高二下学期期中考试化学试题四川省广安市第二中学2021-2022学年高二下学期第一次月考化学试题广东省十五校联盟2021-2022学年高二下学期第一次联考化学试题辽宁省凤城市第一中学2021-2022学年高二上学期12月月考化学试题福建省三明市五县2021-2022学年高二下学期联合质检考试(期中)化学试题广东省揭阳市榕城区仙桥中学2021-2022学年高二下学期期中考试化学试题河南省开封市五县部分校2021-2022学年高二下学期期中考试化学试题(已下线)考点47 分子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题14 分子结构与性质-2023年高考化学一轮复习小题多维练(全国通用)湖北省南漳县第二中学2021-2022学年高二下学期3月月考化学试题福建省厦门英才学校中学部2021-2022学年高二下学期半期考化学试题山东省德州市陵城区祥龙高级中学2022-2023学年高二下学期3月月考化学试题贵州省铜仁市松桃民族中学2022-2023学年高二下学期第一次月考化学试题(已下线)考点42 分子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
6 . 硅及其化合物有许多用途,回答下列问题:
(1)基态Si原子价层电子的排布图(轨道表达式)为_________ ,含有长硅链的化合物不是氢化物,而是氯化物。主要原因是F比H多了一种形状的原子轨道,该原子轨道的形状为___________ 。
(2)SiF4分子的立体构型为_______ 形,SiCl4的熔、沸点均高于SiF4,主要原因是________________ 。
(3)SiF4可KF反应得K2SiF6晶体,该晶体可用于制取高纯硅,K2SiF6晶体中微观粒子之间的作用力有______ 。
a.离子键 b.共价键 c.配位键 d.分子间作用力 e.氢键

(4)H4SiO4的结构简式如图(1),中心原子Si的轨道杂化类型为_________ ,H4SiO4在常温下能稳定存在,但H4CO4不能,会迅速脱水生成H2CO3,最终生成CO2,主要原因是___________ 。
(5)硅的晶胞结构如图(2)所示,若该立方晶胞的边长为a nm,阿伏伽德罗常数的数值为NA,则距离最近的两个硅原子间的距离为_____ nm,晶体硅密度的计算表达式为_____ g/cm3。
(1)基态Si原子价层电子的排布图(轨道表达式)为
(2)SiF4分子的立体构型为
(3)SiF4可KF反应得K2SiF6晶体,该晶体可用于制取高纯硅,K2SiF6晶体中微观粒子之间的作用力有
a.离子键 b.共价键 c.配位键 d.分子间作用力 e.氢键

(4)H4SiO4的结构简式如图(1),中心原子Si的轨道杂化类型为
(5)硅的晶胞结构如图(2)所示,若该立方晶胞的边长为a nm,阿伏伽德罗常数的数值为NA,则距离最近的两个硅原子间的距离为
您最近一年使用:0次
2019-04-26更新
|
275次组卷
|
2卷引用:【全国百强校】重庆市第一中学校2019届高三下学期4月月考理科综合化学试题
名校
7 . 铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__________ (填晶体类型);Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_____________ ;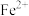 的核外电子排布式为
的核外电子排布式为_____________________ 。
(2)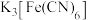 溶液可用于检验
溶液可用于检验_________ (填离子符号);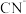 中碳原子杂化轨道类型为
中碳原子杂化轨道类型为_____ ;1mol 含有的π键数目为
含有的π键数目为_______ (用N表示);C、N、O第一电离能由大到小的顺序为_________ (用元素符号表示)。
(3)某M原子的外围电子排布式为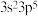 ,铜与M形成的某化合物的晶胞结构如下图所示(黑点代表铜原子)。
,铜与M形成的某化合物的晶胞结构如下图所示(黑点代表铜原子)。
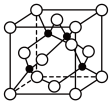
①该晶体的化学式为__________________ 。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于___________ (填“离子”或“共价”)化合物。
③已知该晶体的密度为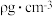 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,则该晶体中铜原子和M原子之间的最短距离为
,则该晶体中铜原子和M原子之间的最短距离为____________________ pm(只需写出计算式)。
(1)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于
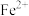 的核外电子排布式为
的核外电子排布式为(2)
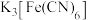 溶液可用于检验
溶液可用于检验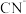 中碳原子杂化轨道类型为
中碳原子杂化轨道类型为 含有的π键数目为
含有的π键数目为(3)某M原子的外围电子排布式为
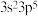 ,铜与M形成的某化合物的晶胞结构如下图所示(黑点代表铜原子)。
,铜与M形成的某化合物的晶胞结构如下图所示(黑点代表铜原子)。
①该晶体的化学式为
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于
③已知该晶体的密度为
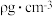 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,则该晶体中铜原子和M原子之间的最短距离为
,则该晶体中铜原子和M原子之间的最短距离为
您最近一年使用:0次
2019-04-26更新
|
568次组卷
|
4卷引用:重庆市黔江新华中学校2021届高三上学期9月月考化学试题
解题方法
8 . [化学——选修3:物质结构与性质]
具有自主知识产权、中国制造的C919,是一款与波音737MAX同等体量的民用飞机。制造C919需要大量的合金材料,其中包括钢,钢是现代社会的物质基础,钢中除含有铁外还含有碳和少量不可避免的硅、锰、磷、硫等元素。请回答下列有关问题:
(1)基态Mn原子的价电子排布式为___________ 。
(2)NO3-的立体构型名称为___________ ,其中心原子的杂化方式为___________ 。
(3)C、O、Si三种元素第一电离能由大到小的顺序是___________ 。
(4)写出和CN-互为等电子体的一种离子的电子式___________ 。
(5)铵盐大多易分解,NH4F和NH4Br两种盐中较易分解的是___________ (填化学式);理由是___________ 。
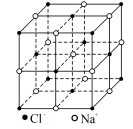
(6)氧化亚铁晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为apm,该晶体的密度为ρg·cm-3,则a=___________ (列出计算式即可,用NA表示阿伏伽德罗常数的值)。
具有自主知识产权、中国制造的C919,是一款与波音737MAX同等体量的民用飞机。制造C919需要大量的合金材料,其中包括钢,钢是现代社会的物质基础,钢中除含有铁外还含有碳和少量不可避免的硅、锰、磷、硫等元素。请回答下列有关问题:
(1)基态Mn原子的价电子排布式为
(2)NO3-的立体构型名称为
(3)C、O、Si三种元素第一电离能由大到小的顺序是
(4)写出和CN-互为等电子体的一种离子的电子式
(5)铵盐大多易分解,NH4F和NH4Br两种盐中较易分解的是
(6)氧化亚铁晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为apm,该晶体的密度为ρg·cm-3,则a=

您最近一年使用:0次
名校
解题方法
9 . 铁、钴、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题:
(1)铁、钴、镍的基态原子核外未成对电子数最多的是_________ 。
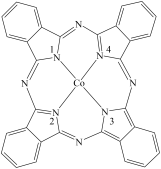
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是_______ (填1、2、3、4),三种非金属原子的电负性由大到小的顺序为_______ (用相应的元素符号表示);氮原子的杂化轨道类型为________ 。

(3)Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x,晶体属于_______ (填晶体类型),若配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=________ 。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO______ FeO(填“>”“<”或“=”),原因是_________ 。
(5)NiAs的晶胞结构如图所示:①镍离子的配位数为_________ 。
②若阿伏伽德罗常数的值为NA,晶体密度为pg·cm-3,则该晶胞中最近的Ni2+之间的距离为________ cm。(写出计算表达式)
(1)铁、钴、镍的基态原子核外未成对电子数最多的是
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是


(3)Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x,晶体属于
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO
(5)NiAs的晶胞结构如图所示:①镍离子的配位数为
②若阿伏伽德罗常数的值为NA,晶体密度为pg·cm-3,则该晶胞中最近的Ni2+之间的距离为
您最近一年使用:0次
2019-04-17更新
|
649次组卷
|
4卷引用:【全国百强校】重庆南开中学2020届高三第一学期9月理科综合练习化学试题
名校
解题方法
10 . 常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs 太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)基态亚铜离子(Cu+)的价电子排布图为_________ ;高温下CuO 容易转化为Cu2O,试从原子结构角度解释原因:_____ 。
(2)镓、砷、硒三种元素位于第四周期,其第一电离能从大到小的顺序为_____ (用元素符号表示)
(3)GaCl3和AsF3的立体构型分别是_____ ,_____ 。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH) 4]-中B 原子的杂化类型为_____ 。②[B(OH)4 ]-的结构式为_____ 。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。
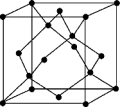
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是_____ (用化学式表示);②金刚石的晶胞参数为a pm(1pm=10-12 m)。1cm3晶体的平均质量为_____ g(只要求列算式,阿伏伽德罗常数为NA)。
(1)基态亚铜离子(Cu+)的价电子排布图为
(2)镓、砷、硒三种元素位于第四周期,其第一电离能从大到小的顺序为
(3)GaCl3和AsF3的立体构型分别是
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH) 4]-中B 原子的杂化类型为
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是
您最近一年使用:0次
2019-03-15更新
|
279次组卷
|
3卷引用:重庆第二外国语学校2020-2021学年度高三下学期高三5月诊断考试化学试题
重庆第二外国语学校2020-2021学年度高三下学期高三5月诊断考试化学试题2020届高三化学二轮选修大题必练—— 物质结构与性质大题练(已下线)广东省汕头市2019届普通高中毕业班第一次模拟考试理科化学



