名校
解题方法
1 . X、Y、Z、W、M、N是元素周期表中前四周期原子序数依次增大的六种元素,其相关信息如下表:
(1)红色金属N位于元素周期表中的位置为______________ ,其基态原子的电子排布式为_______________
(2)H2Y分子的立体构型为_____ 形,XY2分子中X原子的杂化轨道的类型是______ ,与XY分子互为等电子体的微粒有__________________ (写一种即可,填化学式)
(3)Y单质和Z单质点燃条件下得到的固体产物为________ (填化学式),其晶体类型为___________ 晶体
(4)与Z同周期且相邻的两种元素的原子与Z比较,三者第一电离能最大的为______ ,X、Y两种元素电负性的大小关系为_____ >_____ (均用元素符号表示)。
(5)写出N的单质在潮湿的空气中生成绿色锈斑的化学方程式__________
(6)W与Y元素同主族且相邻,W的单质在空气中燃烧生成一种无色有刺激性气味的气体。该气体与含1.5 mol M的一种含氧酸(该酸的钾盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是:______________________ 。
元素 | 相关信息 |
X | X的基态原子核外只有三个能级,且各能级电子数相等 |
Y | Ne与Y2-的核外电子数相同 |
Z | Z的基态原子价电子排布为nsn-1 |
N | N的单质是一种常见的红色金属,在潮湿的空气中易生成绿色的锈斑 |
(1)红色金属N位于元素周期表中的位置为
(2)H2Y分子的立体构型为
(3)Y单质和Z单质点燃条件下得到的固体产物为
(4)与Z同周期且相邻的两种元素的原子与Z比较,三者第一电离能最大的为
(5)写出N的单质在潮湿的空气中生成绿色锈斑的化学方程式
(6)W与Y元素同主族且相邻,W的单质在空气中燃烧生成一种无色有刺激性气味的气体。该气体与含1.5 mol M的一种含氧酸(该酸的钾盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是:
您最近一年使用:0次
名校
2 . 下列说法不正确 的是
| A.向硫酸铜溶液中加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解后得到深蓝色的透明溶液,形成该溶液是因为产生了配合离子[Cu(NH3)4] 2+ |
| B.NH4+的空间构型是正四面体形 |
| C.氨气极易溶于水的重要原因之一:氨分子与水分子之间能形成氢键 |
| D.由于氢键的作用,使NH3、H2O、HF的沸点反常,且沸点高低顺序为HF>H2O>NH3 |
您最近一年使用:0次
名校
解题方法
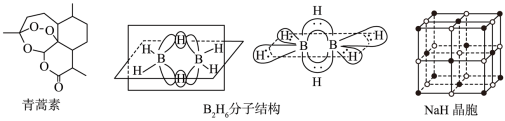
3 . 青蒿素是从黄花蒿中提取的一种无色针状晶体,双氢青蒿素是青蒿素的重要衍生物,抗疟疾疗效优于青蒿素,请回答下列问题:
(1)组成青蒿素的三种元素电负性由大到小排序是__________ ,画出基态O原子的价电子排布图__________ 。
(2)一个青蒿素分子中含有_______ 个手性碳原子。
(3)双氢青蒿素的合成一般是用硼氢化钠(NaBH4)还原青蒿素.硼氢化物的合成方法有:
2LiH+B2H6=2LiBH4; 4NaH+BF3═NaBH4+3NaF
①写出BH4﹣的等电子体_________ (分子、离子各写一种);
②B2H6分子结构如图,2个B原子和一个H原子共用2个电子形成3中心二电子键,中间的2个氢原子被称为“桥氢原子”,它们连接了2个B原子.则B2H6分子中有______ 种共价键,B原子的杂化方式为________ ;
③NaBH4的阴离子中一个B原子能形成4个共价键,而冰晶石(Na3AlF6)的阴离子中一个Al原子可以形成6个共价键,原因是______________ ;
④NaH的晶胞如图,则NaH晶体中阳离子的配位数是_________ ;设晶胞中阴、阳离子为刚性球体且恰好相切,求阴、阳离子的半径比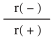 =
=__________ 。
(1)组成青蒿素的三种元素电负性由大到小排序是
(2)一个青蒿素分子中含有
(3)双氢青蒿素的合成一般是用硼氢化钠(NaBH4)还原青蒿素.硼氢化物的合成方法有:
2LiH+B2H6=2LiBH4; 4NaH+BF3═NaBH4+3NaF
①写出BH4﹣的等电子体
②B2H6分子结构如图,2个B原子和一个H原子共用2个电子形成3中心二电子键,中间的2个氢原子被称为“桥氢原子”,它们连接了2个B原子.则B2H6分子中有
③NaBH4的阴离子中一个B原子能形成4个共价键,而冰晶石(Na3AlF6)的阴离子中一个Al原子可以形成6个共价键,原因是
④NaH的晶胞如图,则NaH晶体中阳离子的配位数是
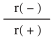 =
=
您最近一年使用:0次
名校
解题方法
4 . A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C,B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是_________ ,基态D原子价电子的轨道表达式为_______
(2)DA2分子的VSEPR模型是________ 。H2A比H2D熔沸点高得多的原因是_________ 。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH 溶液反应可生成Na[C(OH)4]
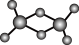
①C2Cl6属于_________ 晶体(填晶体类型),其中C原子的杂化轨道类型为______ 杂化。
②[C(OH)4]-中存在的化学键有__________ 。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是_________ 。
(5)B、C的氯化物晶格能分别是2957kJ/mol、5492kJ/mol,二者相差很大的原因是________ 。
(6)D与E所形成化合物晶体的晶胞如右图所示。
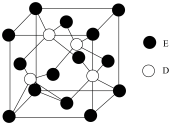
①在该晶胞中,E的配位数为__________ 。
②原子坐标参数可表示晶胞内部各原子的相对位置。右图晶胞中,原子坐标参数a为(0,0,0);b为(1/2,0,1/2),c为(1/2,1/2,0).则d原子的坐标为__________ 。
③已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为____ pm(列出计算式即可)。
(1)B、C中第一电离能较大的是
(2)DA2分子的VSEPR模型是
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH 溶液反应可生成Na[C(OH)4]

①C2Cl6属于
②[C(OH)4]-中存在的化学键有
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是
(5)B、C的氯化物晶格能分别是2957kJ/mol、5492kJ/mol,二者相差很大的原因是
(6)D与E所形成化合物晶体的晶胞如右图所示。

①在该晶胞中,E的配位数为
②原子坐标参数可表示晶胞内部各原子的相对位置。右图晶胞中,原子坐标参数a为(0,0,0);b为(1/2,0,1/2),c为(1/2,1/2,0).则d原子的坐标为
③已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为
您最近一年使用:0次
2017-02-17更新
|
453次组卷
|
3卷引用:【全国百强校】重庆市第一中学2017届高三下学期第二次月考理科综合化学试题
解题方法
5 . [化学—选修3:物质结构与性质]
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为_______________ ,D原子的杂化类型为_______________ 。
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点________ (填“大于”、“小于”、或“等于”)N的沸点,原因是_______________ 。
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为____________________ 。写出相应的化学反应方程式:____________________ 。
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:__________________ ,加入乙醇的作用是________________ 。
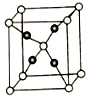
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为__________ 。若两个氧原子间最短距离为apm,列式计算晶体G的密度_______ g.cm-3
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为

您最近一年使用:0次
解题方法
6 . 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸。发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云。根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等。运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等。
回答下列问题:
(1)在组成NH4NO3、NaCN两种物质的元素中第一电离能最大的是___________ (填元素符号),解释原因_____________________________________________
(2)二甲基二硫和甲酸中,在水中溶解度较大的是______ (填名称),原因是_________________________________ ;烧碱所属的晶体类型为________ ;硫化碱(Na2S)的S2-的基态电子排布式是__________________________
(3)硝酸铵中,NO3-的立体构型为_______ ,中心原子的杂化轨道类型为______________
(4)1mol化合物NaCN中CN-所含的π键数为_____ ,与CN-互为等电子体的分子有________ 。(CN)2又称为拟卤素,实验室可以用氰化钠、二氧化锰和浓硫酸在加热条件下制得,写成该制备的化学方程式____________ 。
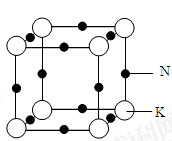
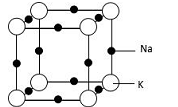
(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为____________ ;晶胞中K 原子的配位数为______ ;已知金属原子半径r(Na)=186pm、r(K)=227pm,计算晶体的空间利用率 __________________ (列出计算式,不需要计算出结果)。
回答下列问题:
(1)在组成NH4NO3、NaCN两种物质的元素中第一电离能最大的是
(2)二甲基二硫和甲酸中,在水中溶解度较大的是
(3)硝酸铵中,NO3-的立体构型为
(4)1mol化合物NaCN中CN-所含的π键数为
(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为

您最近一年使用:0次
2016-12-09更新
|
388次组卷
|
5卷引用:【全国校级联考】重庆市江津巴县长寿等七校联盟2018届高三第三次联考理综化学试题
解题方法
7 . 由N、B等元素组成的新型材料有着广泛用途。
(1)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造,由第二周期元素组成的与BCl3互为等电子体的阴离子为_________ (填离子符号,填一个)。
(2)氮硼烷化合物(H2N→BH2)和Ti(BH4)3均为广受关注的新型化学氮化物储氢材料。
①H2N→BH2中N原子的杂化类型为_________ ;
②Ti(BH4)3由TiCl3和LiBH4反应制得。基态Ti3+的未成对电子数有____ 个,BH4-的立体构型是_________ ;写出该制备反应的化学方程式_________ ;
③氮硼烷可由六元环状化合物(HB=NH)3通过如下所对应制得:
3CH4+2(HB=NH)3+6H2O═3CO2+6H3BNH3与上述化学方程式有关的叙述不正确的是_________ ;.(填标号)
(3)磷化硼(BP)是受到高度关注的耐麿材料;如图1为磷化硼晶胞。
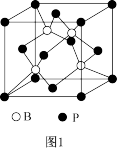

①磷化硼晶体属于________ 晶体(填晶体类型),________ (填是或否)含有配位键。
②晶体中B原子的配位数为_______ 。
(4)立方氮化硼是一种新型的超硬、耐麿、耐高温的结构材料,其结构和硬度都与金刚石相似,但熔点比金刚石低,原因是________ 。图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置________ 。
(1)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造,由第二周期元素组成的与BCl3互为等电子体的阴离子为
(2)氮硼烷化合物(H2N→BH2)和Ti(BH4)3均为广受关注的新型化学氮化物储氢材料。
①H2N→BH2中N原子的杂化类型为
②Ti(BH4)3由TiCl3和LiBH4反应制得。基态Ti3+的未成对电子数有
③氮硼烷可由六元环状化合物(HB=NH)3通过如下所对应制得:
3CH4+2(HB=NH)3+6H2O═3CO2+6H3BNH3与上述化学方程式有关的叙述不正确的是
| A.氮硼烷中存在配位键 |
| B.第一电离能:N>O>C>B |
| C.反应前后碳原子的轨道杂化类型不变 |
| D.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |


①磷化硼晶体属于
②晶体中B原子的配位数为
(4)立方氮化硼是一种新型的超硬、耐麿、耐高温的结构材料,其结构和硬度都与金刚石相似,但熔点比金刚石低,原因是
您最近一年使用:0次
解题方法
8 . 化学选修物质结构与性质2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸。发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云。
回答下列问题:
(1)在组成NH4NO3、NaCN两种物质的元素中第一电离能最大的是_______ (填元素符号),解释原因_____________________ 。
(2)二甲基二硫和甲酸中,在水中溶解度较大的是______ (填名称),原因是__________________ ;烧碱所属的晶体类型为________ ;硫化碱(Na2S)的S2-的基态电子排布式是__________________________ 。
(3)硝酸铵中,NO3-的立体构型为_______ ,中心原子的杂化轨道类型为___________ 。
(4)1mol化合物NaCN中CN-所含的π键数为___________ ,与CN-互为等电子体的分子有_________ 。(CN)2又称为拟卤素,实验室可以用氰化钠、二氧化锰和浓硫酸在加热条件下制得,写成该制备的化学方程式____________ 。
(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为____________ ;晶胞中K 原子的配位数为___ ;已知金属原子半径r(Na)=186pm、r(K)=227pm,计算晶体的空间利用率 __________________ (列出计算式,不需要计算出结果)。
回答下列问题:
(1)在组成NH4NO3、NaCN两种物质的元素中第一电离能最大的是
(2)二甲基二硫和甲酸中,在水中溶解度较大的是
(3)硝酸铵中,NO3-的立体构型为
(4)1mol化合物NaCN中CN-所含的π键数为
(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为

您最近一年使用:0次
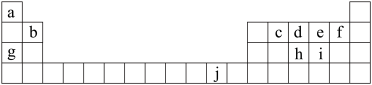
9 . 下表为周期表的一部分,表中所列的字母分别代表一种化学元素。
用化学用语回答下列问题:
(1)写出元素f的基态原子核外电子排布式______________ ;
(2)在C6a6分子中,元素c为______________ 杂化,该分子是___________ 分子(填“极性”或“非极性”)。
(3)ci2分子的电子式为_____________ ,ci2与ce2比较,沸点较高的是______________ (写分子式);
(4)第一电离能:h_________ i;电负性:g___________ b(填“>”、“<”或“=”)。
(5)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述正确的是___________ ;
(6)将氨水滴入到j的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液,显深蓝色的离子是_____________ ,写出蓝色沉淀溶解在氨水中的离子方程式______________ ;

用化学用语回答下列问题:
(1)写出元素f的基态原子核外电子排布式
(2)在C6a6分子中,元素c为
(3)ci2分子的电子式为
(4)第一电离能:h
(5)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述正确的是
| A.j位于元素周期表中第四周期、IB族,属于ds区元素 |
| B.d的基态原子中,2p能级为半充满,属于p区元素 |
| C.最外层电子排布式为4s1,一定属于IA族 |
| D.最外层电子排布式为ns2np1,该元素可能是ⅢA族或ⅢB族 |
您最近一年使用:0次
10 . 【化学一选修3:物质结构与性质】由N、B、Ni等元素组成的新型材料有着广泛用途。
(1)基态Ni原子的最外层电子排布式为_____________________ 。
(2)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。与上述化学方程式有关的叙述不正确的是_________。(填标号)
(3)1个(HB=NH)3分子中有__________ 个 键。
键。
(4)立方氮化硼结构和硬度都与金刚石相似,但熔点比金刚石低,原因是__________ 。右图是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置,__________ 。

(5)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为________ ,图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________ 。


(6)在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如右图),可以认为氧离子作密置单层排列,镍离子填充其中,氧离子的半径为a pm,则每平方米面积上分散的该晶体的质量为_________ g(用a、NA表示)
(1)基态Ni原子的最外层电子排布式为
(2)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。与上述化学方程式有关的叙述不正确的是_________。(填标号)
| A.反应前后碳原子的轨道杂化类型不变 |
| B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
| C.第一电离能:N>O>C>B |
| D.化合物A中存在配位键 |
 键。
键。(4)立方氮化硼结构和硬度都与金刚石相似,但熔点比金刚石低,原因是

(5)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为


(6)在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如右图),可以认为氧离子作密置单层排列,镍离子填充其中,氧离子的半径为a pm,则每平方米面积上分散的该晶体的质量为
您最近一年使用:0次



