(1)P、Q的简单离子半径由大到小的顺序为
(2)P与Q两元素可形成1:3的化合物甲,写出甲分子的结构式
(3)Y、Z分别与X可形成原子个数比为1:2的6原子二元化合物乙、丙,乙、丙分子中Y、Z的杂化类型依次为
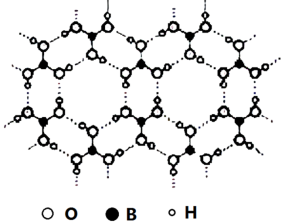
| A.硼酸分子含三个羟基,硼酸属于三元酸 |
| B.硼酸晶体熔融时主要破坏作用力为氢键 |
| C.硼酸分子中含有两种极性键 |
| D.硼酸分子中硼原子采用sp2杂化 |
| A.CS2是含极性键的非极性分子 |
B.CO 和ClO 和ClO 的具有相同的空间构型 的具有相同的空间构型 |
| C.AlCl3和SF6的中心原子均不不满足8电子构型 |
D.BF3和BF 的中心原子杂化方式不同 的中心原子杂化方式不同 |
 PCl
PCl +PCl
+PCl ,下列说法错误的是
,下列说法错误的是| A.PCl5分子中的化学键为极性键 |
| B.PCl5在熔融状态下具有一定的导电性 |
C.PCl 呈正四面体构型 呈正四面体构型 |
D.PCl 中P只用3s、3p轨道参与成键 中P只用3s、3p轨道参与成键 |

(1)基态钒原子的核外电子排布式为
(2)钒固氮酶中钒的配位原子有
(3)配体CH3CN中碳的杂化类型为
(4)配体CH3CN中所涉及元素的电负性由强到弱依次排序为
(5)写出证明非金属性Cl >S的一个常见离子方程式:
(1)按电子排布Ti元素在元素周期表分区中属于
(2)某含钛化合物的化学式为[TiCl(H2O)5]Cl2•H2O,化合物中含有的化学键类型是
(3)二氧化钛是很好的催化剂,可以催化如下反应:
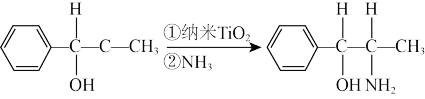
化合物甲中,sp2杂化的碳原子个数与sp3杂化的碳原子个数之比为
(4)二氯二茂钛(IV)在金属有机合成中应用较广。其结构式如图所示。分子中的大π键可用符号
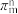 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为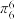 ),则二氯二茂钛(IV)中的大π键可表示为
),则二氯二茂钛(IV)中的大π键可表示为
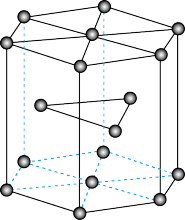
(5)金属钛晶体的一种原子堆积方式如图所示,这种堆积方式称为
Ⅰ.(1)磷的价电子排布图是
(2)NaN3常用于汽车安全气囊,写出与其阴离子互为等电子体的分子的化学式
 的空间构型是
的空间构型是(3)胺硼烷(NH3BH3)有极佳的稳定性和环境友好性,是一种非常有潜力的储氢材料。胺硼烷(NH3BH3)具有的化学键为
Ⅱ.已知:红砷镍矿,其主要成分为NiAs。将Ni原子放在晶胞原点.得其晶胞结构如图:
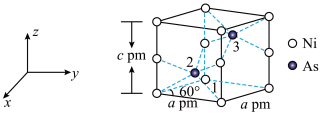
(4)NiAs晶体中As的配位数是
(5)该晶体的密度d=
8 . 地壳中含量排在前五位的元素分别是O、Si、Al、Fe、Ca,占到地壳总质量的90.83%。回答下列问题:
(1)Ca元素的基态原子价电子排布式为
(2)“棕色环”现象是检验溶液中 的一种方法。向含有
的一种方法。向含有 溶液的试管中加入FeSO4,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为[Fe(NO)(H2O)5]SO4。
溶液的试管中加入FeSO4,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为[Fe(NO)(H2O)5]SO4。
① 中N元素采取
中N元素采取
②[Fe(NO)(H2O)5]SO4中含有的作用力类型有
a.离子键 b.金属键 c.配位键 d.极性键 e.非极性键
③[Fe(NO)(H2O)5]SO4中一种配体实际上是NO+,则其中Fe元素的化合价为
(3)硅酸盐中的硅酸根通常以[SiO4]四面体(如图a)的方式形成链状、环状或网络状复杂阴离子。图b为一种环状硅酸根离子,写出其化学式

(4)冰有十六种晶型。自然界中最常见的冰是冰-Ⅰ(如图c),0℃时密度为0.92g·cm-3,其中水分子的配位数为

(1)锰元素在周期表中的位置是
(2)硒常用作半导体,基态硒原子的价电子排布图为
(3)
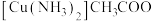 中碳原子的杂化类型是
中碳原子的杂化类型是 ;该反应中,肯定有
;该反应中,肯定有a.离子键 b.配位键 c.σ键 d.非极性键
(4)已知:
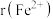 为62pm,
为62pm,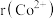 为66pm。在隔绝空气条件下分别加热FeCO3和CoCO3实验测得FeCO3的分解温度低于CoCO3,原因是
为66pm。在隔绝空气条件下分别加热FeCO3和CoCO3实验测得FeCO3的分解温度低于CoCO3,原因是 (5)某铁的氧化物晶胞如图所示:
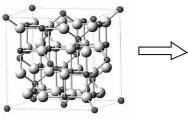
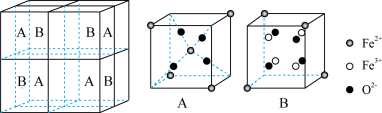
该晶胞可视为由A、B组成,则该氧化物与足量稀硝酸反应的化学方程式为
 ,该晶体的密度为
,该晶体的密度为 (用含a和
(用含a和 的代数式表示)。
的代数式表示)。
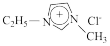 ,简称EMIC)混合形成的离子液体被认为是21世纪理想的绿色溶剂。请回答下列问题:
,简称EMIC)混合形成的离子液体被认为是21世纪理想的绿色溶剂。请回答下列问题:(1)请写出基态Ga原子的核外电子排布式
(2)EMIC阳离子中的几种元素电负性由大到小顺序为
(3)已知分子中的大π键可用符号π
 表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则EMIC中大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表大π键中的电子数,则EMIC中大π键可表示为(4)GaCl3熔点为77.8℃,GaF3熔点高于1000℃,其原因是
(5)GaCl3和EMIC混合形成离子液体的过程中会存在以下转变:GaCl3
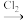 GaCl4
GaCl4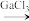 Ga2Cl7请写出Ga2Cl
Ga2Cl7请写出Ga2Cl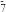 的结构式
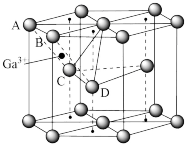
的结构式(6)某种Ga的氧化物晶胞结构如图所示。O2﹣以六方密堆积形成晶胞,Ga3+位于由A、C、D四个O2﹣围成的四边形的中心,但晶胞中只有的四边形中心位置占据了Ga3+,另外
 的位置空置。
的位置空置。①Ga3+位于O2﹣围成的
②该晶胞中O2﹣的配位数为
③若该晶胞的体积为Vcm3,该氧化物晶体密度为