2024高三下·全国·专题练习
解题方法
1 . 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运。通过氨热分解法制取氢气,其反应的化学方程式如下: 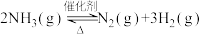
(1)根据下表数据,写出氨热分解法的热化学方程式___________ 。相关化学键的键能数据
(2)已知该反应的∆S=198.9×10-3kJ·mol-1·K-1,判断在300℃时反应是否能自发进行___________ (填“是”或“否”),理由是___________ 。
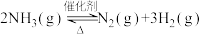
(1)根据下表数据,写出氨热分解法的热化学方程式
| 化学键 | N≡N | H-H | N-H |
| 键能E/(kJ·mol-1) | 946 | 436.0 | 390.8 |
您最近一年使用:0次
名校
2 . 硅单质及其化合物应用广泛。请回答下列问题:
(1) 是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是(用化学方程式表示)
是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是(用化学方程式表示)___________ 。
(2)硅单质可作为硅半导体材料。三氯甲硅烷( )还原法是当前制备高纯硅的主要方法,生产过程如图:
)还原法是当前制备高纯硅的主要方法,生产过程如图:
石英砂 粗硅
粗硅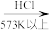
 (粗)
(粗)
 (纯)
(纯) 高纯硅
高纯硅
①写出制粗硅的化学方程式___________ 。
②整个制备过程必须严格控制无水无氧。 遇水剧烈反应生成
遇水剧烈反应生成 、HCl和一种气体单质,写出发生反应的化学方程式
、HCl和一种气体单质,写出发生反应的化学方程式___________ 。
(3)新型陶瓷材料氮化硅( )可应用于原子反应堆,一种制备氮化硅的反应为:
)可应用于原子反应堆,一种制备氮化硅的反应为:
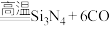 。若生成标准状况下33.6L CO时,反应过程中转移的电子数为
。若生成标准状况下33.6L CO时,反应过程中转移的电子数为___________ 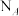 。
。
(1)
 是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是(用化学方程式表示)
是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是(用化学方程式表示)(2)硅单质可作为硅半导体材料。三氯甲硅烷(
 )还原法是当前制备高纯硅的主要方法,生产过程如图:
)还原法是当前制备高纯硅的主要方法,生产过程如图:石英砂
 粗硅
粗硅
 (粗)
(粗)
 (纯)
(纯) 高纯硅
高纯硅①写出制粗硅的化学方程式
②整个制备过程必须严格控制无水无氧。
 遇水剧烈反应生成
遇水剧烈反应生成 、HCl和一种气体单质,写出发生反应的化学方程式
、HCl和一种气体单质,写出发生反应的化学方程式(3)新型陶瓷材料氮化硅(
 )可应用于原子反应堆,一种制备氮化硅的反应为:
)可应用于原子反应堆,一种制备氮化硅的反应为:
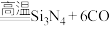 。若生成标准状况下33.6L CO时,反应过程中转移的电子数为
。若生成标准状况下33.6L CO时,反应过程中转移的电子数为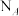 。
。
您最近一年使用:0次
2024-05-05更新
|
47次组卷
|
2卷引用:河北省衡水市枣强中学2023-2024学年高一下学期第二次调研考试化学试题
名校
解题方法
3 . 石油是一种非常重要的化石能源,主要是由各种烷烃、环烷烃和芳香烃组成的混合物。请回答下列问题:
(1)下列有机物中,属于烷烃的是___________ ,属于同分异构体的是___________ ,属于同一种物质的是___________ 。___________ 。
(3)写出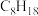 主链5个碳原子,且有4个甲基的烷烃的结构简式:
主链5个碳原子,且有4个甲基的烷烃的结构简式:___________ 。
(1)下列有机物中,属于烷烃的是
①四氯化碳 ② ③
③ ④
④ ⑤
⑤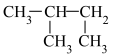 ⑥
⑥ 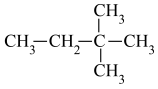 ⑦
⑦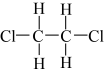 ⑧
⑧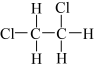
(3)写出
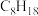 主链5个碳原子,且有4个甲基的烷烃的结构简式:
主链5个碳原子,且有4个甲基的烷烃的结构简式:
您最近一年使用:0次
名校
4 . 按要求回答下列问题:
(1)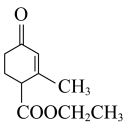 中含有的含氧官能团的名称为
中含有的含氧官能团的名称为___________ 。
(2)某有机物结构如图所示,下列说法正确的是___________ (填序号)。
③分子中C原子的杂化方式为 杂化 ④该分子是非极性分子
杂化 ④该分子是非极性分子
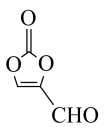
(3)TiO2是环境友好材料,能光催化降解有机物。纳米TiO2催化处理污水的一个实例如图所示。___________ ;化合物乙中有___________ 个手性碳原子。
(4)有A、B两种烃,已知:
( )B完全燃烧的产物
)B完全燃烧的产物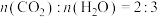 。
。
( )A是B分子中的氢原子全部被甲基取代后的产物;A遇
)A是B分子中的氢原子全部被甲基取代后的产物;A遇 的
的 溶液不褪色,其一氯代物只有一种。
溶液不褪色,其一氯代物只有一种。
①写出B与溴在光照下的反应方程式___________ (只写一取代)。
②A的结构简式为___________ ,系统命名为___________ 。
(1)
 中含有的含氧官能团的名称为
中含有的含氧官能团的名称为(2)某有机物结构如图所示,下列说法正确的是
③分子中C原子的杂化方式为
 杂化 ④该分子是非极性分子
杂化 ④该分子是非极性分子(3)TiO2是环境友好材料,能光催化降解有机物。纳米TiO2催化处理污水的一个实例如图所示。

(4)有A、B两种烃,已知:
(
 )B完全燃烧的产物
)B完全燃烧的产物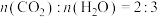 。
。(
 )A是B分子中的氢原子全部被甲基取代后的产物;A遇
)A是B分子中的氢原子全部被甲基取代后的产物;A遇 的
的 溶液不褪色,其一氯代物只有一种。
溶液不褪色,其一氯代物只有一种。①写出B与溴在光照下的反应方程式
②A的结构简式为
您最近一年使用:0次
名校
5 . 某化学小组选用酸性高锰酸钾溶液和草酸( )溶液,探究外界条件对化学反应速率的影响,进行了如下了三组实验:
)溶液,探究外界条件对化学反应速率的影响,进行了如下了三组实验:
(1)实验原理的离子方程式:____________ 。
(2)实验2中的
______ ,目的是____________ 。
(3)根据上表中的实验数据,可以得到的结论是____________ 。
(4)利用实验1中数据计算,用 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为
______ mol/(L⋅min)。
 )溶液,探究外界条件对化学反应速率的影响,进行了如下了三组实验:
)溶液,探究外界条件对化学反应速率的影响,进行了如下了三组实验:实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
a mol/L |
| 0.05 mol/L | 3 mol/L稀硫酸 | ||
1 | 3.0 | 1.0 | 4.0 | 2.0 | 4.0 |
2 | 2.0 | v | 4.0 | 2.0 | 5.2 |
3 | 1.0 | 3.0 | 4.0 | 2.0 | 6.4 |
(2)实验2中的

(3)根据上表中的实验数据,可以得到的结论是
(4)利用实验1中数据计算,用
 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为
您最近一年使用:0次
2024-05-04更新
|
181次组卷
|
2卷引用:北京交大附中2023-2024学年高一下学期期中考试化学试题
名校
6 . 化学反应同时伴随着能量变化,是人类获取能量的重要途径。以下是常见的化学反应。
a.镁与盐酸反应;b.氢氧化钠与盐酸反应;c.盐酸与碳酸氢钠反应;d.Ba(OH)2·8H2O晶体与NH4Cl晶体反应
(1)反应d的化学方程式是___________ 。
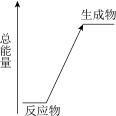
(2)以上化学反应中能用下图表示其能量变化的是___________ (填字母),此类反应中有能量变化的原因是:断开反应物的化学键吸收的总能量___________ (填“>”或“<”)形成生成物的化学键释放的总能量。
①将下图原电池装置补充完整。___________ ___________ 。
③正极的电极反应式是___________ 。
a.镁与盐酸反应;b.氢氧化钠与盐酸反应;c.盐酸与碳酸氢钠反应;d.Ba(OH)2·8H2O晶体与NH4Cl晶体反应
(1)反应d的化学方程式是
(2)以上化学反应中能用下图表示其能量变化的是
①将下图原电池装置补充完整。
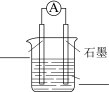
③正极的电极反应式是
您最近一年使用:0次
2024-05-04更新
|
80次组卷
|
2卷引用:北京市陈经纶中学2023-2024学年高一下学期期中诊断化学试卷
2024高三下·全国·专题练习
解题方法
7 . 黄铁矿[主要成分为二硫化亚铁(FeS2)]、焦炭和适量空气混合加热发生如下反应:
i.3FeS2+2C+3O2=3S2+Fe3O4+2CO
(1)反应i生成1molS2时,转移电子的物质的量为___________ mol。
(2)反应i所得气体经冷凝回收S2后,尾气中还含有CO和SO2.将尾气通过催化剂进行处理,发生反应ii,同时发生副反应iii。
ii.2SO2(g)+4CO(g) S2(g)+4CO2(g) ΔH<0
S2(g)+4CO2(g) ΔH<0
iii.SO2(g)+3CO(g) COS(g)+2CO2(g) ΔH<0
COS(g)+2CO2(g) ΔH<0
理论分析及实验结果表明,600~1000K范围内,SO2平衡转化率接近100%。其他条件相同,不同温度下,S2、COS平衡产率和10min时S2实际产率如图。___________ 。
②随温度升高,S2平衡产率上升,推测其原因是___________ 。
③900K,在10min后继续反应足够长时间,推测S2实际产率的变化趋势可能为___________ 。
i.3FeS2+2C+3O2=3S2+Fe3O4+2CO
(1)反应i生成1molS2时,转移电子的物质的量为
(2)反应i所得气体经冷凝回收S2后,尾气中还含有CO和SO2.将尾气通过催化剂进行处理,发生反应ii,同时发生副反应iii。
ii.2SO2(g)+4CO(g)
 S2(g)+4CO2(g) ΔH<0
S2(g)+4CO2(g) ΔH<0iii.SO2(g)+3CO(g)
 COS(g)+2CO2(g) ΔH<0
COS(g)+2CO2(g) ΔH<0理论分析及实验结果表明,600~1000K范围内,SO2平衡转化率接近100%。其他条件相同,不同温度下,S2、COS平衡产率和10min时S2实际产率如图。
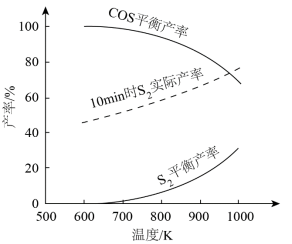
②随温度升高,S2平衡产率上升,推测其原因是
③900K,在10min后继续反应足够长时间,推测S2实际产率的变化趋势可能为
您最近一年使用:0次
2024高三下·全国·专题练习
8 . 碳和氮的化合物在生产生活中广泛存在。低碳烃类(甲烷、乙烯、丙烯等)作为重要的基本化工原料,在现代石油和化学工业中具有举足轻重的作用。
一定条件下,碘甲烷 热裂解制低碳烯烃的主要反应有:
热裂解制低碳烯烃的主要反应有:
反应①: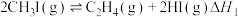
反应②: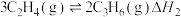
反应①和②在不同温度下的分压平衡常数 如下表,回答下列问题:
如下表,回答下列问题:
(1)根据表中数据推出反应①的活化能 (正)
(正)___________ (填“>”或“<”) (逆);
(逆);
(2)反应②的正、逆反应速率表达式有: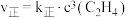 ,
,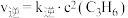 (
( 、
、 为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式:
为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式: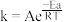 [k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越
[k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越___________ (填“大”或“小”)。当该反应达到平衡后,升高温度,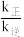 的值
的值___________ (填“增大”“减小”或“不变”);
一定条件下,碘甲烷
 热裂解制低碳烯烃的主要反应有:
热裂解制低碳烯烃的主要反应有:反应①:
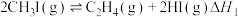
反应②:
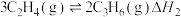
反应①和②在不同温度下的分压平衡常数
 如下表,回答下列问题:
如下表,回答下列问题: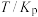 |  |  |  |  |  |  |
| 反应① | 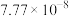 | 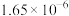 | 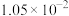 | 2.80 |  | 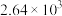 |
| 反应② | 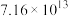 | 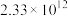 | 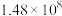 | 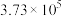 | 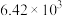 | 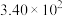 |
(1)根据表中数据推出反应①的活化能
 (正)
(正) (逆);
(逆);(2)反应②的正、逆反应速率表达式有:
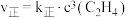 ,
,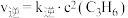 (
( 、
、 为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式:
为反应速率常数,只与温度有关)。1889年,瑞典物理化学家阿仑尼乌斯根据实验结果,提出了速率常数与温度关系的经验公式: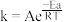 [k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越
[k为速率常数;A为常数;e为自然对数的底数]。在相同温度下,活化能越大,速率常数越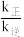 的值
的值
您最近一年使用:0次
2024高三下·全国·专题练习
9 . 将二氧化碳资源化是实现“碳中和”目标的重要手段。回答下列问题:
利用 和重整技术可获得合成气(主要成分为CO和
和重整技术可获得合成气(主要成分为CO和 ),反应如下:
),反应如下:
I:

Ⅱ:
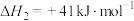
反应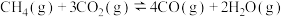 的
的
___________  ,该反应活化能
,该反应活化能 (正)
(正)___________  (逆)(填“>”“<”或“=”)。
(逆)(填“>”“<”或“=”)。
利用
 和重整技术可获得合成气(主要成分为CO和
和重整技术可获得合成气(主要成分为CO和 ),反应如下:
),反应如下:I:


Ⅱ:

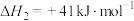
反应
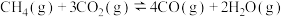 的
的
 ,该反应活化能
,该反应活化能 (正)
(正) (逆)(填“>”“<”或“=”)。
(逆)(填“>”“<”或“=”)。
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
10 . 化学需氧量(COD)是指用强氧化剂将1 L废水中的还原性物质氧化为二氧化碳和水所消耗的氧化剂的量,并换算成以O2为氧化剂时所消耗O2的质量。水体COD值常作为水体中有机污染物相对含量的综合指标之一,Fenton(Fe2+/H2O2)法能产生Fe3+和具有强氧化性的羟基自由基(·OH)引发一系列链式反应,被广泛应用于有机废水的治理。
(1)羟基自由基(·OH)的电子式为___________ 。
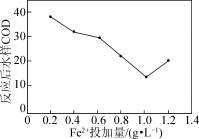
(2)分别取初始pH=4、COD=80的废水200 mL,加入200 mL H2O2,改变起始投加FeSO4·7H2O的量,反应相同时间。测得反应后水样COD随Fe2+投加量的关系如图所示。当Fe2+投加量超过1 g·L-1时,反应后水样COD不降反升的原因可能是___________ 。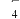 )的氧化技术引起关注。研究发现,一种Mn3O4石墨烯纳米复合材料对催化活化S2O
)的氧化技术引起关注。研究发现,一种Mn3O4石墨烯纳米复合材料对催化活化S2O 产生SO
产生SO 具有很好的效果。S2O
具有很好的效果。S2O 结构如图所示。
结构如图所示。 的使用范围更广。SO
的使用范围更广。SO 在强碱性条件下反应生成·OH,写出该反应的离子方程式:
在强碱性条件下反应生成·OH,写出该反应的离子方程式:___________ 。
② 一种制取Mn3O4—石墨烯纳米复合材料的物种转化关系可表示如下(GO表示石墨烯):___________ mol。
③利用该复合材料催化活化S2O 并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为
并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为___________ 。
(1)羟基自由基(·OH)的电子式为
(2)分别取初始pH=4、COD=80的废水200 mL,加入200 mL H2O2,改变起始投加FeSO4·7H2O的量,反应相同时间。测得反应后水样COD随Fe2+投加量的关系如图所示。当Fe2+投加量超过1 g·L-1时,反应后水样COD不降反升的原因可能是
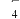 )的氧化技术引起关注。研究发现,一种Mn3O4石墨烯纳米复合材料对催化活化S2O
)的氧化技术引起关注。研究发现,一种Mn3O4石墨烯纳米复合材料对催化活化S2O 产生SO
产生SO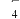 具有很好的效果。S2O
具有很好的效果。S2O 结构如图所示。
结构如图所示。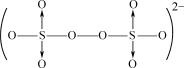
 的使用范围更广。SO
的使用范围更广。SO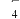 在强碱性条件下反应生成·OH,写出该反应的离子方程式:
在强碱性条件下反应生成·OH,写出该反应的离子方程式:② 一种制取Mn3O4—石墨烯纳米复合材料的物种转化关系可表示如下(GO表示石墨烯):
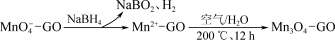
③利用该复合材料催化活化S2O
 并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为
并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为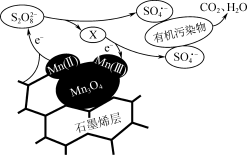
您最近一年使用:0次




