名校
解题方法
1 . 硫氰酸钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品,常用于合成树脂、杀虫杀菌剂等。某化学小组用下图实验装置模拟工业制备硫氰酸钾,并进行相关实验探究。

已知:①NH3不溶于CCl4和CS2 ,CS2不溶于水且密度比水大;
②D中三颈烧瓶内盛放CS2、水和催化剂,发生反应 ,该反应比较缓慢且NH4SCN在高于170℃时易分解,NH4HS在高于25℃时即分解生成NH3和H2S。
,该反应比较缓慢且NH4SCN在高于170℃时易分解,NH4HS在高于25℃时即分解生成NH3和H2S。
③KSCN的溶解度随温度变化较大。
回答下列问题:
(1)试剂a是_______ ,装置D中盛装KOH溶液的仪器名称是_______ 。
(2)制备KSCN溶液:将D中反应混合液加热至105℃,打开K1通入氨气。
①反应一段时间后,关闭K1,此时装置C中观察到的现象是_______ ,保持三颈烧瓶内反应混合液温度为105℃一段时间,这样操作的目的是_______ 。
②打开K2,缓缓滴入适量的KOH溶液,继续保持反应混合液温度为105℃。
(3)装置E的作用是吸收尾气,防止污染环境。写出吸收氨气转化为无污染气体的离子方程式是_______ 。
(4)制备硫氰酸钾晶体:先滤去三颈烧瓶中的固体催化剂,再经_______ (填操作名称)、最后对所得溶液进行减压蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰酸钾晶体。
(5)晶体中KSCN含量的测定:称取10.0g样品,配成1000mL溶液。量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液18.00mL。[已知:滴定时发生的反应为SCN- + Ag+ = AgSCN↓(白色)]
①指示剂a为_______ 。
②晶体中KSCN的质量分数为_______ %。

已知:①NH3不溶于CCl4和CS2 ,CS2不溶于水且密度比水大;
②D中三颈烧瓶内盛放CS2、水和催化剂,发生反应
 ,该反应比较缓慢且NH4SCN在高于170℃时易分解,NH4HS在高于25℃时即分解生成NH3和H2S。
,该反应比较缓慢且NH4SCN在高于170℃时易分解,NH4HS在高于25℃时即分解生成NH3和H2S。③KSCN的溶解度随温度变化较大。
回答下列问题:
(1)试剂a是
(2)制备KSCN溶液:将D中反应混合液加热至105℃,打开K1通入氨气。
①反应一段时间后,关闭K1,此时装置C中观察到的现象是
②打开K2,缓缓滴入适量的KOH溶液,继续保持反应混合液温度为105℃。
(3)装置E的作用是吸收尾气,防止污染环境。写出吸收氨气转化为无污染气体的离子方程式是
(4)制备硫氰酸钾晶体:先滤去三颈烧瓶中的固体催化剂,再经
(5)晶体中KSCN含量的测定:称取10.0g样品,配成1000mL溶液。量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液18.00mL。[已知:滴定时发生的反应为SCN- + Ag+ = AgSCN↓(白色)]
①指示剂a为
②晶体中KSCN的质量分数为
您最近一年使用:0次
名校
2 . 纯碱在生产、生活中有广泛应用。例如可用足量的纯碱溶液吸收含氯气的尾气,生成三种盐(反应1);工业上从海水中提取溴的流程中也用到了纯碱溶液,其主要原理如下:反应2: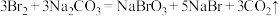 。下列说法正确的是
。下列说法正确的是
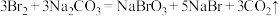 。下列说法正确的是
。下列说法正确的是| A.反应2中氧化产物与还原产物的质量之比为1∶5 |
| B.标准状况下,22.4L溴单质中含有2mol溴原子 |
| C.反应1中生成的三种盐是NaClO,NaClO3和NaHCO3 |
| D.反应2中的Br2与反应1中的Cl2表现出了相似的化学性质 |
您最近一年使用:0次
名校
解题方法
3 . 物质集合M中含有常见物质Na2O2、NaHCO3、Al、SO2、Fe、NH3、Na、F2。这些物质按照以下方法进行分类后如图所示,请按照要求回答问题。
(1)B组物质中属于非电解质的物质为____ ,其中能作制冷剂的物质的电子式为____ 。
(2)C组物质中能与水反应生成还原性气体的化学方程式为____ 。
(3)D组物质中其中一种物质可以制备出另外一种物质,请写出一种该反应在工业上的应用:____ 。
(4)请写出F组中的酸性氧化物与酸性KMnO4溶液反应的离子方程式:____ 。
(5)在密闭容器中,将E组中的两种物质加热反应,若混合物中金属原子与氧原子的物质的量之比为1:2,混合加热充分反应后,排出气体,剩余固体的成分为____ ;反应中氧化剂与还原剂的物质的量之比为____ 。

(1)B组物质中属于非电解质的物质为
(2)C组物质中能与水反应生成还原性气体的化学方程式为
(3)D组物质中其中一种物质可以制备出另外一种物质,请写出一种该反应在工业上的应用:
(4)请写出F组中的酸性氧化物与酸性KMnO4溶液反应的离子方程式:
(5)在密闭容器中,将E组中的两种物质加热反应,若混合物中金属原子与氧原子的物质的量之比为1:2,混合加热充分反应后,排出气体,剩余固体的成分为
您最近一年使用:0次
2022-09-23更新
|
599次组卷
|
2卷引用:宁夏石嘴山市平罗中学2022-2023学年高三上学期期中考试(重点班)化学试题
名校
解题方法
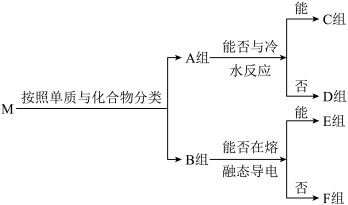
4 . 物质之间的转化关系如图,部分生成物省略。A是由四种元素组成的化合物。C、D是由元素X、Y、Z中两种组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用。
请回答下列问题:
(1)C的电子式____ 。
(2)写出反应①的离子反应方程式____ ,反应②中体现葡萄糖的____ 性。
(3)比较Y与Z的原子半径大小_____>_____(填写元素符号)。____
(4)写出A的化学式____ 。
(5)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体;请写出该反应的化学方程式____ 。
(6)研究表明:气体D在480℃、800大气压条件下可被活泼金属钠还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出该反应的化学方程式____ ,N的一种同素异形体的名称为____ 。

请回答下列问题:
(1)C的电子式
(2)写出反应①的离子反应方程式
(3)比较Y与Z的原子半径大小_____>_____(填写元素符号)。
(4)写出A的化学式
(5)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体;请写出该反应的化学方程式
(6)研究表明:气体D在480℃、800大气压条件下可被活泼金属钠还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出该反应的化学方程式
您最近一年使用:0次
2022-09-20更新
|
343次组卷
|
5卷引用:宁夏固原市第一中学2023届高三上学期第二次月考化学试题
名校
5 . 氧化还原反应在工业生产、环保及科研中有广泛的应用。氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50 ℃时反应可生成它。CuH具有的性质有:不稳定,易分解,在氯气中能燃烧;与稀盐酸反应能生成气体,Cu+在酸性条件下发生的反应是2Cu+=Cu2++Cu。
(1)写出CuH在氯气中燃烧的化学反应方程式:_______ 。
(2)CuH溶解在稀盐酸中反应的离子化学方程式是_______ 。
(3)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:_______ 。
(1)写出CuH在氯气中燃烧的化学反应方程式:
(2)CuH溶解在稀盐酸中反应的离子化学方程式是
(3)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:
您最近一年使用:0次
名校
6 . 由软锰矿(主要成分为MnO2)制备KMnO4的实验流程可表示如下:
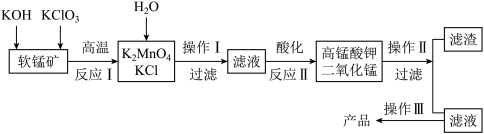
(1)实验时,首先将软锰矿研细,然后和KOH、 KClO3混合高温发生反应I,将软锰矿研细的目的是_______ 。
(2)反应I发生反应的化学方程式是_______ ,该反应中氧化剂是_______ ;反应II发生反应的离子方程式是_______ 。
(3)操作III的实验步骤为_______ 、_______ 、过滤;可循环利用的物质的化学式为_______ 。
(4)取制得的产品6.5g,配成250mL溶液;准确称取纯1.34gNa2C2O4配成适量溶液。用上述KMnO4溶液滴定Na2C2O4溶液,恰好反应(氧化产物为CO2,还原产物为Mn2+)时,消耗KMnO4溶液的体积为25.00mL。该KMnO4的纯度为_______ (保留小数点后一位)。

(1)实验时,首先将软锰矿研细,然后和KOH、 KClO3混合高温发生反应I,将软锰矿研细的目的是
(2)反应I发生反应的化学方程式是
(3)操作III的实验步骤为
(4)取制得的产品6.5g,配成250mL溶液;准确称取纯1.34gNa2C2O4配成适量溶液。用上述KMnO4溶液滴定Na2C2O4溶液,恰好反应(氧化产物为CO2,还原产物为Mn2+)时,消耗KMnO4溶液的体积为25.00mL。该KMnO4的纯度为
您最近一年使用:0次
名校
7 . 下列离子方程式中,不 正确的是
A.向NaHCO3溶液中加入过量的NaOH溶液: +OH-= +OH-= +H2O +H2O |
| B.稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑ |
| C.FeBr2溶液中通入过量的Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
D.向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++ =3Fe3++NO↑+2H2O =3Fe3++NO↑+2H2O |
您最近一年使用:0次
2022-09-14更新
|
244次组卷
|
2卷引用:宁夏固原市第一中学2023届高三上学期第一次月考化学试题
名校
解题方法
8 . 某同学在实验室欲配制物质的量浓度均为1.0mol·L-1的NaOH溶液、稀硫酸各450mL。提供的试剂是:NaOH固体、18.4mol·L-1的浓硫酸(密度为1.84g·cm-3)和蒸馏水。
(1)请你观察图示判断其中不正确的操作有_______ 。(填序号)
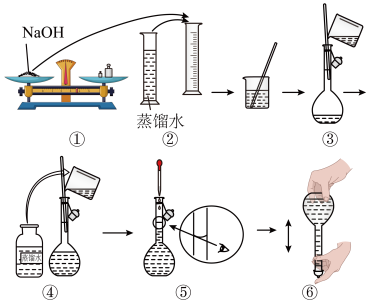
(2)应用托盘天平称量NaOH_______ g,应用量筒量取浓硫酸_______ mL。
(3)在配制上述溶液实验中,下列操作引起结果偏低的有_______ 。
A.该学生在量取浓硫酸时,仰视刻度线
B.溶解硫酸后没有冷却至室温就立即完成后面的配制操作
C.在烧杯中溶解搅拌时,溅出少量溶液
D.没有用蒸馏水洗涤烧杯2~3次,并将洗涤液移入容量瓶中
E.将量筒洗涤2~3次,并全部转移至容量瓶中
F.容量瓶中原来存有少量蒸馏水
G.胶头滴管加水定容时俯视刻度线
(4)若用0.01000mol·L-1K2Cr2O7(酸性)溶液滴定20.00mL未知浓度的含Fe2+的溶液,恰好完全反应时消10.00mLK2Cr2O7溶液,写出该反应的离子反应方程式_______ ,待测液中Fe2+的浓度是_______ g/L(保留4位有效数字)。
(1)请你观察图示判断其中不正确的操作有

(2)应用托盘天平称量NaOH
(3)在配制上述溶液实验中,下列操作引起结果偏低的有
A.该学生在量取浓硫酸时,仰视刻度线
B.溶解硫酸后没有冷却至室温就立即完成后面的配制操作
C.在烧杯中溶解搅拌时,溅出少量溶液
D.没有用蒸馏水洗涤烧杯2~3次,并将洗涤液移入容量瓶中
E.将量筒洗涤2~3次,并全部转移至容量瓶中
F.容量瓶中原来存有少量蒸馏水
G.胶头滴管加水定容时俯视刻度线
(4)若用0.01000mol·L-1K2Cr2O7(酸性)溶液滴定20.00mL未知浓度的含Fe2+的溶液,恰好完全反应时消10.00mLK2Cr2O7溶液,写出该反应的离子反应方程式
您最近一年使用:0次
2022-08-30更新
|
324次组卷
|
2卷引用:宁夏回族自治区银川一中2022-2023学年高三上学期第一次月考理科综合化学试题
名校
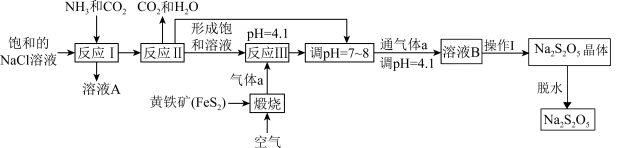
9 . 焦亚硫酸钠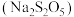 在医药、橡胶、印染、食品等方面应用广泛,其制备流程如图所示。
在医药、橡胶、印染、食品等方面应用广泛,其制备流程如图所示。
已知:① 过饱和溶液中更易形成
过饱和溶液中更易形成 ;
;
②焦亚硫酸钠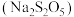 在空气中易氧化,受热易分解。
在空气中易氧化,受热易分解。
回答下列问题:
(1)反应I中先通入气体____ (填化学式),反应III中通入的气体a为_____ (填化学式)。
(2)溶液A中含有三种阳离子,分别为 、
、 和离子X。检验溶液A中离子X的方法是
和离子X。检验溶液A中离子X的方法是_______ 。
(3)反应III调节pH为4.1,发生反应的离子方程式为_______ 。
(4)再次通入气体a得到溶液B的目的是_______ 。
(5)操作I为:在氮气氛围中,_______ ,_______ ,过滤,洗涤。其中洗涤 晶体时依次用饱和
晶体时依次用饱和 水溶液、无水乙醇。用饱和
水溶液、无水乙醇。用饱和 水溶液洗涤的目的是
水溶液洗涤的目的是_______ 。
(6)久置的 固体中若含有
固体中若含有 杂质,其可能的原因是
杂质,其可能的原因是_______ 。(用化学反应方程式表示)
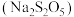 在医药、橡胶、印染、食品等方面应用广泛,其制备流程如图所示。
在医药、橡胶、印染、食品等方面应用广泛,其制备流程如图所示。
已知:①
 过饱和溶液中更易形成
过饱和溶液中更易形成 ;
;②焦亚硫酸钠
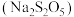 在空气中易氧化,受热易分解。
在空气中易氧化,受热易分解。回答下列问题:
(1)反应I中先通入气体
(2)溶液A中含有三种阳离子,分别为
 、
、 和离子X。检验溶液A中离子X的方法是
和离子X。检验溶液A中离子X的方法是(3)反应III调节pH为4.1,发生反应的离子方程式为
(4)再次通入气体a得到溶液B的目的是
(5)操作I为:在氮气氛围中,
 晶体时依次用饱和
晶体时依次用饱和 水溶液、无水乙醇。用饱和
水溶液、无水乙醇。用饱和 水溶液洗涤的目的是
水溶液洗涤的目的是(6)久置的
 固体中若含有
固体中若含有 杂质,其可能的原因是
杂质,其可能的原因是
您最近一年使用:0次
2022-08-26更新
|
298次组卷
|
2卷引用:宁夏石嘴山市平罗中学2022-2023学年高三上学期11月期中考试化学试题
名校
解题方法
10 . 如图两圆相交部分A、B、C、D分别表示两物质间的反应。下列各对应反应的离子方程式书写不正确的是
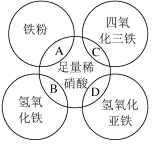

A.Fe+4H++ =Fe3++NO↑+2H2O =Fe3++NO↑+2H2O |
| B.Fe3O4+8H+=Fe2++2Fe3++4H2O |
| C.Fe(OH)3+3H+=Fe3++3H2O |
D.3Fe(OH)2+10H++ =3Fe3++NO↑+8H2O =3Fe3++NO↑+8H2O |
您最近一年使用:0次
2022-08-24更新
|
128次组卷
|
14卷引用:宁夏石嘴山市平罗中学2022-2023学年高三上学期11月期中考试化学试题
宁夏石嘴山市平罗中学2022-2023学年高三上学期11月期中考试化学试题山东省济南市第一中学2017届高三10月阶段测试化学试题陕西省西安市第一中学2018届高三第三次月考化学试题(已下线)【艺体生百日捷进提升系列-技能方法】专题3.07 离子反应方面试题的解题方法与技巧(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第3讲 铁及其化合物【押题专练】(已下线)2019年8月2日 《每日一题》2020年一轮复习-“铁三角”及其应用(已下线)考点05 典型金属元素及其化合物——《备战2020年高考精选考点专项突破题集》福建省南安第一中学2020届高三上学期第二次月考化学试题2020届高三《新题速递·化学》1月第01期(考点01-06)湖南省岳阳市平江县第一中学2020-2021学年高二上学期10月联考化学试题(已下线)新人教必修1第3章第一节第2课时铁的氧化物和氢氧化物(课中)云南省普洱市第一中学2021-2022学年高三下学期3月份考试理综化学试题黑龙江省牡丹江市第三高级中学2022-2023学年高三上学期第一次月考化学试题(已下线)BBWYhjhx1006.pdf



