名校
解题方法
1 . I.亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:

(1)反应①阶段,参加反应的NaClO3和SO2的物质的量之比为___________
(2)若反应①通过原电池来实现,则ClO2是___________ 极产物
(3)反应②中的H2O2___________ 用NaClO4代替(填能或不能)
(4)写出反应②的离子方程式___________
II.聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
(5)将一定量的FeSO4·7H2O溶于稀硫酸,在约70℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为___________ ;水解聚合反应会导致溶液的pH___________ 。
(6)测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000g,置于250mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×10-2mol·L-1K2Cr2O7溶液滴定至终点(滴定过程中 与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。
与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。
①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将__ (填“偏大”“偏小”或“无影响”)。
②计算该样品中铁的质量分数_____ (写出计算过程)。

(1)反应①阶段,参加反应的NaClO3和SO2的物质的量之比为
(2)若反应①通过原电池来实现,则ClO2是
(3)反应②中的H2O2
(4)写出反应②的离子方程式
II.聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
(5)将一定量的FeSO4·7H2O溶于稀硫酸,在约70℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为
(6)测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000g,置于250mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×10-2mol·L-1K2Cr2O7溶液滴定至终点(滴定过程中
 与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。
与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00mL。①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将
②计算该样品中铁的质量分数
您最近一年使用:0次
名校
解题方法
2 . R、W、X、Y、Z是原子序数依次增大的短周期主族元素。R的最外层电子数是内层电子数的两倍,X2W2可用于呼吸面具,Y的主族序数与周期数相等,Z的氢化物的分子式为H2Z。
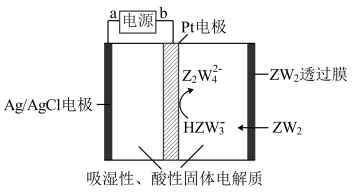
(1)Z在周期表中的位置是______ 。
(2)RZ2的结构式是______ ,X2Z2的电子式是______ 。
(3)H2ZW3在水中电离的方程式为__________________ ,向H2ZW3水溶液滴入少量酸性高锰酸钾溶液,发生反应的离子方程式为__________________ 。
(4)某传感器可以检测空气中ZW2的含量,工作原理如图所示。则电流流向为____________ 时针方向(填“顺”或“逆”),其阴极电极反应式________________________ 。

(1)Z在周期表中的位置是
(2)RZ2的结构式是
(3)H2ZW3在水中电离的方程式为
(4)某传感器可以检测空气中ZW2的含量,工作原理如图所示。则电流流向为
您最近一年使用:0次
名校
解题方法
3 . 绿水青山是习近平总书记构建美丽中国的伟大构想,某工厂拟综合处理含 废水和工业废气(主要含
废水和工业废气(主要含 、
、 、
、 、
、 、
、 ,不考虑其他成分),设计了如下流程:
,不考虑其他成分),设计了如下流程:
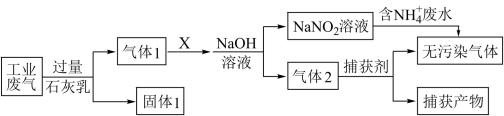
下列说法正确的是
 废水和工业废气(主要含
废水和工业废气(主要含 、
、 、
、 、
、 、
、 ,不考虑其他成分),设计了如下流程:
,不考虑其他成分),设计了如下流程:
下列说法正确的是
A.固体1的成分为 、 、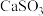 |
| B.X可以是空气 |
C.捕获剂所捕获的气体主要是 |
D.处理含 废水时,发生的反应为 废水时,发生的反应为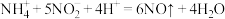 |
您最近一年使用:0次
2021-11-21更新
|
317次组卷
|
3卷引用:宁夏石嘴山市第三中学2021-2022学年高三上学期第二次月考化学试题
宁夏石嘴山市第三中学2021-2022学年高三上学期第二次月考化学试题吉林省东北师范大学附属中学2021-2022学年高三上学期第二次摸底考试化学试题(已下线)3.3 氮的循环-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)
4 . 下列反应的离子反应方程式正确的是
A.二氧化碳通入饱和碳酸钠溶液中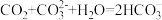 |
B.氯气通入冷的氢氧化钠溶液中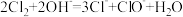 |
C.硫酸亚铁溶液中加入过氧化氢溶液 |
D. 使酸性 使酸性 溶液褪色: 溶液褪色: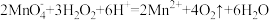 |
您最近一年使用:0次
2021-11-19更新
|
116次组卷
|
2卷引用:宁夏银川市景博中学2021-2022学年高三上学期第二次月考化学试题
5 . 高锰酸钾是一种强氧化剂,为紫黑色、细长的棱形结晶或颗粒,带蓝色的金属光泽,可溶于水。根据所学知识,回答下列问题:
(1)酸性条件下,高锰酸钾可与草酸( )溶液发生反应,其反应为
)溶液发生反应,其反应为 。
。
①补上产物,配平化学方程式___________ 。
②上述反应中 表现的性质有
表现的性质有___________ 。
(2)若将 通入硫酸酸化的
通入硫酸酸化的 溶液中,溶液褪色,生成
溶液中,溶液褪色,生成 ,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:
,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:___________ ,该反应中作还原剂的是___________ (填化学式)。
(3)高锰酸钾还可与浓盐酸反应,写出其化学方程式___________ ,其中浓盐酸表现酸性与还原性的物质的量之比为:___________ 。
(1)酸性条件下,高锰酸钾可与草酸(
 )溶液发生反应,其反应为
)溶液发生反应,其反应为 。
。①补上产物,配平化学方程式
②上述反应中
 表现的性质有
表现的性质有(2)若将
 通入硫酸酸化的
通入硫酸酸化的 溶液中,溶液褪色,生成
溶液中,溶液褪色,生成 ,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:
,此时溶液中仅有一种阴离子。写出发生反应的离子方程式:(3)高锰酸钾还可与浓盐酸反应,写出其化学方程式
您最近一年使用:0次
名校
6 . 工业上冶炼锡的第一步反应原理为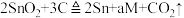 。下列说法中错误的是
。下列说法中错误的是
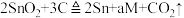 。下列说法中错误的是
。下列说法中错误的是A.该反应中 被还原 被还原 |
| B.a的值为3 |
| C.反应后有两种氧化产物 |
D.每生成1个 转移的电子数为8 转移的电子数为8 |
您最近一年使用:0次
2021-11-14更新
|
259次组卷
|
11卷引用:宁夏青铜峡市高级中学2021-2022学年高一上学期11月测试化学试题
宁夏青铜峡市高级中学2021-2022学年高一上学期11月测试化学试题吉林省榆树一中2017-2018学年高一上学期期中考试化学试题广东省韶关市2017-2018学年高一化学上学期期中试题内蒙古通辽实验中学2017-2018学年高一上学期期末考试化学试题山西省灵丘县一中2017-2018学年高一上学期期中考试化学试卷云南省峨山彝族自治县第一中学2019-2020学年高一上学期期中考试化学试题云南省玉溪市华宁二中2019-2020学年高一上学期期中考试化学试题广东省八校2021-2022学年高一上学期期中调研考试 化学试题 河南省安阳县高级中学2021-2022学年高一上学期期中考试化学试题安徽师范大学附属中学2022-2023学年高一上学期10月选科诊断测试化学试题江苏省南京市第二十九中学2022-2023学年高一上学期10月月考化学试题
7 . 水体中过量氨氮(以NH3表示)或总氮(溶液中所有可溶性的含氮化合物中氮元素总量)含量过高会导致水体富营养化。用次氯酸钠除去氨氮的一种原理如下图所示,下列说法正确的是
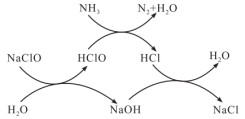

| A.NaClO除去氨氮的总反应化学方程式2NH3+3NaClO=N2+3NaCl+3H2O |
| B.整个过程中发生的反应都是氧化还原反应 |
| C.在较高温度下,氨氮去除率会升高 |
| D.NaClO投入过多,总氮去除率可能会升高 |
您最近一年使用:0次
2021-11-01更新
|
141次组卷
|
2卷引用:宁夏北方民族大学附属中学2022-2023学年高三上学期月考(一)理科综合化学试题
名校
8 . 现有下列10种物质:①铝,②纯醋酸,③CO2,④H2SO4,⑤Ba(OH)2,⑥红褐色的氢氧化铁胶体,⑦稀盐酸,⑧NaHSO4,⑨碳酸钙,⑩乙醇,请按要求书写离子方程式或化学方程式,
(1)上述物质中属于电解质的有_______ ,属于非电解质的有_______ ,既不属于电解质也不属于非电解质的有_______ (填序号)。
(2)写出⑧在水中的电离方程式为_______ 。
(3)向沸水中逐滴加入饱和FeCl3溶液,至液体呈透明的红褐色,写出化学方程式_______ 。
(4)已知酸性环境下,ClO-可将Mn2+氧化成MnO2,自身被还原成Cl-,该过程的离子反应方程式为_______ 。
(5)在酸性条件下,向含铬废水中加入FeSO4溶液,可将Cr2O 还原为Cr3+,该过程的离子方程式为
还原为Cr3+,该过程的离子方程式为_______ 。
(1)上述物质中属于电解质的有
(2)写出⑧在水中的电离方程式为
(3)向沸水中逐滴加入饱和FeCl3溶液,至液体呈透明的红褐色,写出化学方程式
(4)已知酸性环境下,ClO-可将Mn2+氧化成MnO2,自身被还原成Cl-,该过程的离子反应方程式为
(5)在酸性条件下,向含铬废水中加入FeSO4溶液,可将Cr2O
 还原为Cr3+,该过程的离子方程式为
还原为Cr3+,该过程的离子方程式为
您最近一年使用:0次
2021-10-29更新
|
212次组卷
|
2卷引用:宁夏吴忠中学2021-2022学年高三上学期线上教学测试化学试题
名校
解题方法
9 . 交警通常用一种“酒精检测仪”检查司机呼出气体中的酒精含量,其反应原理为C2H5OH+4CrO3+6H2SO4=2R+2CO2↑+9H2O,反应中红色的CrO3转变为绿色的化合物R,则R的化学式应为
| A.Cr2O3 | B.CrSO3 | C.Cr2(SO4)3 | D.CrS |
您最近一年使用:0次
2021-10-11更新
|
110次组卷
|
2卷引用:宁夏银川唐徕回民中学2021-2022学年高一10月月考化学试题
名校
10 . Ⅰ.磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2)为主要原料制备碳酸锰的主要工艺流程如下:

回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采用的措施为_______ (写一条即可)
(2)溶浸过程中主要产生的离子为Fe3+、Mn2+、 ,请写出主要反应的离子方程式
,请写出主要反应的离子方程式_______ 。
(3)溶浸后的溶液中含有少量Fe2+、Cu2+、Ca2+,则“氧化除铁”过程中加入适量的软锰矿的目的是_______ 。
(4)“净化”工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要成分是_______ (填化学式)和CaF2
(5)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是_______ 。
Ⅱ.工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如如图所示:
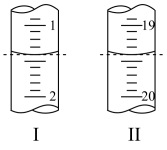
(6)消耗Na2S2O3标准溶液的体积为_______ mL。
(7)原样品中高铁酸钾的质量分数为_______ 。[M(K2FeO4)=198g/mol]
(8)若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数_______ (填“偏高”、“偏低”或“无影响”)。

回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采用的措施为
(2)溶浸过程中主要产生的离子为Fe3+、Mn2+、
 ,请写出主要反应的离子方程式
,请写出主要反应的离子方程式(3)溶浸后的溶液中含有少量Fe2+、Cu2+、Ca2+,则“氧化除铁”过程中加入适量的软锰矿的目的是
(4)“净化”工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要成分是
(5)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是
Ⅱ.工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如如图所示:

(6)消耗Na2S2O3标准溶液的体积为
(7)原样品中高铁酸钾的质量分数为
(8)若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数
您最近一年使用:0次



