名校
解题方法
1 . 下列关于化学反应速率和平衡的说法,正确的是
| A.升高温度能增大单位体积内活化分子数目,加快反应速率 |
| B.增大反应物浓度,可增大活化分子的百分数,因而反应速率加快 |
| C.催化剂可以降低反应的反应热,进而提高反应速率 |
| D.可逆反应:2NO2(g)⇌2NO(g)+O2(g),当n(NO2)∶n(NO)∶n(O2)=2∶2∶1时,反应达平衡 |
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
2 . 甲烷是重要的资源,通过下列过程可实现由甲烷到氢气的转化。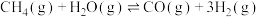 ;
;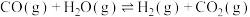 。已知
。已知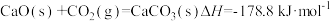 向重整反应体系中加入适量多孔CaO,其优点是
向重整反应体系中加入适量多孔CaO,其优点是_______ 。
(2)CH4与CO2重整的主要反应的热化学方程式为
反应Ⅰ:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=246.5 kJ·mol-1;
反应Ⅱ:H2(g)+CO2(g)=CO(g)+H2O(g) ΔH=41.2 kJ·mol-1;
反应Ⅲ:2CO(g)=CO2(g)+C(s) ΔH=-172.5 kJ·mol-1。
1.01×105 Pa下,将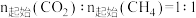 的混合气体置于密闭容器中,不同温度下重整体系中CH4和CO2的平衡转化率如图1所示。800 ℃下CO2平衡转化率远大于600 ℃ 下CO2平衡转化率,其原因是
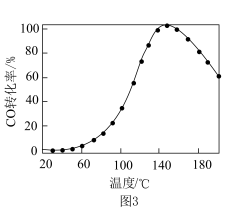
的混合气体置于密闭容器中,不同温度下重整体系中CH4和CO2的平衡转化率如图1所示。800 ℃下CO2平衡转化率远大于600 ℃ 下CO2平衡转化率,其原因是_____________ 。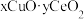 催化剂的反应器,CO的转化率随温度变化的曲线如图3所示。
催化剂的反应器,CO的转化率随温度变化的曲线如图3所示。_______ 。
②当催化氧化温度超过150 ℃时,催化剂的催化活性下降,其可能原因是_______ 。
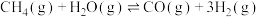 ;
;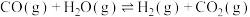 。已知
。已知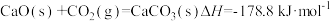 向重整反应体系中加入适量多孔CaO,其优点是
向重整反应体系中加入适量多孔CaO,其优点是(2)CH4与CO2重整的主要反应的热化学方程式为
反应Ⅰ:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=246.5 kJ·mol-1;
反应Ⅱ:H2(g)+CO2(g)=CO(g)+H2O(g) ΔH=41.2 kJ·mol-1;
反应Ⅲ:2CO(g)=CO2(g)+C(s) ΔH=-172.5 kJ·mol-1。
1.01×105 Pa下,将
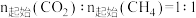 的混合气体置于密闭容器中,不同温度下重整体系中CH4和CO2的平衡转化率如图1所示。800 ℃下CO2平衡转化率远大于600 ℃ 下CO2平衡转化率,其原因是
的混合气体置于密闭容器中,不同温度下重整体系中CH4和CO2的平衡转化率如图1所示。800 ℃下CO2平衡转化率远大于600 ℃ 下CO2平衡转化率,其原因是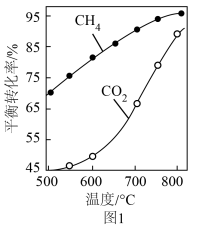
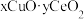 催化剂的反应器,CO的转化率随温度变化的曲线如图3所示。
催化剂的反应器,CO的转化率随温度变化的曲线如图3所示。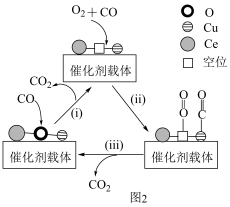
②当催化氧化温度超过150 ℃时,催化剂的催化活性下降,其可能原因是
您最近一年使用:0次
2024高三·全国·专题练习
3 . 工业上,利用CO和H2合成二甲醚: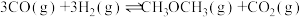 ,为了寻找合适的温度,研究者进行了多次实验,每次实验保持原料气组成(3 mol CO、3 mol H2)、体积(10 L)、反应时间等因素不变,实验结果如图所示。下列说法正确的是
,为了寻找合适的温度,研究者进行了多次实验,每次实验保持原料气组成(3 mol CO、3 mol H2)、体积(10 L)、反应时间等因素不变,实验结果如图所示。下列说法正确的是
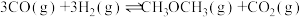 ,为了寻找合适的温度,研究者进行了多次实验,每次实验保持原料气组成(3 mol CO、3 mol H2)、体积(10 L)、反应时间等因素不变,实验结果如图所示。下列说法正确的是
,为了寻找合适的温度,研究者进行了多次实验,每次实验保持原料气组成(3 mol CO、3 mol H2)、体积(10 L)、反应时间等因素不变,实验结果如图所示。下列说法正确的是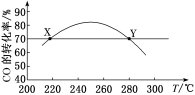
| A.X、Y两点对应的正反应速率相等 |
| B.合成二甲醚反应的ΔH>0 |
| C.反应温度应控制在240℃~260 ℃ |
| D.选择合适催化剂,可以提高CO的转化率 |
您最近一年使用:0次
名校
4 .  的资源化利用可以有效实现“碳达峰”和“碳中和”。
的资源化利用可以有效实现“碳达峰”和“碳中和”。
(1) 和
和 反应制
反应制 。主要反应如下:
。主要反应如下:
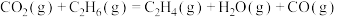

在催化剂氧化镍作用下,反应分两步进行:
第一步:……,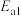 ;
;
第二步: ,
, 。
。
第一步反应的化学方程式___________ 。反应过程中第二步决定了整个反应速率,说明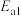
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)吸收剂X(乙醇胺, )可完成对燃煤烟气中
)可完成对燃煤烟气中 的捕集。
的捕集。___________ 。
②乙醇胺溶液能够吸收和解吸 的原因是
的原因是___________ 。
(3) 通过电催化还原可转化为有机物。以0.1mol/L的
通过电催化还原可转化为有机物。以0.1mol/L的 溶液为电解质溶液,将
溶液为电解质溶液,将 通入Cu基催化剂的电极材料上(Cu是催化剂的活性位点)。
通入Cu基催化剂的电极材料上(Cu是催化剂的活性位点)。
①生成的中间产物CO中C原子上存在孤电子对,则CO与Cu之间强烈的相互作用是___________ 。
②电解电压从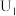 增大到
增大到 时,生成CO的量增多,导致电流减小的可能原因是
时,生成CO的量增多,导致电流减小的可能原因是___________ 。
(4)在Cu-ZnO- 催化剂上,
催化剂上, 和
和 反应可合成
反应可合成 。在有催化剂和无催化剂条件下,在高温下
。在有催化剂和无催化剂条件下,在高温下 与足量的
与足量的 混合反应,相同时间内,
混合反应,相同时间内, 的转化率基本相等,可能的原因是
的转化率基本相等,可能的原因是___________ 。
 的资源化利用可以有效实现“碳达峰”和“碳中和”。
的资源化利用可以有效实现“碳达峰”和“碳中和”。(1)
 和
和 反应制
反应制 。主要反应如下:
。主要反应如下: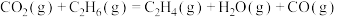

在催化剂氧化镍作用下,反应分两步进行:
第一步:……,
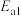 ;
;第二步:
 ,
, 。
。第一步反应的化学方程式
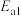
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)吸收剂X(乙醇胺,
 )可完成对燃煤烟气中
)可完成对燃煤烟气中 的捕集。
的捕集。
②乙醇胺溶液能够吸收和解吸
 的原因是
的原因是(3)
 通过电催化还原可转化为有机物。以0.1mol/L的
通过电催化还原可转化为有机物。以0.1mol/L的 溶液为电解质溶液,将
溶液为电解质溶液,将 通入Cu基催化剂的电极材料上(Cu是催化剂的活性位点)。
通入Cu基催化剂的电极材料上(Cu是催化剂的活性位点)。①生成的中间产物CO中C原子上存在孤电子对,则CO与Cu之间强烈的相互作用是
②电解电压从
 增大到
增大到 时,生成CO的量增多,导致电流减小的可能原因是
时,生成CO的量增多,导致电流减小的可能原因是(4)在Cu-ZnO-
 催化剂上,
催化剂上, 和
和 反应可合成
反应可合成 。在有催化剂和无催化剂条件下,在高温下
。在有催化剂和无催化剂条件下,在高温下 与足量的
与足量的 混合反应,相同时间内,
混合反应,相同时间内, 的转化率基本相等,可能的原因是
的转化率基本相等,可能的原因是
您最近一年使用:0次
2024高三·江苏·专题练习
解题方法
5 . 完成下列问题。
(1)CO2/HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO-,其离子方程式:_______ ;其他条件不变, 转化为HCOO-的转化率随温度的变化如图所示。反应温度在40~80℃范围内,
转化为HCOO-的转化率随温度的变化如图所示。反应温度在40~80℃范围内, 催化加氢的转化率迅速上升,其主要原因是
催化加氢的转化率迅速上升,其主要原因是_______ 。_______ (填“高”或“低”)。相同温度下,投料比远大于10∶1时,乙苯的消耗速率明显下降,可能的原因是_______ 。
(1)CO2/HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO-,其离子方程式:
 转化为HCOO-的转化率随温度的变化如图所示。反应温度在40~80℃范围内,
转化为HCOO-的转化率随温度的变化如图所示。反应温度在40~80℃范围内, 催化加氢的转化率迅速上升,其主要原因是
催化加氢的转化率迅速上升,其主要原因是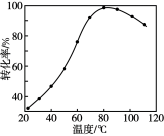
您最近一年使用:0次
2024高三·江苏·专题练习
解题方法
6 . 利用铜-铈氧化物(xCuO·yCeO2,Ce是活泼金属)催化氧化可除去H2中少量CO,催化氧化过程中Cu、Ce元素的化合价均发生变化,可能机理如图1所示。将n(CO)∶n(O2)∶n(H2)∶n(N2)=1∶1∶49∶49的混合气体以一定流速通过装有xCuO·yCeO2催化剂的反应器,CO的转化率随温度变化的曲线如图2所示。_______ 。
(2)当催化氧化温度超过150℃时,催化剂的催化活性下降,可能原因是_______ 。
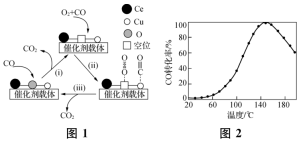
(2)当催化氧化温度超过150℃时,催化剂的催化活性下降,可能原因是
您最近一年使用:0次
2024高三·江苏·专题练习
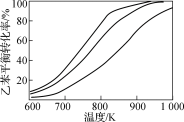
7 . 在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO+SO2 2CO2+S。其他条件相同,以比表面积大的γ-Al2O3作为催化剂,研究表明,γ-Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2去除率随反应温度的变化如图所示。240℃以前,随着温度的升高,SO2去除率降低的原因是
2CO2+S。其他条件相同,以比表面积大的γ-Al2O3作为催化剂,研究表明,γ-Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2去除率随反应温度的变化如图所示。240℃以前,随着温度的升高,SO2去除率降低的原因是_______ 。240℃以后,随着温度的升高,SO2去除率迅速增大的主要原因是_______ 。
 2CO2+S。其他条件相同,以比表面积大的γ-Al2O3作为催化剂,研究表明,γ-Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2去除率随反应温度的变化如图所示。240℃以前,随着温度的升高,SO2去除率降低的原因是
2CO2+S。其他条件相同,以比表面积大的γ-Al2O3作为催化剂,研究表明,γ-Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2去除率随反应温度的变化如图所示。240℃以前,随着温度的升高,SO2去除率降低的原因是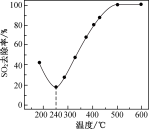
您最近一年使用:0次
2024高三·江苏·专题练习
8 . 含有少量I-的溶液中,H2O2的分解机理如下:
①H2O2+I-=H2O+IO-(慢),
②H2O2+IO-=H2O+O2+I-(快)。
对于含有少量I-的溶液中发生的反应2H2O2(aq)=2H2O(l)+O2(g) ΔH=-98kJ/mol,下列说法正确的是
①H2O2+I-=H2O+IO-(慢),
②H2O2+IO-=H2O+O2+I-(快)。
对于含有少量I-的溶液中发生的反应2H2O2(aq)=2H2O(l)+O2(g) ΔH=-98kJ/mol,下列说法正确的是
| A.增大溶液中c(I-),可提高H2O2的分解速率 |
| B.IO-也是该反应的催化剂 |
| C.反应①和反应②的活化能之和等于98kJ/mol |
| D.升高温度和使用催化剂均能提高H2O2分解的平衡转化率 |
您最近一年使用:0次
9 . 我国科研团队研究发现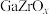 双金属氧化物可形成氧空位,具有催化性能,实现
双金属氧化物可形成氧空位,具有催化性能,实现 加氢制甲醇,其反应机理如图所示。下列说法正确的是
加氢制甲醇,其反应机理如图所示。下列说法正确的是
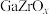 双金属氧化物可形成氧空位,具有催化性能,实现
双金属氧化物可形成氧空位,具有催化性能,实现 加氢制甲醇,其反应机理如图所示。下列说法正确的是
加氢制甲醇,其反应机理如图所示。下列说法正确的是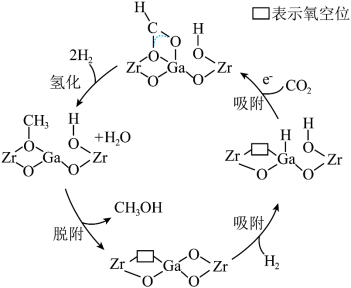
| A.反应过程中Ga的成键数目保持不变 |
B.氧空位用于吸附 ,有利于提高反应的速率 ,有利于提高反应的速率 |
| C.脱附过程中伴随着极性键和非极性键的断裂和形成 |
| D.该反应的原子利用率为100% |
您最近一年使用:0次
名校
解题方法
10 . 少量铁粉与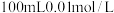 的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变
的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变 的产量,可以使用如下方法中的
的产量,可以使用如下方法中的
①加 ②加
②加 固体 ③滴入几滴浓盐酸 ④加
固体 ③滴入几滴浓盐酸 ④加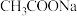 固体 ⑤加
固体 ⑤加 溶液
溶液
⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用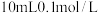 盐酸
盐酸
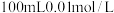 的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变
的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变 的产量,可以使用如下方法中的
的产量,可以使用如下方法中的①加
 ②加
②加 固体 ③滴入几滴浓盐酸 ④加
固体 ③滴入几滴浓盐酸 ④加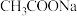 固体 ⑤加
固体 ⑤加 溶液
溶液⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用
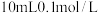 盐酸
盐酸| A.①⑥⑦ | B.③⑤⑧ | C.⑤⑦⑧ | D.③⑦⑧ |
您最近一年使用:0次
2024-09-04更新
|
81次组卷
|
12卷引用:新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高二上学期第一次月考化学试题
新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高二上学期第一次月考化学试题河北省石家庄外国语学校2019-2020学年高二上学期期末考试化学试题四川省简阳市阳安中学2020-2021学年高二上学期9月月考化学试题陕西省渭南市澄城县城关中学2020-2021学年高二上学期第一次月考化学试题宁夏石嘴山市第三中学2020-2021学年高二上学期期中考试化学试题新疆乌鲁木齐市第八中学2020-2021学年高二上学期第一阶段考试化学试题黑龙江省哈尔滨市第六中学2020-2021学年高一下学期期末考试化学试题黑龙江省大庆市东风中学2021-2022学年高一下学期期中考试化学试题四川省凉山宁南中学2021-2022学年高二上学期第一次月考化学试题江苏省无锡市太湖高级中学2022-2023学年高二下学期期中考试化学试题云南省红河哈尼族彝族自治州第一中学2023-2024学年高一下学期5月月考化学试题(已下线)考点巩固卷09 化学反应速率与化学平衡(一)(7大考向)-2025年高考化学一轮复习考点通关卷(江苏专用)



