1 . 某小组同学探究铜和浓硝酸的反应,进行如下实验:
实验1:分别取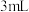 浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如下:
浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如下:
(1)写出铜和浓硝酸反应的离子反应方程式:_______ 。
(2)小组同学认为溶液呈绿色的可能原因是:
猜想1:硝酸铜质量分数较高,溶液呈绿色;
猜想2: 溶解在硝酸铜溶液中,溶液呈绿色。
溶解在硝酸铜溶液中,溶液呈绿色。
依据实验1中的现象,判断猜想1是否合理,并说明理由:_____ 。
(3)取⑤中溶液,_____ (填操作和现象),证实猜想2成立。
(4)小组同学进行如下实验也证实了猜想2成立。
实验2:向①中溶液以相同流速分别通入N2和空气,观察现象。
结合物质性质和上述实验现象,下列推测合理的是_______(填字母序号)。
(5)小组同学继续探究实验2中现象的差异,并查阅文献知:
i.“可溶性铜盐中溶解亚硝酸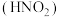 ”可能是实验①中溶液显绿色的主要原因
”可能是实验①中溶液显绿色的主要原因
ii. 在溶液中存在:
在溶液中存在:
反应1: (慢)
(慢)
反应2: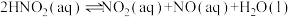 (快)
(快)
结合信息及反应原理解释实验2中“通入氮气变蓝慢,通入空气变蓝快”的原因_______ 。
(6)小组同学为确认亚硝酸参与了形成绿色溶液的过程,继续进行实验。
实验3:取3份等体积的①中绿色溶液,分别加入不同物质,观察现象。
实验中加入的固体物质是_______ (填化学式),加入 后溶液迅速变蓝可能的原因是化学方程式表示):
后溶液迅速变蓝可能的原因是化学方程式表示):  ,
,_______ ,_______ 。
实验1:分别取
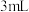 浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如下:
浓硝酸与不同质量的铜粉充分反应,铜粉完全溶解,溶液颜色如下:| 编号 | ① | ② | ③ | ④ | ⑤ |
| 铜粉质量 | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 |
| 溶液颜色 | 绿色 | 草绿色 | 蓝绿色偏绿 | 蓝绿色偏蓝 | 蓝色 |
(2)小组同学认为溶液呈绿色的可能原因是:
猜想1:硝酸铜质量分数较高,溶液呈绿色;
猜想2:
 溶解在硝酸铜溶液中,溶液呈绿色。
溶解在硝酸铜溶液中,溶液呈绿色。依据实验1中的现象,判断猜想1是否合理,并说明理由:
(3)取⑤中溶液,
(4)小组同学进行如下实验也证实了猜想2成立。
实验2:向①中溶液以相同流速分别通入N2和空气,观察现象。
| 通入气体 | 氮气 | 空气 |
| 现象 | 液面上方出现明显的红棕色气体,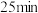 后溶液变为蓝色 后溶液变为蓝色 | 液面上方出现明显的红棕色气体, 后溶液变为蓝 后溶液变为蓝 |
A.(1)中溶液通入 时, 时, 被缓慢氧化为 被缓慢氧化为 |
| B.(1)中溶液里某还原性微粒与绿色有关,通入空气时较快被氧化 |
C.空气中的 溶于水显酸性,促进了溶液变蓝色 溶于水显酸性,促进了溶液变蓝色 |
| D.加热溶液①后,能观察到溶液变蓝的现象 |
i.“可溶性铜盐中溶解亚硝酸
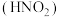 ”可能是实验①中溶液显绿色的主要原因
”可能是实验①中溶液显绿色的主要原因ii.
 在溶液中存在:
在溶液中存在:反应1:
 (慢)
(慢)反应2:
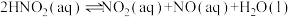 (快)
(快)结合信息及反应原理解释实验2中“通入氮气变蓝慢,通入空气变蓝快”的原因
(6)小组同学为确认亚硝酸参与了形成绿色溶液的过程,继续进行实验。
实验3:取3份等体积的①中绿色溶液,分别加入不同物质,观察现象。
| 加入物质 | _______固体 | 3滴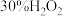 溶液 溶液 | 3滴水 |
| 现象 | 溶液绿色变深 | 溶液迅速变为蓝色 | 溶液颜色几乎不变 |
 后溶液迅速变蓝可能的原因是化学方程式表示):
后溶液迅速变蓝可能的原因是化学方程式表示):  ,
,
您最近一年使用:0次
名校
2 . 溴代烷的制备,分“氧化”和“溴化”两个过程,回答下列问题。
(1)氧化过程:HBr(g)与O2(g)在合适温度下制备Br2(g)。
已知:T℃时,相关物质的相对能量如表所示:
此温度下,在恒容密闭容器中充入4molHBr(g)和1molO2(g),测得反应物的平衡转化率为60%。若保持其他条件不变,改为绝热状态,平衡时,测得放出热量为QkJ,则下列关系正确的是_____ (填标号)。
(2)溴化过程:在T℃下,向10V0L容器中投入初始浓度均为0.1mol•L-1的Br2(g)和CH4(g),发生反应:Br2(g)+CH4(g) CH3Br(g)+HBr(g)。保持温度不变,压缩容器体积,分别测得不同容积下CH3Br(g)的平衡浓度如表:
CH3Br(g)+HBr(g)。保持温度不变,压缩容器体积,分别测得不同容积下CH3Br(g)的平衡浓度如表:
当容器体积从10V0L缩小到3V0L时,测得此时容器内仍有四种气态组分,则m=_____ ;容器体积缩小到V0L时,平衡_____ 移动(填“正向”、“逆向”或“不”)。T℃时,此反应在容积为10V0L和V0L时化学平衡常数分别为K1、K2,则K1_____ K2(填“大于”、“小于”或“等于”)。
(3)新工艺可将甲烷、HBr和O2混合,直接催化“氧化溴化”:2CH4(g)+2HBr(g)+O2(g) 2CH3Br(g)+2H2O(g) △H<0。反应起始物料n(CH4)、n(HBr)、n(O2)分别为2mol、2mol、1mol时,在不同条件下达到平衡,设体系中CH3Br的物质的量分数为x(CH3Br),在T为500℃下的x(CH3Br)~p、在p为3×105Pa下的x(CH3Br)~T如图所示。
2CH3Br(g)+2H2O(g) △H<0。反应起始物料n(CH4)、n(HBr)、n(O2)分别为2mol、2mol、1mol时,在不同条件下达到平衡,设体系中CH3Br的物质的量分数为x(CH3Br),在T为500℃下的x(CH3Br)~p、在p为3×105Pa下的x(CH3Br)~T如图所示。

①图中a点对应的反应条件为_____ ,此时用各物质平衡分压表示的平衡常数Kp=_____ Pa-1(列计算式,某气体分压=总压×该气体的物质的量百分数)
②b点对应的甲烷转化率α(CH4)=_____ (保留三位有效数字)。
(1)氧化过程:HBr(g)与O2(g)在合适温度下制备Br2(g)。
已知:T℃时,相关物质的相对能量如表所示:
| 物质 | HBr(g) | O2(g) | H2O(g) | Br2(g) |
| 相对能量/kJ•mol-1 | x | y | z | w |
| A.Q=0.6(2z+2w-4x-y) | B.Q<0.6(2z+2w-4x-y) |
| C.Q<0.6(4x+y-2z-2w) | D.0.6(4x+y-2z-2w)<Q<4x+y-2z-2w |
 CH3Br(g)+HBr(g)。保持温度不变,压缩容器体积,分别测得不同容积下CH3Br(g)的平衡浓度如表:
CH3Br(g)+HBr(g)。保持温度不变,压缩容器体积,分别测得不同容积下CH3Br(g)的平衡浓度如表:| 容器体积V/L | 10V0 | 3V0 | V0 |
| c(CH3Br)/mol•L-1 | m | 0.09 | 0.25 |
(3)新工艺可将甲烷、HBr和O2混合,直接催化“氧化溴化”:2CH4(g)+2HBr(g)+O2(g)
 2CH3Br(g)+2H2O(g) △H<0。反应起始物料n(CH4)、n(HBr)、n(O2)分别为2mol、2mol、1mol时,在不同条件下达到平衡,设体系中CH3Br的物质的量分数为x(CH3Br),在T为500℃下的x(CH3Br)~p、在p为3×105Pa下的x(CH3Br)~T如图所示。
2CH3Br(g)+2H2O(g) △H<0。反应起始物料n(CH4)、n(HBr)、n(O2)分别为2mol、2mol、1mol时,在不同条件下达到平衡,设体系中CH3Br的物质的量分数为x(CH3Br),在T为500℃下的x(CH3Br)~p、在p为3×105Pa下的x(CH3Br)~T如图所示。
①图中a点对应的反应条件为
②b点对应的甲烷转化率α(CH4)=
您最近一年使用:0次
3 . 著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面所作出的贡献。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图(铈常见的化合价为+3和+4):
的一种工艺流程如图(铈常见的化合价为+3和+4):
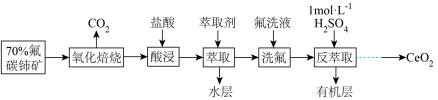
(1)氟碳铈矿“氧化焙烧”生成 ,冷却后,不需要机械加工粉碎成细颗粒,就能与盐酸充分反应,其原因是
,冷却后,不需要机械加工粉碎成细颗粒,就能与盐酸充分反应,其原因是___________ 。
(2)“酸浸”过程中产生大量黄绿色气体,写出 与盐酸反应的离子方程式:
与盐酸反应的离子方程式:___________ 。
(3)有机物HT能将 从水溶液中提取出来,该过程可表示为
从水溶液中提取出来,该过程可表示为 (水层)+3HT(有机层)
(水层)+3HT(有机层)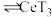 (有机层)
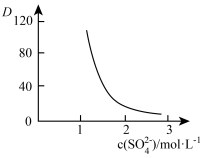
(有机层)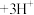 (水层)。保持其它条件不变时,分配比D(D表示
(水层)。保持其它条件不变时,分配比D(D表示 分别在有机层中与水层中存在形式的物质的量浓度之比)随起始料液中
分别在有机层中与水层中存在形式的物质的量浓度之比)随起始料液中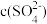 变化如图所示。“反萃取”时,工业上常选用
变化如图所示。“反萃取”时,工业上常选用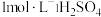 ,其作用为:
,其作用为:___________ ;同时还加入一定量的 的原因:
的原因:___________ 。
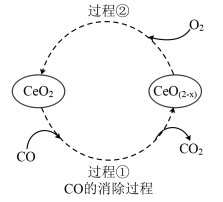
(4) 是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式
是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式___________ 。尾气消除过程中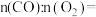
___________
 )为原料制备
)为原料制备 的一种工艺流程如图(铈常见的化合价为+3和+4):
的一种工艺流程如图(铈常见的化合价为+3和+4):
(1)氟碳铈矿“氧化焙烧”生成
 ,冷却后,不需要机械加工粉碎成细颗粒,就能与盐酸充分反应,其原因是
,冷却后,不需要机械加工粉碎成细颗粒,就能与盐酸充分反应,其原因是(2)“酸浸”过程中产生大量黄绿色气体,写出
 与盐酸反应的离子方程式:
与盐酸反应的离子方程式:(3)有机物HT能将
 从水溶液中提取出来,该过程可表示为
从水溶液中提取出来,该过程可表示为 (水层)+3HT(有机层)
(水层)+3HT(有机层)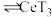 (有机层)
(有机层)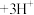 (水层)。保持其它条件不变时,分配比D(D表示
(水层)。保持其它条件不变时,分配比D(D表示 分别在有机层中与水层中存在形式的物质的量浓度之比)随起始料液中
分别在有机层中与水层中存在形式的物质的量浓度之比)随起始料液中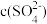 变化如图所示。“反萃取”时,工业上常选用
变化如图所示。“反萃取”时,工业上常选用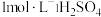 ,其作用为:
,其作用为: 的原因:
的原因:
(4)
 是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式
是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式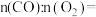

您最近一年使用:0次
4 . 硫、氮是主要的非金属元素,也是人类较早认识的化学元素。硫元素与氮元素也都是生命元素,在自然界中有重要的循环过程。人类对硫、氮元素的利用,其本质就是通过各种化学反应,实现物质之间的转化,如硫酸工业就是人类对硫元素的利用。
(1)生产、生活中,与SO2的大量排放有关的环境问题是_______。(选填编号)
(2)氮循环和硫循环是自然界中两种重要的元素循环过程。请选出下表中关于这两种循环的正确评价_______ 。(选填编号)
任选其中一种错误评价,解释判断理由:_______ 。
硫酸工业生产的核心阶段是转化,转化率越高,则硫的利用率越高,对环境影响也越小。转化阶段发生的反应:2SO2+O2 2SO3(放热反应)
2SO3(放热反应)
(3)上述反应中,反应物的总能量_______ (选填“大于”或“小于”)生成物的总能量。
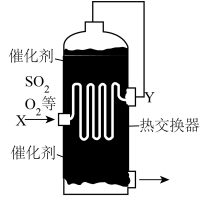
(4)为合理利用反应中产生的热量,热交换器在硫酸工业中与下列_______设备合为一体。(选填编号)
(5)图中,Y处的气体是_______。(选填编号)
一定温度下,在容积为2L的密闭容器内,通入一定量的SO2和空气,在给定条件下发生反应生成SO3的物质的量浓度变化如下图所示:

(6)不能说明反应已达平衡状态的是_______。(选填编号)
(7)根据图上信息,从反应开始到第一次达到平衡状态时,SO3的平均反应速率为_______ 。
(8)在6min时,可能改变的条件是_______。(选填编号)
(9)对于该反应,能否通过改变条件使SO2完全转化为SO3?_______ (选填“能”或“不能”),原因是_______ 。
(1)生产、生活中,与SO2的大量排放有关的环境问题是_______。(选填编号)
| A.酸雨 | B.PM2.5 | C.温室效应 | D.白色污染 |
| 编号 | 比较 | 氮循环 | 硫循环 |
| ① | 异 | 氮元素会进入大气 | 硫循环不会进入大气 |
| ② | 氮元素可以有机化合物形式参与循环 | 硫元素都以无机化合物形式参与循环 | |
| ③ | 同 | 人类活动对氮循环和硫循环都造成了巨大影响 | |
| ④ | 氮循环和硫循环对环境影响都导致温室效应 | ||
硫酸工业生产的核心阶段是转化,转化率越高,则硫的利用率越高,对环境影响也越小。转化阶段发生的反应:2SO2+O2
 2SO3(放热反应)
2SO3(放热反应)(3)上述反应中,反应物的总能量
(4)为合理利用反应中产生的热量,热交换器在硫酸工业中与下列_______设备合为一体。(选填编号)
| A.沸腾炉 | B.净化器 | C.转化器 | D.吸收塔 |

| A.低温的SO2、O2 | B.低温的SO2、O2和SO3 |
| C.高温的SO2、O2 | D.高温的SO2、O2和SO3 |
一定温度下,在容积为2L的密闭容器内,通入一定量的SO2和空气,在给定条件下发生反应生成SO3的物质的量浓度变化如下图所示:

(6)不能说明反应已达平衡状态的是_______。(选填编号)
| A.v(SO2)正=2v(O2)逆 | B.压强不变 |
| C.SO2浓度不再发生变化 | D.密度不变 |
(8)在6min时,可能改变的条件是_______。(选填编号)
| A.降低温度 | B.增加O2浓度 |
| C.减小压强 | D.增加SO3浓度 |
您最近一年使用:0次
5 . 某铬渣主要含有 以及少量的
以及少量的 、
、 等杂质,某研究小组设计以下流程获取
等杂质,某研究小组设计以下流程获取 ,实现铬渣资源化。
,实现铬渣资源化。

资料:
a.焙烧中加入氧化钙的目的是防止物料烧结,并提高物料焙烧温度。
b.常温下,水溶液中存在 ,
, 。
。
c. 与
与 类似,均具有两性。
类似,均具有两性。
d.
(1)为提高“酸浸”速率,可采取的措施有___________ (至少写出两条)。
(2)焙烧时, 被
被 氧化为
氧化为 ,产物中还有
,产物中还有 ,写出该反应的化学方程式
,写出该反应的化学方程式___________
(3)滤液A中加入 发生的氧化反应:
发生的氧化反应:
①含铬元素的微粒参与的还原反应:___________ 。
②实验表明,酸浸时调节pH越低,最终得到的铬回收率越高,原因是___________ 。
③当加入 过量,过量的
过量,过量的 与
与 形成配合物
形成配合物 而稳定存在,对铬回收率的影响是
而稳定存在,对铬回收率的影响是___________ (填“增大”、“减小”、或者“不影响”),理由是___________ 。
(4)滤液A中 发生反应的离子方程式是
发生反应的离子方程式是___________ 。
(5)草酸“除铁”的离子方程式是___________ 。
(6)90℃时,加入 调节pH,不同pH对铬沉淀率的影响如下图所示,请解释铬沉淀率随着pH先增大后减小的原因
调节pH,不同pH对铬沉淀率的影响如下图所示,请解释铬沉淀率随着pH先增大后减小的原因___________ 。

 以及少量的
以及少量的 、
、 等杂质,某研究小组设计以下流程获取
等杂质,某研究小组设计以下流程获取 ,实现铬渣资源化。
,实现铬渣资源化。
资料:
a.焙烧中加入氧化钙的目的是防止物料烧结,并提高物料焙烧温度。
b.常温下,水溶液中存在
 ,
, 。
。c.
 与
与 类似,均具有两性。
类似,均具有两性。d.

(1)为提高“酸浸”速率,可采取的措施有
(2)焙烧时,
 被
被 氧化为
氧化为 ,产物中还有
,产物中还有 ,写出该反应的化学方程式
,写出该反应的化学方程式(3)滤液A中加入
 发生的氧化反应:
发生的氧化反应:
①含铬元素的微粒参与的还原反应:
②实验表明,酸浸时调节pH越低,最终得到的铬回收率越高,原因是
③当加入
 过量,过量的
过量,过量的 与
与 形成配合物
形成配合物 而稳定存在,对铬回收率的影响是
而稳定存在,对铬回收率的影响是(4)滤液A中
 发生反应的离子方程式是
发生反应的离子方程式是(5)草酸“除铁”的离子方程式是
(6)90℃时,加入
 调节pH,不同pH对铬沉淀率的影响如下图所示,请解释铬沉淀率随着pH先增大后减小的原因
调节pH,不同pH对铬沉淀率的影响如下图所示,请解释铬沉淀率随着pH先增大后减小的原因
您最近一年使用:0次
解题方法
6 . 羰基硫 是一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害,利于粮食的长期储存.在容积不变的密闭容器中,将
是一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害,利于粮食的长期储存.在容积不变的密闭容器中,将 和
和 混合后在催化剂和加热条件下达到下列平衡:
混合后在催化剂和加热条件下达到下列平衡: 。
。
(1)已知 结构与
结构与 相似,则
相似,则 分子的空间结构为
分子的空间结构为__________ 。
(2)若反应前 的物质的量为
的物质的量为 ,达到平衡时
,达到平衡时 的物质的量为
的物质的量为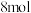 ,且化学平衡常数为0.1。下列说法正确的是
,且化学平衡常数为0.1。下列说法正确的是__________ 。
a.增大压强,化学平衡正向移动
b.增大 浓度,正反应速率增大,逆反应速率减小
浓度,正反应速率增大,逆反应速率减小
c.反应前 的物质的量为
的物质的量为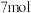
d.达到平衡时 的转化率为
的转化率为
(3)①在不同温度下达到化学平衡时, 的转化率如图所示,则该反应是
的转化率如图所示,则该反应是__________ (填“吸热”或“放热”)反应。
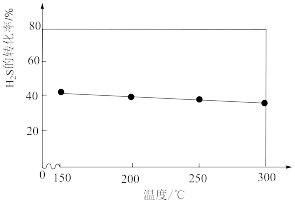
②若采用恒压,当温度高于 后,
后, 的转化率出现了断崖式下跌,原因可能是
的转化率出现了断崖式下跌,原因可能是__________ 、__________ (写出任意两点即可)。
(4)增大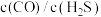 的值,
的值, 的转化率
的转化率__________ (填“增大”或“减小”)。工业上 尾气的处理方法中,克劳斯法是将三分之一
尾气的处理方法中,克劳斯法是将三分之一 氧化为
氧化为 ,再在转化炉中将剩下的
,再在转化炉中将剩下的 转化为S单质,写出转化炉中反应的化学方程式:
转化为S单质,写出转化炉中反应的化学方程式:__________ 。实验室中 气体常用过量的氢氧化钠溶液吸收,写出反应的离子方程式:
气体常用过量的氢氧化钠溶液吸收,写出反应的离子方程式:__________ 。
 是一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害,利于粮食的长期储存.在容积不变的密闭容器中,将
是一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害,利于粮食的长期储存.在容积不变的密闭容器中,将 和
和 混合后在催化剂和加热条件下达到下列平衡:
混合后在催化剂和加热条件下达到下列平衡: 。
。(1)已知
 结构与
结构与 相似,则
相似,则 分子的空间结构为
分子的空间结构为(2)若反应前
 的物质的量为
的物质的量为 ,达到平衡时
,达到平衡时 的物质的量为
的物质的量为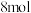 ,且化学平衡常数为0.1。下列说法正确的是
,且化学平衡常数为0.1。下列说法正确的是a.增大压强,化学平衡正向移动
b.增大
 浓度,正反应速率增大,逆反应速率减小
浓度,正反应速率增大,逆反应速率减小c.反应前
 的物质的量为
的物质的量为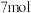
d.达到平衡时
 的转化率为
的转化率为
(3)①在不同温度下达到化学平衡时,
 的转化率如图所示,则该反应是
的转化率如图所示,则该反应是
②若采用恒压,当温度高于
 后,
后, 的转化率出现了断崖式下跌,原因可能是
的转化率出现了断崖式下跌,原因可能是(4)增大
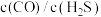 的值,
的值, 的转化率
的转化率 尾气的处理方法中,克劳斯法是将三分之一
尾气的处理方法中,克劳斯法是将三分之一 氧化为
氧化为 ,再在转化炉中将剩下的
,再在转化炉中将剩下的 转化为S单质,写出转化炉中反应的化学方程式:
转化为S单质,写出转化炉中反应的化学方程式: 气体常用过量的氢氧化钠溶液吸收,写出反应的离子方程式:
气体常用过量的氢氧化钠溶液吸收,写出反应的离子方程式:
您最近一年使用:0次
7 . 重要的金属化合物。铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。在一定温度下,氧化铁可以与一氧化碳发生下列反应: 。经实验表明,该反应是吸热反应。
。经实验表明,该反应是吸热反应。
(1)化学反应速率是指化学反应进行的快慢,通常以单位时间内反应物或生成物浓度的变化值来表示。如果在该温度下,在2L盛有 粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为___________ 。
(2)化学平衡状态是指可逆反应在该条件下所能进行的最大程度。在密闭容器中进行一氧化碳还原氧化铁的反应,在一段时间内,下列物理量保持不变时,不能说明上述反应已经达到平衡状态的是___________
(3)改变外界条件,使化学反应在单位时间内尽可能得到多的产品,是化工生产的核心思想之一、在下列措施中,既可以加快化学反应速率,又可以使平衡正向移动,得到更多铁单质的措施是___________
铝是一种比铁活泼的金属,铝粉和金属氧化物在高温条件下发生剧烈反应并放出大量热的化学反应称为铝热反应。由于反应迅速,且反应放出的热量可使温度达到3000℃以上,铝热反应常被用于冶炼难熔的金属、焊接钢轨等大截面钢材部件、制作铝热弹等军事用途,以及制作传统的烟火剂等。
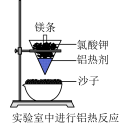
(4)最常见的铝热剂为铝粉和氧化铁( )的混合物。在实验室中可以按右图装置进行铝热反应,生成铁单质。该反应的化学方程式为
)的混合物。在实验室中可以按右图装置进行铝热反应,生成铁单质。该反应的化学方程式为___________ 。
(5)利用函数图可以比较直观地表示出速率的变化趋势。铝热反应是放热反应,下列关于反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是___________
(6)金属还可以组装成原电池用于发电。原电池又称一次电池,是指放电之后不可再充电的化学电池。日常使用的锌锰干电池、锌银纽扣电池等都属于一次电池。将Al、Fe浸入盛有稀硫酸的烧杯中,再用导线连接,即得到一简易的化学电池。有关该原电池说法正确的是___________
 。经实验表明,该反应是吸热反应。
。经实验表明,该反应是吸热反应。(1)化学反应速率是指化学反应进行的快慢,通常以单位时间内反应物或生成物浓度的变化值来表示。如果在该温度下,在2L盛有
 粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为(2)化学平衡状态是指可逆反应在该条件下所能进行的最大程度。在密闭容器中进行一氧化碳还原氧化铁的反应,在一段时间内,下列物理量保持不变时,不能说明上述反应已经达到平衡状态的是
| A.容器内的压强不变 | B.容器内气体的平均相对分子质量不变 |
| C.容器内CO的浓度不变 | D.容器内气体的密度不变 |
| A.升高反应温度 | B.增大体系压强 | C.使用合适的催化剂 | D.增加氧化铁的量 |
铝是一种比铁活泼的金属,铝粉和金属氧化物在高温条件下发生剧烈反应并放出大量热的化学反应称为铝热反应。由于反应迅速,且反应放出的热量可使温度达到3000℃以上,铝热反应常被用于冶炼难熔的金属、焊接钢轨等大截面钢材部件、制作铝热弹等军事用途,以及制作传统的烟火剂等。

(4)最常见的铝热剂为铝粉和氧化铁(
 )的混合物。在实验室中可以按右图装置进行铝热反应,生成铁单质。该反应的化学方程式为
)的混合物。在实验室中可以按右图装置进行铝热反应,生成铁单质。该反应的化学方程式为(5)利用函数图可以比较直观地表示出速率的变化趋势。铝热反应是放热反应,下列关于反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是
A.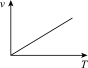 | B.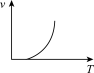 | C.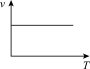 | D.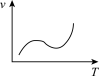 |

| A.铁作负极 | B.铝片上产生大量气泡 |
| C.电子由铝流向铁 | D.该装置将电能转化为化学能 |
您最近一年使用:0次
名校
解题方法
8 . Ⅰ.碳化学是以分子中只含一个碳原子的化合物为原料生产化工产品的方法。合成气( 和
和 的混合气体)
的混合气体)
是碳化学的重要原料,焦炭与水蒸气在刚性密闭容器中会发生如下两个反应:
i.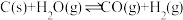
ii.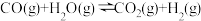
下表是几种物质的标准生成热(由对应稳定单质生成 某种物质的焓变叫做该物质的标准生成热)。
某种物质的焓变叫做该物质的标准生成热)。
(1)反应i的焓变
___________ 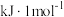 ,
,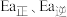 分别表示该反应正、逆反应的活化能,则
分别表示该反应正、逆反应的活化能,则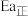
___________ 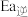 (填“>”或“<”或“=”)。
(填“>”或“<”或“=”)。
(2)若在绝热恒容容器中仅发生反应ii,则下列事实能说明反应达到平衡状态的是___________。
(3)已知反应ii的正反应速率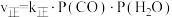 ,逆反应速率
,逆反应速率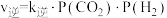 ,
, 分别为正、逆反应速率常数,
分别为正、逆反应速率常数,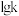 (k表示
(k表示 或
或 )与温度
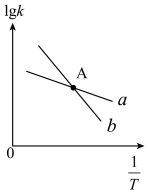
)与温度 的关系如图所示,其中直线a、b分别表示
的关系如图所示,其中直线a、b分别表示 随温度的变化。升高温度,反应ii的平衡常数K
随温度的变化。升高温度,反应ii的平衡常数K___________ (填“变大”或“变小”或“不变”)。
(4)在上图A点对应的温度下,向某刚性密闭容器中加入足量焦炭和一定量水蒸气,同时发生反应i和反应ii,已知起始时容器内压强为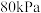 ,10分钟后体系达到平衡状态,容器内压强变为
,10分钟后体系达到平衡状态,容器内压强变为 。平衡时
。平衡时 的分压
的分压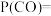
___________  ,平衡时水蒸气的转化率为
,平衡时水蒸气的转化率为___________  。
。
Ⅱ.和 制备
制备 ,可实现的资源化利用,涉及的反应如下:
,可实现的资源化利用,涉及的反应如下:
主反应: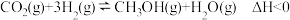
副反应: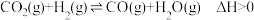
将反应物混合气体按进料比 通入反应装置中,选择合适的催化剂,发生上述反应。
通入反应装置中,选择合适的催化剂,发生上述反应。
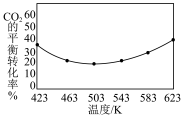
(5)不同温度下, 的平衡转化率如图所示,温度高于
的平衡转化率如图所示,温度高于 时,
时, 的平衡转化率随温度的升高而增大的原因是
的平衡转化率随温度的升高而增大的原因是___________ 。
 和
和 的混合气体)
的混合气体)是碳化学的重要原料,焦炭与水蒸气在刚性密闭容器中会发生如下两个反应:
i.
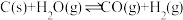
ii.
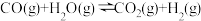
下表是几种物质的标准生成热(由对应稳定单质生成
 某种物质的焓变叫做该物质的标准生成热)。
某种物质的焓变叫做该物质的标准生成热)。| 物质 | 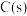 |  |  |  |
标准生成热/ | 0.0 |  | 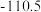 | 0.0 |

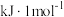 ,
,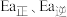 分别表示该反应正、逆反应的活化能,则
分别表示该反应正、逆反应的活化能,则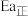
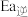 (填“>”或“<”或“=”)。
(填“>”或“<”或“=”)。(2)若在绝热恒容容器中仅发生反应ii,则下列事实能说明反应达到平衡状态的是___________。
| A.容器内气体的压强不变 | B.容器内温度不变 |
| C.容器内气体的密度不再改变 | D.容器内气体的平均相对分子质量不变 |
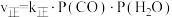 ,逆反应速率
,逆反应速率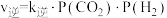 ,
, 分别为正、逆反应速率常数,
分别为正、逆反应速率常数,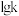 (k表示
(k表示 或
或 )与温度
)与温度 的关系如图所示,其中直线a、b分别表示
的关系如图所示,其中直线a、b分别表示 随温度的变化。升高温度,反应ii的平衡常数K
随温度的变化。升高温度,反应ii的平衡常数K
(4)在上图A点对应的温度下,向某刚性密闭容器中加入足量焦炭和一定量水蒸气,同时发生反应i和反应ii,已知起始时容器内压强为
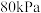 ,10分钟后体系达到平衡状态,容器内压强变为
,10分钟后体系达到平衡状态,容器内压强变为 。平衡时
。平衡时 的分压
的分压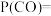
 ,平衡时水蒸气的转化率为
,平衡时水蒸气的转化率为 。
。Ⅱ.和
 制备
制备 ,可实现的资源化利用,涉及的反应如下:
,可实现的资源化利用,涉及的反应如下:主反应:
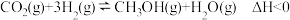
副反应:
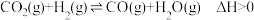
将反应物混合气体按进料比
 通入反应装置中,选择合适的催化剂,发生上述反应。
通入反应装置中,选择合适的催化剂,发生上述反应。(5)不同温度下,
 的平衡转化率如图所示,温度高于
的平衡转化率如图所示,温度高于 时,
时, 的平衡转化率随温度的升高而增大的原因是
的平衡转化率随温度的升高而增大的原因是
您最近一年使用:0次
名校
9 . 处理含铬[Cr(Ⅵ)]废水的方法有化学沉淀法、铝还原回收法等。
(1)钡盐沉铬法:
已知水溶液中 (橙色)可转化为
(橙色)可转化为 (黄色),该可逆反应用离子方程式可表示为
(黄色),该可逆反应用离子方程式可表示为___________ ;向含Cr(Ⅵ)的酸性废水中加入钡盐,生成难溶于水的 沉淀。使用
沉淀。使用 的沉铬效果要优于
的沉铬效果要优于 的原因是
的原因是___________ ;
(2)亚硫酸氢钠-石灰乳还原沉淀法:向初始pH不等的几份酸性含铬废水中加入等量 ,使Cr(Ⅵ)还原成Cr(Ⅲ)。测得废水中残留Cr(Ⅵ)与反应时间的关系变化关系如图所示。
,使Cr(Ⅵ)还原成Cr(Ⅲ)。测得废水中残留Cr(Ⅵ)与反应时间的关系变化关系如图所示。

①写出 将
将 还原为
还原为 的离子方程式
的离子方程式___________ ;
②实际生产中,还原反应控制pH为2.5左右的原因是___________ ;
(3)还原回收Cr(Ⅵ)法:
步骤1:向含Cr(Ⅵ)的酸性溶液中加入一定量的铝粉,充分反应,过滤。
步骤Ⅱ:利用步骤Ⅰ过滤后得到的溶液(含有 、
、 、
、 )获得
)获得 。
。
①研究发现,若步骤Ⅰ中pH偏低将会导致Cr(Ⅵ)的去除率下降,其原因是___________ ;
②获得 和
和 的混合溶液的实验方案为:向步骤Ⅰ过滤后的溶液中加KOH溶液调节pH=8,
的混合溶液的实验方案为:向步骤Ⅰ过滤后的溶液中加KOH溶液调节pH=8,___________ ,得到 和
和 的混合溶液。(实验中须用到的试剂:KOH溶液、
的混合溶液。(实验中须用到的试剂:KOH溶液、 溶液、稀硫酸)
溶液、稀硫酸)
已知:
ⅰ.常温下,体系中Al(Ⅲ)、Cr(Ⅲ)微粒的分布分数随溶液pH的变化如图下所示(部分无关粒子已略去)。
ⅱ.强碱性条件下Cr(Ⅲ)能被 氧化为
氧化为 ;酸性条件下
;酸性条件下 能将Cr(Ⅵ)还原为Cr(Ⅲ)。
能将Cr(Ⅵ)还原为Cr(Ⅲ)。

(1)钡盐沉铬法:
已知水溶液中
 (橙色)可转化为
(橙色)可转化为 (黄色),该可逆反应用离子方程式可表示为
(黄色),该可逆反应用离子方程式可表示为 沉淀。使用
沉淀。使用 的沉铬效果要优于
的沉铬效果要优于 的原因是
的原因是(2)亚硫酸氢钠-石灰乳还原沉淀法:向初始pH不等的几份酸性含铬废水中加入等量
 ,使Cr(Ⅵ)还原成Cr(Ⅲ)。测得废水中残留Cr(Ⅵ)与反应时间的关系变化关系如图所示。
,使Cr(Ⅵ)还原成Cr(Ⅲ)。测得废水中残留Cr(Ⅵ)与反应时间的关系变化关系如图所示。
①写出
 将
将 还原为
还原为 的离子方程式
的离子方程式②实际生产中,还原反应控制pH为2.5左右的原因是
(3)还原回收Cr(Ⅵ)法:
步骤1:向含Cr(Ⅵ)的酸性溶液中加入一定量的铝粉,充分反应,过滤。
步骤Ⅱ:利用步骤Ⅰ过滤后得到的溶液(含有
 、
、 、
、 )获得
)获得 。
。①研究发现,若步骤Ⅰ中pH偏低将会导致Cr(Ⅵ)的去除率下降,其原因是
②获得
 和
和 的混合溶液的实验方案为:向步骤Ⅰ过滤后的溶液中加KOH溶液调节pH=8,
的混合溶液的实验方案为:向步骤Ⅰ过滤后的溶液中加KOH溶液调节pH=8, 和
和 的混合溶液。(实验中须用到的试剂:KOH溶液、
的混合溶液。(实验中须用到的试剂:KOH溶液、 溶液、稀硫酸)
溶液、稀硫酸)已知:
ⅰ.常温下,体系中Al(Ⅲ)、Cr(Ⅲ)微粒的分布分数随溶液pH的变化如图下所示(部分无关粒子已略去)。
ⅱ.强碱性条件下Cr(Ⅲ)能被
 氧化为
氧化为 ;酸性条件下
;酸性条件下 能将Cr(Ⅵ)还原为Cr(Ⅲ)。
能将Cr(Ⅵ)还原为Cr(Ⅲ)。
您最近一年使用:0次
10 . 氢能是极具发展潜力的清洁能源,2021年我国制氢量位居世界第一、请回答:
(1)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)= Na3AlH6(s)+
Na3AlH6(s)+ Al(s)+H2(g),△H=+37kJ•mol-1
Al(s)+H2(g),△H=+37kJ•mol-1
Na3AlH6(s)=3NaH(s)+Al(s)+ H2(g),△H=+70.5kJ•mol-1
H2(g),△H=+70.5kJ•mol-1
则NaAlH4(s)=NaH(s)+Al(s)+ H2(g),△H=
H2(g),△H=___________ 。
(2)工业上,常用 与
与 重整制备
重整制备 。500℃时,主要发生下列反应:
。500℃时,主要发生下列反应:
Ⅰ.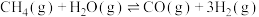 Ⅱ.
Ⅱ.
①已知: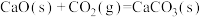
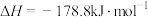 。向重整反应体系中加入适量多孔CaO,其优点是
。向重整反应体系中加入适量多孔CaO,其优点是___________ 。
②下列操作中,能提高CH4(g)平衡转化率的是___________ (填标号)。
A.加催化剂 B.增加CH4(g)用量 C.移除H2(g) D.恒温恒压,通入惰性气体
③500℃、恒压(Po)条件下,1 mol CH4(g)和1 mol H2O(g)反应达平衡时,CH4(g)的转化率为0.5,CO2(g)的物质的量为0.25 mol,则反应Ⅱ的平衡常数KP=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)实现碳达峰、碳中和是贯彻新发展理念的内在要求,因此二氧化碳的合理利用成为研究热点。可用氢气和二氧化碳在催化剂作用下合成甲醇: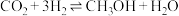 。
。
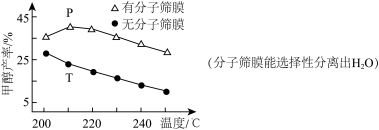
恒压下,CO2和H2的起始物质的量之比为1∶3时,该反应甲醇的平衡产率随温度的变化如图所示。该反应的
___________ 0,甲醇的产率P点高于T点的原因为___________ 。
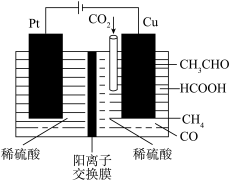
(4)利用电催化可将CO2同时转化为多种燃料,装置如图:铜电极上产生CH4的电极反应式为___________ 。
(1)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:
NaAlH4(s)=
 Na3AlH6(s)+
Na3AlH6(s)+ Al(s)+H2(g),△H=+37kJ•mol-1
Al(s)+H2(g),△H=+37kJ•mol-1Na3AlH6(s)=3NaH(s)+Al(s)+
 H2(g),△H=+70.5kJ•mol-1
H2(g),△H=+70.5kJ•mol-1则NaAlH4(s)=NaH(s)+Al(s)+
 H2(g),△H=
H2(g),△H=(2)工业上,常用
 与
与 重整制备
重整制备 。500℃时,主要发生下列反应:
。500℃时,主要发生下列反应:Ⅰ.
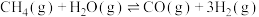 Ⅱ.
Ⅱ.
①已知:
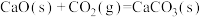
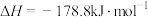 。向重整反应体系中加入适量多孔CaO,其优点是
。向重整反应体系中加入适量多孔CaO,其优点是②下列操作中,能提高CH4(g)平衡转化率的是
A.加催化剂 B.增加CH4(g)用量 C.移除H2(g) D.恒温恒压,通入惰性气体
③500℃、恒压(Po)条件下,1 mol CH4(g)和1 mol H2O(g)反应达平衡时,CH4(g)的转化率为0.5,CO2(g)的物质的量为0.25 mol,则反应Ⅱ的平衡常数KP=
(3)实现碳达峰、碳中和是贯彻新发展理念的内在要求,因此二氧化碳的合理利用成为研究热点。可用氢气和二氧化碳在催化剂作用下合成甲醇:
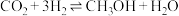 。
。恒压下,CO2和H2的起始物质的量之比为1∶3时,该反应甲醇的平衡产率随温度的变化如图所示。该反应的


(4)利用电催化可将CO2同时转化为多种燃料,装置如图:铜电极上产生CH4的电极反应式为

您最近一年使用:0次



