解题方法
1 . 丙烯(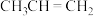 )是重要的有机合成单体,常用丙烷(
)是重要的有机合成单体,常用丙烷( )为原料合成。回答下列问题:
)为原料合成。回答下列问题:
(1)加热条件下,以 和丙烷为原料合成丙烯的反应为
和丙烷为原料合成丙烯的反应为 。
。
①上述反应过程中,能量的变化形式为___________ 。
②其他条件不变,增大压强,丙烷的平衡转化率___________ (填“增大”“减小”或“不变”,下同);升高温度,混合气体的平均摩尔质量___________ 。
(2)在高效催化剂作用下,丙烷脱氢生成丙烯的反应如下: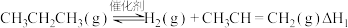 。
。
①已知断裂或形成1mol共价键需要吸收或放出的能量数据如下表所示:
则
___________ 。若该反应的活化能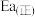 为
为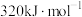 ,则该反应逆反应的活化能
,则该反应逆反应的活化能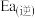 为
为___________  。
。
②其他条件不变时,在不同催化剂(M、N、P)作用下,反应进行相同时间后,丙烷的转化率随反应温度的变化如图所示。500℃时,三种催化剂(M、N、P)的催化活性由高到低的顺序为___________ ;b点丙烷的转化率高于a点的原因是___________ 。

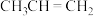 )是重要的有机合成单体,常用丙烷(
)是重要的有机合成单体,常用丙烷( )为原料合成。回答下列问题:
)为原料合成。回答下列问题:(1)加热条件下,以
 和丙烷为原料合成丙烯的反应为
和丙烷为原料合成丙烯的反应为 。
。①上述反应过程中,能量的变化形式为
②其他条件不变,增大压强,丙烷的平衡转化率
(2)在高效催化剂作用下,丙烷脱氢生成丙烯的反应如下:
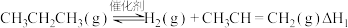 。
。①已知断裂或形成1mol共价键需要吸收或放出的能量数据如下表所示:
| 共价键 |  |  |  |  |
能量( ) ) | 345 | 412 | 615 | 436 |

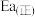 为
为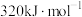 ,则该反应逆反应的活化能
,则该反应逆反应的活化能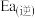 为
为 。
。②其他条件不变时,在不同催化剂(M、N、P)作用下,反应进行相同时间后,丙烷的转化率随反应温度的变化如图所示。500℃时,三种催化剂(M、N、P)的催化活性由高到低的顺序为

您最近一年使用:0次
2 . 某兴趣小组以重铬酸钾(K2Cr2O7)溶液为研究对象,结合所学化学反应原理的知识,来探究改变条件使其发生“色彩变幻”。
已知:① 溶液存在平衡:
溶液存在平衡:
②含铬元素的离子在溶液中的颜色: (橙色);
(橙色); (黄色);
(黄色); (绿色)
(绿色)

(1)ⅰ可证明反应 的正反应是
的正反应是___________ (填“吸热”或“放热”)反应。
(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是___________ 。
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的___________ (填“能”或“不能”),理由是___________ 。
(4)根据实验Ⅱ中不同现象,可以得出的结论是___________ 。
(5)继续实验
实验Ⅲ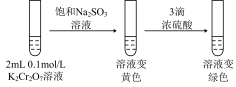
①解释溶液变黄的主要原因是___________ 。
②溶液变绿色,该反应的离子方程式是___________ 。
(6)对于平衡: ,若改变条件使上述平衡向正反应方向移动,则下列说法正确的是___________。
,若改变条件使上述平衡向正反应方向移动,则下列说法正确的是___________。
已知:①
 溶液存在平衡:
溶液存在平衡:
②含铬元素的离子在溶液中的颜色:
 (橙色);
(橙色); (黄色);
(黄色); (绿色)
(绿色)
(1)ⅰ可证明反应
 的正反应是
的正反应是(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的
(4)根据实验Ⅱ中不同现象,可以得出的结论是
(5)继续实验
实验Ⅲ

①解释溶液变黄的主要原因是
②溶液变绿色,该反应的离子方程式是
(6)对于平衡:
 ,若改变条件使上述平衡向正反应方向移动,则下列说法正确的是___________。
,若改变条件使上述平衡向正反应方向移动,则下列说法正确的是___________。A.达到新平衡 的消耗速率等于 的消耗速率等于 的消耗速率 的消耗速率 |
| B.平衡常数K值可能不改变 |
| C.达到新平衡后,溶液pH一定增大 |
| D.再次达平衡前正反应速率一定大于逆反应速率 |
您最近一年使用:0次
3 . 肼(N2H4)是一种应用广泛的化工原料。
(1)发射火箭时用肼为燃料,NO2(g)作氧化剂,两者反应生成氮气和气态水。已知16 g N2H4(g)在上述反应中放出284 kJ的热量,写出该反应的热化学方程式___________ 。
(2)一种以N2H4(g)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。
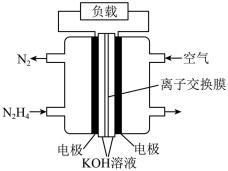
①负极的电极反应式为___________ 。
②电池工作时电子从___________ 电极经过负载后流向___________ 电极(填“左侧”或“右侧”)。
③电池工作时消耗标准状况下2.24 L 空气时,产生N2的质量约为___________ g。
(3)肼和氧气在不同温度和催化剂条件下生成不同产物(如下图):
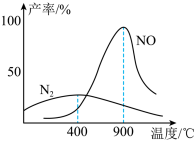
温度较低时主要发生反应a:N2H4(g) + O2(g) = N2(g) + 2H2O(g)
温度较高时主要发生反应b:N2H4(g) + 2O2(g) = 2NO(g) + 2H2O(g)
①反应a的化学平衡常数K的表达式为K=________ 。
②1000℃,反应b达到平衡时,下列措施能使容器中 增大的是
增大的是________ 。
A.恒容条件下,充入N2H4 B.恒压条件下,充入He
C.缩小容器体积 D.使用催化剂
(1)发射火箭时用肼为燃料,NO2(g)作氧化剂,两者反应生成氮气和气态水。已知16 g N2H4(g)在上述反应中放出284 kJ的热量,写出该反应的热化学方程式
(2)一种以N2H4(g)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。

①负极的电极反应式为
②电池工作时电子从
③电池工作时消耗标准状况下2.24 L 空气时,产生N2的质量约为
(3)肼和氧气在不同温度和催化剂条件下生成不同产物(如下图):

温度较低时主要发生反应a:N2H4(g) + O2(g) = N2(g) + 2H2O(g)
温度较高时主要发生反应b:N2H4(g) + 2O2(g) = 2NO(g) + 2H2O(g)
①反应a的化学平衡常数K的表达式为K=
②1000℃,反应b达到平衡时,下列措施能使容器中
 增大的是
增大的是A.恒容条件下,充入N2H4 B.恒压条件下,充入He
C.缩小容器体积 D.使用催化剂
您最近一年使用:0次
名校
解题方法
4 . 二甲醚(CH3OCH3)是一种极具发展潜力的有机化工产品和洁净燃料。由合成气制备二甲醚的主要反应原理如下:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ/molK1
CH3OH(g) △H1=-90.7kJ/molK1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5kJ/molK2
CH3OCH3(g)+H2O(g) △H2=-23.5kJ/molK2
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ/molK3
CO2(g)+H2(g) △H3=-41.2kJ/molK3
回答下列问题:
(1)反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H=
CH3OCH3(g)+CO2(g)的△H=___________ kJ/mol;该反应的平衡常数K=___________ (用K1、K2、K3表示)。
(2)下列措施中,能提高(1)中CH3OCH3产率的有___________ 。
A.使用过量的CO B.升高温度 C.增大压强
(3)600℃时,将0.4molCO和0.2molH2O(g)通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得H2的体积分数为0.2.则0~5min内v(H2O)=___________ ,CO的转化率α(CO)=___________ 。
(4)在600℃时发生反应③,某一时刻测得容器内各物质的浓度分别为c(CO)=0.2mol/L,c(H2O)=0.15mol/L,c(CO2)=0.1mol/L,c(H2)=0.2mol/L,则下一时刻,反应___________ (填“正向进行”、“逆向进行”或“不移动”)。
①CO(g)+2H2(g)
 CH3OH(g) △H1=-90.7kJ/molK1
CH3OH(g) △H1=-90.7kJ/molK1②2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2=-23.5kJ/molK2
CH3OCH3(g)+H2O(g) △H2=-23.5kJ/molK2③CO(g)+H2O(g)
 CO2(g)+H2(g) △H3=-41.2kJ/molK3
CO2(g)+H2(g) △H3=-41.2kJ/molK3回答下列问题:
(1)反应3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)的△H=
CH3OCH3(g)+CO2(g)的△H=(2)下列措施中,能提高(1)中CH3OCH3产率的有
A.使用过量的CO B.升高温度 C.增大压强
(3)600℃时,将0.4molCO和0.2molH2O(g)通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得H2的体积分数为0.2.则0~5min内v(H2O)=
(4)在600℃时发生反应③,某一时刻测得容器内各物质的浓度分别为c(CO)=0.2mol/L,c(H2O)=0.15mol/L,c(CO2)=0.1mol/L,c(H2)=0.2mol/L,则下一时刻,反应
您最近一年使用:0次
5 . 金属铬耐腐蚀,可做镀层金属, 致癌,国家对废水中Cr含量有严格的排放标准。已知:
致癌,国家对废水中Cr含量有严格的排放标准。已知: ;
; ;氧化性强弱:
;氧化性强弱: ;
;
(1)焦亚硫酸钠除铬法
①可以选择焦亚硫酸钠或亚硫酸钠( 在酸性条件下分解为
在酸性条件下分解为 、
、 )处理含铬(Ⅵ)废水,处理费用低。其工艺流程如图:
)处理含铬(Ⅵ)废水,处理费用低。其工艺流程如图:

反应池中发生反应的离子方程式_____ 。
②其他条件相同,pH<2.5时pH过低,充分反应后除铬率反而下降,可能的原因是_____ 。
③室温下,加入石灰乳调节pH,当 时,pH>
时,pH>_____ 。
(2) Fe3O4/纳米Fe除铬法
(i)某研究小组经查阅资料,发现磁铁矿Fe3O4辅助纳米Fe可以降解废水中的 。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。
。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。
(ii)依据如下两个图示信息,上述实验3降解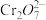 效率增大的原因是
效率增大的原因是_____ 。

(3)电解除铬法:
已知:电解除铬过程中主要反应: ;
;

①图3中气体a的主要成分是_____ 。
②在电解过程中,不同pH、通电时间与Cr元素的去除率关系如图4所示,其中pH=10比pH=4时Cr元素去除率低的原因可能是_____ 。
 致癌,国家对废水中Cr含量有严格的排放标准。已知:
致癌,国家对废水中Cr含量有严格的排放标准。已知: ;
; ;氧化性强弱:
;氧化性强弱: ;
;(1)焦亚硫酸钠除铬法
①可以选择焦亚硫酸钠或亚硫酸钠(
 在酸性条件下分解为
在酸性条件下分解为 、
、 )处理含铬(Ⅵ)废水,处理费用低。其工艺流程如图:
)处理含铬(Ⅵ)废水,处理费用低。其工艺流程如图:
反应池中发生反应的离子方程式
②其他条件相同,pH<2.5时pH过低,充分反应后除铬率反而下降,可能的原因是
③室温下,加入石灰乳调节pH,当
 时,pH>
时,pH>(2) Fe3O4/纳米Fe除铬法
(i)某研究小组经查阅资料,发现磁铁矿Fe3O4辅助纳米Fe可以降解废水中的
 。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。
。为验证其准确性,进行了如下实验,相同时间内得到如下实验结果。| 实验编号 | 纳米Fe(g/L) | Fe3O4 (g/L) |  实际降解率 实际降解率 |
| 1 | 0.05 | 0 | 51.4% |
| 2 | 0 | 2 | 7.12% |
| 3 | 0.05 | 2 | 86.67% |
 效率增大的原因是
效率增大的原因是
(3)电解除铬法:
已知:电解除铬过程中主要反应:
 ;
;
①图3中气体a的主要成分是
②在电解过程中,不同pH、通电时间与Cr元素的去除率关系如图4所示,其中pH=10比pH=4时Cr元素去除率低的原因可能是
您最近一年使用:0次
名校
解题方法
6 . 我国提出2060年达“碳中和”目标,通过反应CO2+H2 HCOOH将CO2转化为高附加值产品HCOOH是实现该目标的一种方式。回答下列问题:
HCOOH将CO2转化为高附加值产品HCOOH是实现该目标的一种方式。回答下列问题:
(1)向恒容密闭容器中充入1molCO2和lmolH2,发生反应:CO2(g)+H2(g) HCOOH(g) △H。测定不同温度下CO2的平衡转化率数据如表所示:
HCOOH(g) △H。测定不同温度下CO2的平衡转化率数据如表所示:
①该反应的△H_______ 0(填“>”或“<”)。已知:2H2(g)+O2(g)=2H2O(g)△H1,则反应2CO2(g)+2H2O(g)  2HCOOH(g)+O2(g)的△H2
2HCOOH(g)+O2(g)的△H2_______ (用△H和△H1表示)。
②下列有利于提高CO2的平衡转化率的措施有_______ (填标号)。
A.增大反应体系的压强 B.增大 C.降低反应温度 D.移出HCOOH
C.降低反应温度 D.移出HCOOH
③373K下,平衡时压强为P,用各物质的平衡分压(分压=总压×物质的量分数)表示该反应的平衡常数Kp=_________ (用含α和P的代数式表示)。
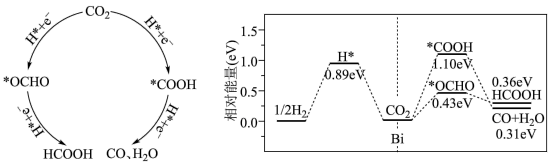
(2)浙江大学某国家实验室用水热法还原CO2转化为HCOOH,探究了不同条件下CO2的转化率,数据如图所示:
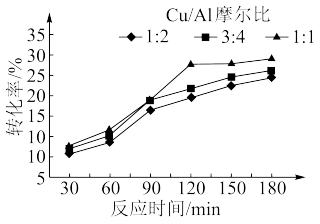
依据以上数据,最佳的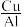 摩尔比和反应时间是
摩尔比和反应时间是______ 。
(3)中国科学院大学以Bi为电极材料,利用电化学催化还原法制备HCOOH。用计算机模拟CO2在电极材料表面发生还原反应的历程如图(*表示微粒与Bi的接触位点):
①HCOOH是________ (填“阴极”或“阳极”)产物,若在该电极消耗22gCO2,则转移电子数目为________ 。
②依据反应历程图中数据,你认为电催化还原CO2生成HCOOH的选择性______ (填“高于”或“低于”)生成CO的选择性,原因是________ 。
 HCOOH将CO2转化为高附加值产品HCOOH是实现该目标的一种方式。回答下列问题:
HCOOH将CO2转化为高附加值产品HCOOH是实现该目标的一种方式。回答下列问题:(1)向恒容密闭容器中充入1molCO2和lmolH2,发生反应:CO2(g)+H2(g)
 HCOOH(g) △H。测定不同温度下CO2的平衡转化率数据如表所示:
HCOOH(g) △H。测定不同温度下CO2的平衡转化率数据如表所示:| T/K | 373 | 473 | 573 | 673 |
| 平衡转化率 | α | 8.4α | 24.3α | 37.5α |
 2HCOOH(g)+O2(g)的△H2
2HCOOH(g)+O2(g)的△H2②下列有利于提高CO2的平衡转化率的措施有
A.增大反应体系的压强 B.增大
 C.降低反应温度 D.移出HCOOH
C.降低反应温度 D.移出HCOOH③373K下,平衡时压强为P,用各物质的平衡分压(分压=总压×物质的量分数)表示该反应的平衡常数Kp=
(2)浙江大学某国家实验室用水热法还原CO2转化为HCOOH,探究了不同条件下CO2的转化率,数据如图所示:

依据以上数据,最佳的
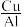 摩尔比和反应时间是
摩尔比和反应时间是(3)中国科学院大学以Bi为电极材料,利用电化学催化还原法制备HCOOH。用计算机模拟CO2在电极材料表面发生还原反应的历程如图(*表示微粒与Bi的接触位点):

①HCOOH是
②依据反应历程图中数据,你认为电催化还原CO2生成HCOOH的选择性
您最近一年使用:0次
名校
7 . CO 变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41 kJ·mol⁻1。
(1)一定温度下,反应后测得各组分的平衡压强(即该组分的物质的量分数×总压): p(CO)=0.25 MPa、p(H2O)=0.25 MPa、p(CO2)=0.75 MPa 和 p(H2)=0.75 MPa,则该反应的平衡常数 Kp=___________ 。维持相同的温度和总压,提高水蒸气的投料比例,使 CO 的平衡转化率提高到 90%,则原料气中水蒸气和 CO 的物质的量之比为___________ 。
(2)生产过程中,为了提高变换反应的速率,下列措施中合适的是___________。
(3)以固体催化剂 M 催化 CO 变换反应,能量-反应过程关系如下图所示。步骤___________ 为决速步。(选填“I”或“II”)

用化学方程式表示该催化反应历程:
步骤 I: M(s)+H2O(g)=MO(s)+H2(g), 步骤 II:___________ 。
(1)一定温度下,反应后测得各组分的平衡压强(即该组分的物质的量分数×总压): p(CO)=0.25 MPa、p(H2O)=0.25 MPa、p(CO2)=0.75 MPa 和 p(H2)=0.75 MPa,则该反应的平衡常数 Kp=
(2)生产过程中,为了提高变换反应的速率,下列措施中合适的是___________。
| A.反应温度越高越好 | B.适当提高反应物压强 |
| C.选择合适的催化剂 | D.通入一定量的 N2 |

用化学方程式表示该催化反应历程:
步骤 I: M(s)+H2O(g)=MO(s)+H2(g), 步骤 II:
您最近一年使用:0次
解题方法
8 . 草酸亚铁晶体( FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.采用如下装置(可重复选用)进行实验探究纯净草酸亚铁晶体受热分解的产物。

(1)装置D的名称为___________ ,作用是_________________________________ 。
(2)按照气流从左到右的方向,上述装置的连接顺序为a→_____________ →d→e→b→c→尾气处理装置(填仪器接口的小字母编号)。
(3)能证明分解产物中存在CO的现象是_____________________ 。
II.将54.0g草酸亚铁晶体在氮气的氛围中加热分解,得到分解产物的热重曲线(样品质量随温度的变化情况)如图所示:

(4)B点时,固体只含有一种铁的氧化物,则所得固体的化学式为__________ 。
Ⅲ.文献表明:相同条件下,草酸根(C2O )的还原性强于Fe2+。为检验这一结论进行以下实验。
)的还原性强于Fe2+。为检验这一结论进行以下实验。
资料:ⅰ.草酸(H2C2O4)为二元弱酸。
ⅱ.三水三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O为翠绿色晶体,光照易分解。其水溶液中存在:[Fe(C2O4)3] 3− Fe3++ 3C2O
Fe3++ 3C2O K=6.3×10−21
K=6.3×10−21
通过Fe3+和C2O 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱
的还原性强弱
(5)取实验中的少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红。加硫酸后溶液变红的原因是__________________________________ 。
(6)经检验,翠绿色晶体为K3[Fe(C2O4)3]·3H2O。请设计实验,确认实验中没有发生氧化还原反应的操作和现象是_____________ 。
I.采用如下装置(可重复选用)进行实验探究纯净草酸亚铁晶体受热分解的产物。

(1)装置D的名称为
(2)按照气流从左到右的方向,上述装置的连接顺序为a→
(3)能证明分解产物中存在CO的现象是
II.将54.0g草酸亚铁晶体在氮气的氛围中加热分解,得到分解产物的热重曲线(样品质量随温度的变化情况)如图所示:

(4)B点时,固体只含有一种铁的氧化物,则所得固体的化学式为
Ⅲ.文献表明:相同条件下,草酸根(C2O
 )的还原性强于Fe2+。为检验这一结论进行以下实验。
)的还原性强于Fe2+。为检验这一结论进行以下实验。资料:ⅰ.草酸(H2C2O4)为二元弱酸。
ⅱ.三水三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O为翠绿色晶体,光照易分解。其水溶液中存在:[Fe(C2O4)3] 3−
 Fe3++ 3C2O
Fe3++ 3C2O K=6.3×10−21
K=6.3×10−21通过Fe3+和C2O
 在溶液中的反应比较Fe2+和C2O
在溶液中的反应比较Fe2+和C2O 的还原性强弱
的还原性强弱| 操作 | 现象 |
| 在避光处,向10mL0.5mol∙L-1FeCl3溶液中缓慢加入0.5mol∙L-1K2C2O4溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤 | 得到翠绿色溶液和翠绿色晶体 |
(6)经检验,翠绿色晶体为K3[Fe(C2O4)3]·3H2O。请设计实验,确认实验中没有发生氧化还原反应的操作和现象是
您最近一年使用:0次
名校
解题方法
9 . 二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2 (g) CH3OH(g) ΔH1=-90.7kJ·mol-1K1
CH3OH(g) ΔH1=-90.7kJ·mol-1K1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1K2
CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1K2
③CO(g)+H2O(g) CO2(g)+H2 (g) ΔH3=-41.2kJ·mol-1K3
CO2(g)+H2 (g) ΔH3=-41.2kJ·mol-1K3
回答下列问题:
(1)反应3H2 (g)+3CO(g) CH3OCH3 (g)+CO2(g)的ΔH=
CH3OCH3 (g)+CO2(g)的ΔH=_____ kJ·mol-1;该反应的平衡常数K=_____ (用K1、K2、K3表示)。随温度的升高,该反应的平衡常数K的变化趋势是_____ (填增大、减小、或不变)
(2)下列措施中,能提高(1)中CH3OCH3产率的有_____ (填字母)。
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,将0.2molCO和0.1molH2O(g)通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得H2的体积分数为0.1.则0~5min内v(H2O)=_____ ,CO的转化率为_____ ,向上述平衡体系中再充入0.2molCO和0.1molH2O(g),再次达到平衡时,H2的体积分数_____ 0.1(填大于、小于、或等于)
(4)将合成气以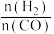 =2通入1L的反应器中,一定条件下发生反应:4H2 (g)+2CO(g)
=2通入1L的反应器中,一定条件下发生反应:4H2 (g)+2CO(g) CH3OCH3 (g)+H2O(g)ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是
CH3OCH3 (g)+H2O(g)ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是_____ (填字母)。
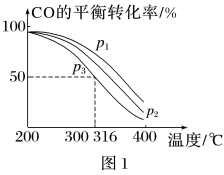
A.ΔH<0
B.p1>p2>p3
C.若在p3和316℃时,起始时 =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%
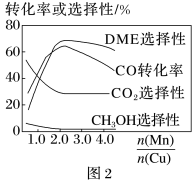
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图2,当 约为
约为_____ 时最有利于二甲醚的合成。
①CO(g)+2H2 (g)
 CH3OH(g) ΔH1=-90.7kJ·mol-1K1
CH3OH(g) ΔH1=-90.7kJ·mol-1K1②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1K2
CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1K2③CO(g)+H2O(g)
 CO2(g)+H2 (g) ΔH3=-41.2kJ·mol-1K3
CO2(g)+H2 (g) ΔH3=-41.2kJ·mol-1K3回答下列问题:
(1)反应3H2 (g)+3CO(g)
 CH3OCH3 (g)+CO2(g)的ΔH=
CH3OCH3 (g)+CO2(g)的ΔH=(2)下列措施中,能提高(1)中CH3OCH3产率的有
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,将0.2molCO和0.1molH2O(g)通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得H2的体积分数为0.1.则0~5min内v(H2O)=
(4)将合成气以
 =2通入1L的反应器中,一定条件下发生反应:4H2 (g)+2CO(g)
=2通入1L的反应器中,一定条件下发生反应:4H2 (g)+2CO(g) CH3OCH3 (g)+H2O(g)ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是
CH3OCH3 (g)+H2O(g)ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是
A.ΔH<0
B.p1>p2>p3
C.若在p3和316℃时,起始时
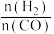 =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图2,当
 约为
约为
您最近一年使用:0次
解题方法
10 . 亚硝酰氯(NOCl)是有机合成中的重要试剂。实验室中可用如下反应合成。
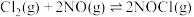

(1)已知 (忽略
(忽略 、
、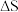 随温度的变化,T为开尔文温度)。上述反应的
随温度的变化,T为开尔文温度)。上述反应的 与温度的关系如下图(该反应的
与温度的关系如下图(该反应的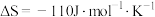 )。
)。

该反应在常温下________ (填“能”或“不能”)自发进行;该反应的
_______  。
。
(2)T°C下,向某真空恒容密闭容器中加入足量的 并充入一定量的NO(g),发生下列反应:
并充入一定量的NO(g),发生下列反应:
反应Ⅰ: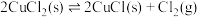

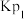
反应Ⅱ:

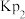
已知:反应Ⅰ、Ⅱ的平衡常数1gKp~T关系如下图:
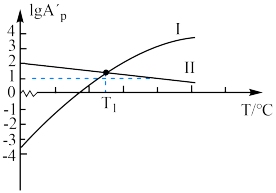
①由图可知,反应Ⅰ反应热
___________ (填“>”或“<”)0。
② °C下,测得起始压强为20kPa,平衡时压强为21kPa,则该温度下NO的平衡转化率为
°C下,测得起始压强为20kPa,平衡时压强为21kPa,则该温度下NO的平衡转化率为_____ %;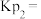
________ 。
(3)向体积均为1L的两恒容容器中分别充入2molNO和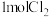 ,发生反应:
,发生反应: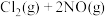
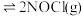 ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。
,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。
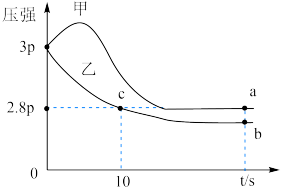
①甲容器中,开始压强变大的原因___________ 。
②乙容器中0~10s内平均反应速率v(NO)=___________ 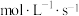 。
。
③a、b、c三点的正反应速率最小的是___________ 点。
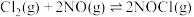

(1)已知
 (忽略
(忽略 、
、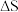 随温度的变化,T为开尔文温度)。上述反应的
随温度的变化,T为开尔文温度)。上述反应的 与温度的关系如下图(该反应的
与温度的关系如下图(该反应的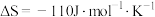 )。
)。
该反应在常温下

 。
。(2)T°C下,向某真空恒容密闭容器中加入足量的
 并充入一定量的NO(g),发生下列反应:
并充入一定量的NO(g),发生下列反应:反应Ⅰ:
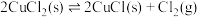

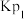
反应Ⅱ:


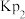
已知:反应Ⅰ、Ⅱ的平衡常数1gKp~T关系如下图:

①由图可知,反应Ⅰ反应热

②
 °C下,测得起始压强为20kPa,平衡时压强为21kPa,则该温度下NO的平衡转化率为
°C下,测得起始压强为20kPa,平衡时压强为21kPa,则该温度下NO的平衡转化率为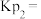
(3)向体积均为1L的两恒容容器中分别充入2molNO和
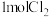 ,发生反应:
,发生反应: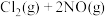
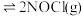 ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。
,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。
①甲容器中,开始压强变大的原因
②乙容器中0~10s内平均反应速率v(NO)=
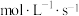 。
。③a、b、c三点的正反应速率最小的是
您最近一年使用:0次



