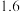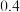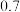名校
1 . 含氯化合物在工农业生产和日常生活中用途十分广泛。
Ⅰ.使用软锰矿为原料精制高纯度的MnO2,并运用综合制取技术最终制取含氯漂白液、漂白粉的工艺流程如图。

(1)过程Ⅳ中,MnO2与浓盐酸反应的离子方程式为______ 。
(2)过程Ⅲ中,MnO2 在___________极产生。
(3)过程Ⅴ制备漂白液(有效成分NaClO)和漂白粉(有效成分Ca(ClO)2)。
①有关漂白粉的说法正确的是:______ 。
A.漂白粉是混合物,其有效成分是次氯酸钙
B.为了增强漂白粉漂白效果,使用时可加少量食醋
C.漂白粉见光不稳定,应当避光放置
D.漂白粉可与CO2 、 H2O 反应,由此可判断次氯酸的酸性弱于碳酸
②漂白液与洁厕灵(主要成分为浓盐酸)禁止混用的原因(用离子方程式表示):______ 。
Ⅱ.氯气可用于海水提溴,其工艺流程如图。

(4)进入吹出塔前海水与Cl2发生反应时往往向其中滴入一些稀硫酸,原因为________ 。
(5)从吸收塔流出的溶液中主要含的负离子有___________。
Ⅲ.为探究氯气的性质,某同学设计了如图所示的实验装置。

(6)A为氯气制备装置,装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,请提出合理的改进方法:________ 。E中的反应的离子方程方程式为________ 。
(7)为验证尾气吸收后的溶液中存在Cl-,正确的操作是________ 。
Ⅰ.使用软锰矿为原料精制高纯度的MnO2,并运用综合制取技术最终制取含氯漂白液、漂白粉的工艺流程如图。

(1)过程Ⅳ中,MnO2与浓盐酸反应的离子方程式为
(2)过程Ⅲ中,MnO2 在___________极产生。
| A.正极 | B.负极 | C.阳极 | D.阴极 |
(3)过程Ⅴ制备漂白液(有效成分NaClO)和漂白粉(有效成分Ca(ClO)2)。
①有关漂白粉的说法正确的是:
A.漂白粉是混合物,其有效成分是次氯酸钙
B.为了增强漂白粉漂白效果,使用时可加少量食醋
C.漂白粉见光不稳定,应当避光放置
D.漂白粉可与CO2 、 H2O 反应,由此可判断次氯酸的酸性弱于碳酸
②漂白液与洁厕灵(主要成分为浓盐酸)禁止混用的原因(用离子方程式表示):
Ⅱ.氯气可用于海水提溴,其工艺流程如图。

(4)进入吹出塔前海水与Cl2发生反应时往往向其中滴入一些稀硫酸,原因为
(5)从吸收塔流出的溶液中主要含的负离子有___________。
| A.OH- | B.Br- | C. | D. |
Ⅲ.为探究氯气的性质,某同学设计了如图所示的实验装置。

(6)A为氯气制备装置,装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,请提出合理的改进方法:
(7)为验证尾气吸收后的溶液中存在Cl-,正确的操作是
您最近一年使用:0次
名校
2 . NOx储存还原技术法(NSR)利用催化剂消除汽车尾气中的NOx,其原理: △H。
△H。
(1)已知:① △H1;②
△H1;②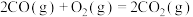 △H2;用含△H1和△H2的代数式表示△H=
△H2;用含△H1和△H2的代数式表示△H=___________ kJ⋅mol-1.汽车发动机工作时,会引发反应①,其能量变化如图所示。则△H1=___________ kJ⋅mol-1。

(2)NSR反应机理及相对能量如下图(TS表示过渡态):

反应过程中,决速步骤的热化学方程式为___________ 。
(3)在一定温度下,向2L恒容密闭容器中充入等物质的量的NO和CO模拟NSR反应,反应过程中c(NO)随时间变化的曲线如下图所示。

线a和b中,表示在该温度下使用NSR催化技术的是曲线_________ (选填“a”或“b”)。线a中前5min内CO的平均反应速率v(CO)=________ ;此温度下该反应的平衡常数K=_________ 。
(4)保持其他条件不变,平衡后再向容器中充入CO和N2各0.8mol,则此时v(正)________ v(逆)(选填“>”“<”或“=”)。
(5)若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是点___________ (选填“A”“B”“C”“D”或“E”)。
 △H。
△H。(1)已知:①
 △H1;②
△H1;②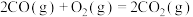 △H2;用含△H1和△H2的代数式表示△H=
△H2;用含△H1和△H2的代数式表示△H=
(2)NSR反应机理及相对能量如下图(TS表示过渡态):

反应过程中,决速步骤的热化学方程式为
(3)在一定温度下,向2L恒容密闭容器中充入等物质的量的NO和CO模拟NSR反应,反应过程中c(NO)随时间变化的曲线如下图所示。

线a和b中,表示在该温度下使用NSR催化技术的是曲线
(4)保持其他条件不变,平衡后再向容器中充入CO和N2各0.8mol,则此时v(正)
(5)若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是点
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题。
(1)为探究 与
与 的还原性强弱,取适量制得的
的还原性强弱,取适量制得的 晶体,进行如下实验:
晶体,进行如下实验:
将适量 加入
加入 溶液中,若观察到
溶液中,若观察到___________ ,则可证明还原性 ;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:
;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:___________ 。
(2)为了证明 可以氧化
可以氧化 溶液中的
溶液中的 ,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:___________

(1)为探究
 与
与 的还原性强弱,取适量制得的
的还原性强弱,取适量制得的 晶体,进行如下实验:
晶体,进行如下实验:将适量
 加入
加入 溶液中,若观察到
溶液中,若观察到 ;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:
;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:(2)为了证明
 可以氧化
可以氧化 溶液中的
溶液中的 ,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
您最近一年使用:0次
解题方法
4 . 某生产中, 还原
还原 的工艺包括以下反应:
的工艺包括以下反应:
Ⅰ.
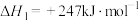
Ⅱ.

Ⅲ.

回答下列问题:
(1)
______ 。
(2)恒温恒容条件下,将 的混合气充入密闭容器中发生反应Ⅱ,下列有关说法正确的是
的混合气充入密闭容器中发生反应Ⅱ,下列有关说法正确的是______ (填标号)。
a.当 ,说明反应达到平衡
,说明反应达到平衡
b.平衡时,容器内 比值保持不变
比值保持不变
c.平衡时,向容器中充入惰性气体,平衡逆向移动
(3)图甲、乙分别表示反应Ⅲ在 时刻达到平衡,在
时刻达到平衡,在 时刻因改变某一条件而发生变化的情况:
时刻因改变某一条件而发生变化的情况:

甲中 时刻改变的条件是
时刻改变的条件是_____________ ;乙中 时刻改变的条件是
时刻改变的条件是____________ ,判断依据是__________________ 。
(4) ,向容积为
,向容积为 的密闭容器中加入等物质的量的
的密闭容器中加入等物质的量的 和
和 发生反应Ⅲ,
发生反应Ⅲ, 和
和 物质的量变化如下表所示。
物质的量变化如下表所示。
 内,
内,
______ ; 时,
时, 的转化率为
的转化率为____________ ;达平衡时,再充入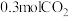 和
和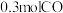 ,上述平衡将
,上述平衡将____________ (填“正向”“逆向”或“不”)移动。
 还原
还原 的工艺包括以下反应:
的工艺包括以下反应:Ⅰ.

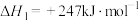
Ⅱ.


Ⅲ.


回答下列问题:
(1)

(2)恒温恒容条件下,将
 的混合气充入密闭容器中发生反应Ⅱ,下列有关说法正确的是
的混合气充入密闭容器中发生反应Ⅱ,下列有关说法正确的是a.当
 ,说明反应达到平衡
,说明反应达到平衡b.平衡时,容器内
 比值保持不变
比值保持不变c.平衡时,向容器中充入惰性气体,平衡逆向移动
(3)图甲、乙分别表示反应Ⅲ在
 时刻达到平衡,在
时刻达到平衡,在 时刻因改变某一条件而发生变化的情况:
时刻因改变某一条件而发生变化的情况:
甲中
 时刻改变的条件是
时刻改变的条件是 时刻改变的条件是
时刻改变的条件是(4)
 ,向容积为
,向容积为 的密闭容器中加入等物质的量的
的密闭容器中加入等物质的量的 和
和 发生反应Ⅲ,
发生反应Ⅲ, 和
和 物质的量变化如下表所示。
物质的量变化如下表所示。时间 | 0 |
|
|
|
|
|
|
|
|
|
|
| 0 |
|
|
|
|
 内,
内,
 时,
时, 的转化率为
的转化率为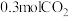 和
和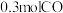 ,上述平衡将
,上述平衡将
您最近一年使用:0次
解题方法
5 . Ⅰ.在0.1 mol·L-1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O +H2O
+H2O 2HCrO
2HCrO
 2CrO
2CrO +2H+
+2H+
(1)在强碱溶液中,铬元素的主要存在形式为___________ (填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中c(Cr2O )/c(CrO
)/c(CrO )将
)将___________ (填“增大”、“减小”或“不变”)。
Ⅱ.已知某溶液中只存在OH-、H+、 、Cl-四种离子,某同学推测该溶液中各离子浓度大小 顺序可能有如下四种关系:并按要求填写下列空白:
、Cl-四种离子,某同学推测该溶液中各离子浓度大小 顺序可能有如下四种关系:并按要求填写下列空白:
①c(Cl-)>c( )>c(H+)>c(OH-) ②c(Cl-)>c(
)>c(H+)>c(OH-) ②c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c( )>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c( )>c(OH-)
)>c(OH-)
(2)若溶液中只溶解了一种溶质,则该溶质是___________ ,上述四种离子浓度的大小顺序为___________ (选填序号)。
(3)若上述关系中③是正确的,则溶液中的溶质为___________ ;
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)___________ c(NH3·H2O) (填“大于”“小于”或“等于”)。
Ⅲ.用酸碱中和滴定法测定某市售白醋(含 ,是一元弱酸)的总酸量。实验步骤如下:
,是一元弱酸)的总酸量。实验步骤如下:
(5)①量取10.00mL市售白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得稀释白醋溶液。取该稀释白醋溶液20.00mL于锥形瓶中,向其中滴加几滴___________ 作指示剂。
②用0.1000mol/L NaOH溶液滴定,当___________ 时,停止滴定,并记录NaOH溶液的最终读数。重复滴定4次。
③实验记录如下:
按上述数处理,可得c(市售白醋)=___________ mol/L。
④在本实验的滴定过程中,下列操作会使实验结果偏高的是___________ (填字母)。
A.碱式滴定管在滴定时未用NaOH标准溶液润洗
B.锥形瓶在滴定时剧烈摇动,有少量液体测出
C.锥形瓶中加入待测稀释白醋溶液后,再加少量水
D.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
E.滴定终点读数时俯视
 +H2O
+H2O 2HCrO
2HCrO
 2CrO
2CrO +2H+
+2H+(1)在强碱溶液中,铬元素的主要存在形式为
 )/c(CrO
)/c(CrO )将
)将Ⅱ.已知某溶液中只存在OH-、H+、
 、Cl-四种离子,某同学推测该溶液中各离子浓度大小 顺序可能有如下四种关系:并按要求填写下列空白:
、Cl-四种离子,某同学推测该溶液中各离子浓度大小 顺序可能有如下四种关系:并按要求填写下列空白:①c(Cl-)>c(
 )>c(H+)>c(OH-) ②c(Cl-)>c(
)>c(H+)>c(OH-) ②c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)③c(
 )>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c( )>c(OH-)
)>c(OH-)(2)若溶液中只溶解了一种溶质,则该溶质是
(3)若上述关系中③是正确的,则溶液中的溶质为
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
Ⅲ.用酸碱中和滴定法测定某市售白醋(含
 ,是一元弱酸)的总酸量。实验步骤如下:
,是一元弱酸)的总酸量。实验步骤如下:(5)①量取10.00mL市售白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得稀释白醋溶液。取该稀释白醋溶液20.00mL于锥形瓶中,向其中滴加几滴
②用0.1000mol/L NaOH溶液滴定,当
③实验记录如下:
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(稀释白醋)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
 (NaOH)/mL (NaOH)/mL | 15.00 | 15.04 | 14.96 | 16.52 |
④在本实验的滴定过程中,下列操作会使实验结果偏高的是
A.碱式滴定管在滴定时未用NaOH标准溶液润洗
B.锥形瓶在滴定时剧烈摇动,有少量液体测出
C.锥形瓶中加入待测稀释白醋溶液后,再加少量水
D.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
E.滴定终点读数时俯视
您最近一年使用:0次
6 . 研究 的综合利用对促进“低碳经济”的发展有重要意义。
的综合利用对促进“低碳经济”的发展有重要意义。
Ⅰ.人类活动排放过量的 会造成海水酸化,进而使海洋生态系统面临巨大威胁。有研究者题出,用下图方法从海水中提取
会造成海水酸化,进而使海洋生态系统面临巨大威胁。有研究者题出,用下图方法从海水中提取 。
。
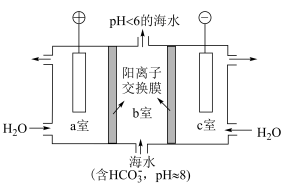
(1)c室发生的电极反应式为________ 。
(2)a室产生的______ 透过离子交换膜进入b室,与b室中的 发生反应,离子方程式为
发生反应,离子方程式为________ 。
Ⅱ. 与
与 合成二甲醚
合成二甲醚 是一种
是一种 转化的方法,其过程中主要发生下列反应:
转化的方法,其过程中主要发生下列反应:
反应①:
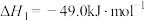
反应②:
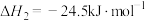
反应③:
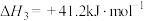
(3)写出 与
与 一步合成二甲醚(反应④)的热化学方程式:
一步合成二甲醚(反应④)的热化学方程式:________ 。
(4)有利于提高反应④平衡转化率的条件是_________(填字母)。
(5)在恒压、 和
和 起始物质的量之比为1:3的条件下,
起始物质的量之比为1:3的条件下, 平衡转化率和平衡时二甲醚的选择性随温度的变化如图所示。
平衡转化率和平衡时二甲醚的选择性随温度的变化如图所示。

 的选择性
的选择性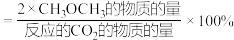 。
。
关于合成二甲醚工艺的理解,下列说法正确的是___________(填字母)。
(6)一定温度下,向容积为2L的恒容密闭容器中充入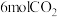 和
和 ,仅发生反应Ⅰ:
,仅发生反应Ⅰ:
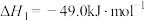 ,测得
,测得 随时间的变化如图曲线Ⅰ所示。下列说法正确的是_________。
随时间的变化如图曲线Ⅰ所示。下列说法正确的是_________。
 的综合利用对促进“低碳经济”的发展有重要意义。
的综合利用对促进“低碳经济”的发展有重要意义。Ⅰ.人类活动排放过量的
 会造成海水酸化,进而使海洋生态系统面临巨大威胁。有研究者题出,用下图方法从海水中提取
会造成海水酸化,进而使海洋生态系统面临巨大威胁。有研究者题出,用下图方法从海水中提取 。
。
(1)c室发生的电极反应式为
(2)a室产生的
 发生反应,离子方程式为
发生反应,离子方程式为Ⅱ.
 与
与 合成二甲醚
合成二甲醚 是一种
是一种 转化的方法,其过程中主要发生下列反应:
转化的方法,其过程中主要发生下列反应:反应①:

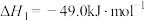
反应②:

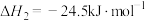
反应③:

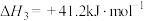
(3)写出
 与
与 一步合成二甲醚(反应④)的热化学方程式:
一步合成二甲醚(反应④)的热化学方程式:(4)有利于提高反应④平衡转化率的条件是_________(填字母)。
| A.高温高压 | B.低温低压 | C.高温低压 | D.低温高压 |
(5)在恒压、
 和
和 起始物质的量之比为1:3的条件下,
起始物质的量之比为1:3的条件下, 平衡转化率和平衡时二甲醚的选择性随温度的变化如图所示。
平衡转化率和平衡时二甲醚的选择性随温度的变化如图所示。
 的选择性
的选择性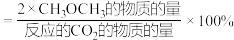 。
。关于合成二甲醚工艺的理解,下列说法正确的是___________(填字母)。
A.反应④在A点和B点时的化学平衡常数: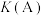 小于 小于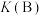 |
B.当温度、压强一定时,在原料气( 和 和 的比例不变)中添加少量惰性气体,有利于提高平衡转化率 的比例不变)中添加少量惰性气体,有利于提高平衡转化率 |
| C.其他条件不变,在恒容条件下的二甲醚平衡选择性比恒压条件下的平衡选择性低 |
| D.提高催化剂的活性和选择性,减少CO等副产物是工艺的关键 |
(6)一定温度下,向容积为2L的恒容密闭容器中充入
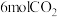 和
和 ,仅发生反应Ⅰ:
,仅发生反应Ⅰ:
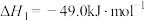 ,测得
,测得 随时间的变化如图曲线Ⅰ所示。下列说法正确的是_________。
随时间的变化如图曲线Ⅰ所示。下列说法正确的是_________。
A.该反应在0~8min内 的平均反应速率是 的平均反应速率是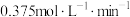 |
| B.改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气 |
C.保持温度不变,若起始时向上述容器中充入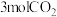 和 和 ,则平衡时 ,则平衡时 的体积分数等于20% 的体积分数等于20% |
D.保持温度不变,若起始时向上述容器中充入 、 、 、 、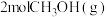 和 和 ,则此时反应向正反应方向进行。 ,则此时反应向正反应方向进行。 |
您最近一年使用:0次
名校
解题方法
7 . Ⅰ.近年来我国大力加强温室气体 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
(1)已知: 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式: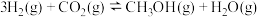
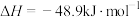 。
。
①总压分别为100kPa、10kPa 时发生该反应,平衡体系中CO2和CH3OH的物质的量分数随温度变化关系如图所示。

100 kPa时,CO2和CH3OH的物质的量分数随温度变化关系的曲线分别是____ 、____ 。
②某温度下,在刚性容器中充入n(H2):n(CO2)=3:1,起始压强为12 kPa,平衡时总压为8 kPa,该反应的平衡常数Kp=_____ kPa (用分压代替平衡浓度,分压=总压×物质的量分数)。
(2)为提高 的产率,理论上应采用的条件是_____(填序号)。
的产率,理论上应采用的条件是_____(填序号)。
(3)催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下四组实验数据:
根据上表所给数据,用 生产甲醇的最优条件为
生产甲醇的最优条件为______ (填实验编号)。
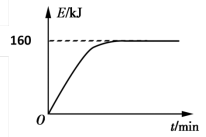
(4)CO2也能与CH4制备合成气,反应原理是CH4(g)+CO2(g) 2CO(g)+2H2(g),若1 g CH4(g)完全反应吸收热量为15kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为
2CO(g)+2H2(g),若1 g CH4(g)完全反应吸收热量为15kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为______ %(保留一位小数)。
Ⅱ.甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯。已知相关物质的燃烧热如下表:
(5)写出表示乙烯燃烧热的热化学方程式:________ 。
(6)甲烷脱氢反应2CH4(g) ⇌ C2H4(g)+2H2(g) △H=_____
Ⅲ.温度为T1时,在一个容积均为1L的密闭容器中仅发生反应: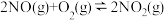
 。实验测得:v正=v (NO)消耗=2v (O2)消耗=k正c2(NO)·c(O2),v逆=v (NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。
。实验测得:v正=v (NO)消耗=2v (O2)消耗=k正c2(NO)·c(O2),v逆=v (NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。
(7)温度为T1时,
______ (填数据);当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m___ n(填“>”、“<”或“=”)
(8)T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数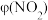 随
随 的变化如图所示,当
的变化如图所示,当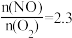 时,达到平衡时
时,达到平衡时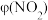 可能是D、E、F三点中的
可能是D、E、F三点中的____ 。
 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:(1)已知:
 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式: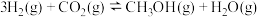
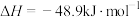 。
。①总压分别为100kPa、10kPa 时发生该反应,平衡体系中CO2和CH3OH的物质的量分数随温度变化关系如图所示。

100 kPa时,CO2和CH3OH的物质的量分数随温度变化关系的曲线分别是
②某温度下,在刚性容器中充入n(H2):n(CO2)=3:1,起始压强为12 kPa,平衡时总压为8 kPa,该反应的平衡常数Kp=
(2)为提高
 的产率,理论上应采用的条件是_____(填序号)。
的产率,理论上应采用的条件是_____(填序号)。| A.高温高压 | B.低温低压 | C.高温低压 | D.低温高压 |
| 实验编号 | 温度/K | 催化剂 |  的转化率/% 的转化率/% | 甲醇的选择性/% |
| A | 543 | 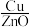 纳米棒 纳米棒 | 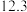 |  |
| B | 543 | 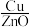 纳米片 纳米片 | 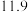 | 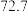 |
| C | 553 | 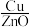 纳米棒 纳米棒 | 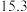 | 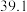 |
| D | 553 | 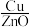 纳米片 纳米片 | 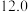 |  |
 生产甲醇的最优条件为
生产甲醇的最优条件为(4)CO2也能与CH4制备合成气,反应原理是CH4(g)+CO2(g)
 2CO(g)+2H2(g),若1 g CH4(g)完全反应吸收热量为15kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为
2CO(g)+2H2(g),若1 g CH4(g)完全反应吸收热量为15kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为
Ⅱ.甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯。已知相关物质的燃烧热如下表:
| 物质 | 氢气 | 甲烷 | 乙烯 |
| 燃烧热(kJ∙mol−1) | 286 | 890 | 1411 |
(6)甲烷脱氢反应2CH4(g) ⇌ C2H4(g)+2H2(g) △H=
Ⅲ.温度为T1时,在一个容积均为1L的密闭容器中仅发生反应:
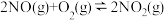
 。实验测得:v正=v (NO)消耗=2v (O2)消耗=k正c2(NO)·c(O2),v逆=v (NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。
。实验测得:v正=v (NO)消耗=2v (O2)消耗=k正c2(NO)·c(O2),v逆=v (NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。| 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | ||
| c(NO) | c(O2) | c(NO2) | c(O2) |
| 0.6 | 0.3 | 0 | 0.2 |

(8)T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数
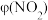 随
随 的变化如图所示,当
的变化如图所示,当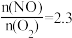 时,达到平衡时
时,达到平衡时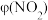 可能是D、E、F三点中的
可能是D、E、F三点中的
您最近一年使用:0次
解题方法
8 . 太阳能甲烷—水蒸气重整制氢技术因具有原料储量丰富、成本低、产量高等特点而被广泛采用。制氢的反应为 。
。
(1)已知:几种化学键的键能(键能为 气态分子离解成气态原子所吸收的能量或气态原子形成
气态分子离解成气态原子所吸收的能量或气态原子形成 气态分子所释放的能量)如下表。
气态分子所释放的能量)如下表。
反应: 的
的
______  。
。
(2)加压使 平衡转化率降低,但工业生产中仍采用较高的压强,原因可能是
平衡转化率降低,但工业生产中仍采用较高的压强,原因可能是____________ (填一条即可,下同),为弥补加压带来的不利因素,可采取的措施为______ 。
(3) 下,向
下,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和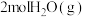 ,发生上述反应,
,发生上述反应, 达平衡,
达平衡, 的平衡转化率为
的平衡转化率为 。
。
① 内,
内,
______  。
。
②
______ 。
③平衡后保持温度和容积不变,若再向容器中充入 和
和 ,此时
,此时
______ (选填“>”、“<”或“=”)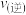 。
。
 。
。(1)已知:几种化学键的键能(键能为
 气态分子离解成气态原子所吸收的能量或气态原子形成
气态分子离解成气态原子所吸收的能量或气态原子形成 气态分子所释放的能量)如下表。
气态分子所释放的能量)如下表。化学键 |
|
|
|
|
键能 | 413 | 463 | 436 | 1071 |
 的
的
 。
。(2)加压使
 平衡转化率降低,但工业生产中仍采用较高的压强,原因可能是
平衡转化率降低,但工业生产中仍采用较高的压强,原因可能是(3)
 下,向
下,向 恒容密闭容器中充入
恒容密闭容器中充入 和
和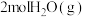 ,发生上述反应,
,发生上述反应, 达平衡,
达平衡, 的平衡转化率为
的平衡转化率为 。
。①
 内,
内,
 。
。②

③平衡后保持温度和容积不变,若再向容器中充入
 和
和 ,此时
,此时
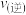 。
。
您最近一年使用:0次
解题方法
9 . Ⅰ.含硫化合物是实验室和工业上的常用化学品。请回答:
(1)实验室可用铜与浓硫酸反应制备少量 :
: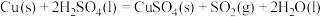
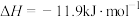 。判断该反应的自发性并说明理由
。判断该反应的自发性并说明理由___________ 。
(2)已知
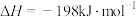 。850K时,在一恒容密闭反应器中充入一定量的
。850K时,在一恒容密闭反应器中充入一定量的 和
和 ,当反应达到平衡后测得
,当反应达到平衡后测得 、
、 和
和 的浓度分别为
的浓度分别为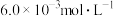 、
、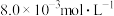 和
和 。
。
①该温度下反应的平衡常数为___________ 。
②平衡时 的转化率为
的转化率为___________ 。
(3)工业上主要采用接触法由含硫矿石制备硫酸。
①下列说法不正确的是___________ 。
A.须采用高温高压的反应条件使 氧化为
氧化为
B.进入接触室之前的气流无需净化处理
C.通入过量的空气可以提高含硫矿石和 的转化率
的转化率
D.在吸收塔中宜采用水或稀硫酸吸收 以提高吸收速率
以提高吸收速率
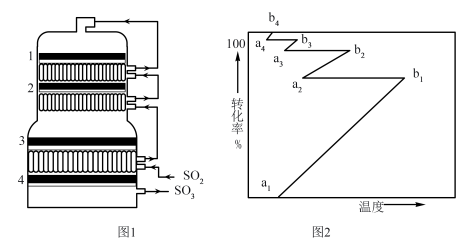
②接触室结构如图1所示,其中1~4表示催化剂层。图2所示进程中表示热交换过程的是___________ 。
A. B.
B. C.
C. D.
D. E.
E. F.
F. G.
G.
Ⅱ.一定条件下,用 、NiO或
、NiO或 作催化剂对燃煤烟气回收。反应为
作催化剂对燃煤烟气回收。反应为
 。
。
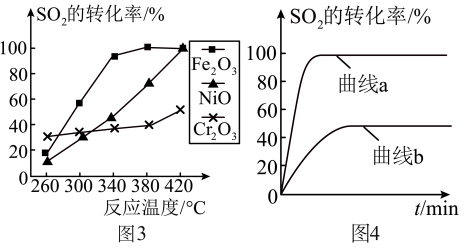
(4)其他条件相同、催化剂不同, 的转化率随反应温度的变化如图3,
的转化率随反应温度的变化如图3, 和NiO作催化剂均能使
和NiO作催化剂均能使 的转化率达到最高,不考虑催化剂价格因素,选择
的转化率达到最高,不考虑催化剂价格因素,选择 的主要优点是:
的主要优点是:___________ 。
(5)某科研小组用 作催化剂。在380℃时,分别研究了
作催化剂。在380℃时,分别研究了 为1:1、3:1时
为1:1、3:1时 转化率的变化情况图4。则图4中表示
转化率的变化情况图4。则图4中表示 的变化曲线为
的变化曲线为___________ 。
(1)实验室可用铜与浓硫酸反应制备少量
 :
:
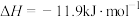 。判断该反应的自发性并说明理由
。判断该反应的自发性并说明理由(2)已知

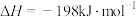 。850K时,在一恒容密闭反应器中充入一定量的
。850K时,在一恒容密闭反应器中充入一定量的 和
和 ,当反应达到平衡后测得
,当反应达到平衡后测得 、
、 和
和 的浓度分别为
的浓度分别为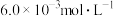 、
、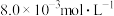 和
和 。
。①该温度下反应的平衡常数为
②平衡时
 的转化率为
的转化率为(3)工业上主要采用接触法由含硫矿石制备硫酸。
①下列说法不正确的是
A.须采用高温高压的反应条件使
 氧化为
氧化为
B.进入接触室之前的气流无需净化处理
C.通入过量的空气可以提高含硫矿石和
 的转化率
的转化率D.在吸收塔中宜采用水或稀硫酸吸收
 以提高吸收速率
以提高吸收速率②接触室结构如图1所示,其中1~4表示催化剂层。图2所示进程中表示热交换过程的是

A.
 B.
B. C.
C. D.
D. E.
E. F.
F. G.
G.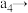
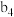
Ⅱ.一定条件下,用
 、NiO或
、NiO或 作催化剂对燃煤烟气回收。反应为
作催化剂对燃煤烟气回收。反应为
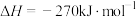 。
。(4)其他条件相同、催化剂不同,
 的转化率随反应温度的变化如图3,
的转化率随反应温度的变化如图3, 和NiO作催化剂均能使
和NiO作催化剂均能使 的转化率达到最高,不考虑催化剂价格因素,选择
的转化率达到最高,不考虑催化剂价格因素,选择 的主要优点是:
的主要优点是:(5)某科研小组用
 作催化剂。在380℃时,分别研究了
作催化剂。在380℃时,分别研究了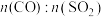 为1:1、3:1时
为1:1、3:1时 转化率的变化情况图4。则图4中表示
转化率的变化情况图4。则图4中表示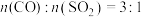 的变化曲线为
的变化曲线为
您最近一年使用:0次
名校
解题方法
10 . 某研究小组查阅资料发现 与
与 的反应具有可逆性,推测亚铁盐与饱和碘水的混合液中会存在
的反应具有可逆性,推测亚铁盐与饱和碘水的混合液中会存在 ,并据此设计实验1(如图所示),发现溶液未变红。该小组对溶液未变红的原因进行了如下探究。
,并据此设计实验1(如图所示),发现溶液未变红。该小组对溶液未变红的原因进行了如下探究。

I、初步探究
实验2:用煮沸后的蒸馏水重新配制两种饱和溶液,并在注射器中进行实验,记录如下表。
(1)研究小组同学根据查阅资料写出的 与
与 反应的离子方程式为
反应的离子方程式为_____ 。
(2)小组同学做出推断:反应速率不是导致实验1中溶液未变红的主要原因,他们的理由是_____ 。
Ⅱ、查阅资料,继续探究。
资料: 为不溶于水的白色固体。
为不溶于水的白色固体。
实验3:

(3)试管a的实验现象说明滤液1中含有_____ 。
(4)试管b中,加入 溶液后所产生实验现象的原因是
溶液后所产生实验现象的原因是_____ 。
(5)甲同学对实验3提出了质疑,认为其实验现象并不能证明 氧化了
氧化了 。他提出如下假设:
。他提出如下假设:
i、可能是 氧化了
氧化了 ;
;
ii、可能是空气中的 氧化了
氧化了 。
。
他设计实施了实验4,实验记录如下表。
①试剂a是_____ 。
②依据实验4,甲同学做出判断:假设_____ 不成立。
(6)根据实验1~4可得实验1溶液未变红的原因是_____ 。
 与
与 的反应具有可逆性,推测亚铁盐与饱和碘水的混合液中会存在
的反应具有可逆性,推测亚铁盐与饱和碘水的混合液中会存在 ,并据此设计实验1(如图所示),发现溶液未变红。该小组对溶液未变红的原因进行了如下探究。
,并据此设计实验1(如图所示),发现溶液未变红。该小组对溶液未变红的原因进行了如下探究。
I、初步探究
实验2:用煮沸后的蒸馏水重新配制两种饱和溶液,并在注射器中进行实验,记录如下表。
| 编号 | 饱和 溶液 溶液 | 饱和碘水 | 操作 |  溶液 溶液 | 现象 |
| 2-1 | 1滴 |  | 不加热 | 1滴 | 无明显现象 |
| 2-2 | 1滴 |  | 加热一段时间后冷却 | 1滴 | 无明显现象 |
(1)研究小组同学根据查阅资料写出的
 与
与 反应的离子方程式为
反应的离子方程式为(2)小组同学做出推断:反应速率不是导致实验1中溶液未变红的主要原因,他们的理由是
Ⅱ、查阅资料,继续探究。
资料:
 为不溶于水的白色固体。
为不溶于水的白色固体。实验3:

(3)试管a的实验现象说明滤液1中含有
(4)试管b中,加入
 溶液后所产生实验现象的原因是
溶液后所产生实验现象的原因是(5)甲同学对实验3提出了质疑,认为其实验现象并不能证明
 氧化了
氧化了 。他提出如下假设:
。他提出如下假设:i、可能是
 氧化了
氧化了 ;
;ii、可能是空气中的
 氧化了
氧化了 。
。他设计实施了实验4,实验记录如下表。
| 编号 | 实验操作 | 实验现象 |
| 4 | 在试管中加入1滴 溶液, 溶液, 蒸馏水,1滴试剂a,一段时间后加入1滴 蒸馏水,1滴试剂a,一段时间后加入1滴 溶液 溶液 | 溶液不变红 |
②依据实验4,甲同学做出判断:假设
(6)根据实验1~4可得实验1溶液未变红的原因是
您最近一年使用:0次