名校
1 . N2(g)+3H2(g) 2NH3(g) △H<0,反应达平衡时,下列措施能提高N2转化率的是
2NH3(g) △H<0,反应达平衡时,下列措施能提高N2转化率的是
①降温 ②恒压通入惰性气体 ③增加N2的浓度 ④加压 ⑤催化剂
 2NH3(g) △H<0,反应达平衡时,下列措施能提高N2转化率的是
2NH3(g) △H<0,反应达平衡时,下列措施能提高N2转化率的是①降温 ②恒压通入惰性气体 ③增加N2的浓度 ④加压 ⑤催化剂
| A.①④ | B.①②③⑤ | C.②③⑤ | D.③④ |
您最近半年使用:0次
2 . CH3CHO在NaOH溶液作用下制取2-丁烯醛的历程如下: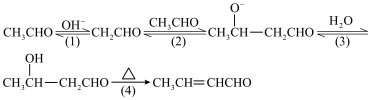
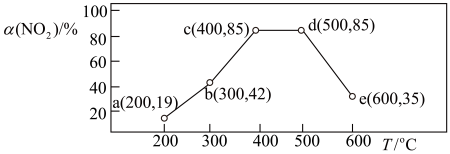
下列说法
| A.OH-是该反应的催化剂 |
B.CH3CHO分子中甲基上的“ ”比 ”比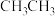 中的“ 中的“ ”更易电离出H+ ”更易电离出H+ |
| C.反应(4)加热失水有利于反应(3)平衡正向移动 |
| D.CH3CHO与CH3CH2CHO的混合液在NaOH溶液作用下最多可得到2种羟基醛 |
您最近半年使用:0次
名校
3 . 下列有关实验探究方案设计合理的是
| 选项 | 实验方案 | 实验目的 |
| A | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4和FeCl3溶液,观察气体产生的速率 | 比较Cu2+和Fe3+的催化效果 |
| B | 先将注射器充满NO2气体,然后将活塞往里推,压缩体积,观察注射器内气体颜色先变深后变浅 | 验证压强对平衡的影响 |
| C | 在锥形瓶内各盛有2g锌粒(颗粒大小基本相同),然后通过分液漏斗分别加入40mL1mol·L-1和40mL18mol·L-1的硫酸,比较两者收集10mL氢气所用的时间
| 探究硫酸浓度对反应速率的影响 |
| D | 在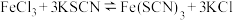 平衡体系中加入KCl晶体,观察并比较实验现象 平衡体系中加入KCl晶体,观察并比较实验现象 | 探究离子浓度对平衡移动的影响 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
4 . 氮及其化合物在工农业生产、生活中有着重要作用。
1.下列元素中电负性最大的是____。
2.NH3和PH3都具有四面体结构,NH3比PH3的分解温度高的原因是____。
3.配合物Ni(CO)4也具有四面体结构,常温下Ni(CO)4为液态,易溶于CCl4、苯等有机溶剂。写出基态Ni的电子排布式____ ;Ni(CO)4属于____ 晶体。
4.Zn(NH3)42+离子也具有四面体结构,Zn2+可提供4个能量最低的空轨道与NH3参与形成配位键,这4个空轨道是____。
氨在某催化剂作用下只发生如下反应:
主反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =-905kJ/mol
4NO(g)+6H2O(g) △H =-905kJ/mol
副反应:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H =-1268kJ/mol
2N2(g)+6H2O(g) △H =-1268kJ/mol
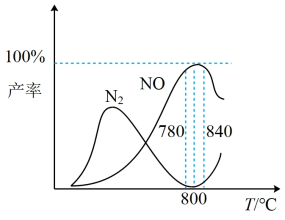
有关物质产率与温度的关系如图。_________ 。
6.工业上采用物料比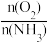 在1.7~2.0,主要目的是:
在1.7~2.0,主要目的是:______________ 。
7.下列说法正确的是______________ 。
A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
C. 选择合适的催化剂,可以大幅度提高NO在最终产物中的比率
8.一定温度下,在3.0L密闭容器中,通入0.10molCH4和0.20molNO2进行反应,CH4(g)+2NO2(g) CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:
表中数据计算0~4min内υ(NO2)=_________ 。
9.在一恒容密闭容器中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率 [α(NO2)/%] 如下图;c点___ (填“是”或“不是”)反应达平衡的点。d点之后,转化率随温度升高而降低的原因是___ 。
1.下列元素中电负性最大的是____。
| A.N | B.P | C.Si | D.C |
| A.NH3分子间有氢键 | B.NH3分子极性强 |
| C.N-H键键能大于P-H键 | D.氨极易液化 |
4.Zn(NH3)42+离子也具有四面体结构,Zn2+可提供4个能量最低的空轨道与NH3参与形成配位键,这4个空轨道是____。
| A.3p | B.3d | C.4s | D.4p |
氨在某催化剂作用下只发生如下反应:
主反应:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H =-905kJ/mol
4NO(g)+6H2O(g) △H =-905kJ/mol副反应:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H =-1268kJ/mol
2N2(g)+6H2O(g) △H =-1268kJ/mol有关物质产率与温度的关系如图。
6.工业上采用物料比
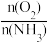 在1.7~2.0,主要目的是:
在1.7~2.0,主要目的是:7.下列说法正确的是
A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
C. 选择合适的催化剂,可以大幅度提高NO在最终产物中的比率
8.一定温度下,在3.0L密闭容器中,通入0.10molCH4和0.20molNO2进行反应,CH4(g)+2NO2(g)
 CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO2(g)+N2(g)+2H2O(g) △H <0,反应时间(t)与容器内气体总压强(p)的数据见下表:| 时间(t/min) | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强(p/100kPa) | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
9.在一恒容密闭容器中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率 [α(NO2)/%] 如下图;c点
您最近半年使用:0次
名校
5 . 将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:[Co(H2O)6]2++4Cl- [CoCl4]2-+6H2O ΔH。用该溶液做实验,溶液的颜色变化如下:
[CoCl4]2-+6H2O ΔH。用该溶液做实验,溶液的颜色变化如下:
下列结论和解释正确的是
 [CoCl4]2-+6H2O ΔH。用该溶液做实验,溶液的颜色变化如下:
[CoCl4]2-+6H2O ΔH。用该溶液做实验,溶液的颜色变化如下: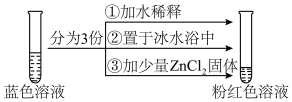
下列结论和解释正确的是
| A.[Co(H2O)6]2+配位数为6,中心离子为Co2+,配位原子为H |
| B.由实验①可知平衡逆向移动 |
| C.由实验②可推知ΔH<0 |
| D.由实验③可知配离子的稳定性:[ZnCl4]2-< [CoCl4]2- |
您最近半年使用:0次
名校
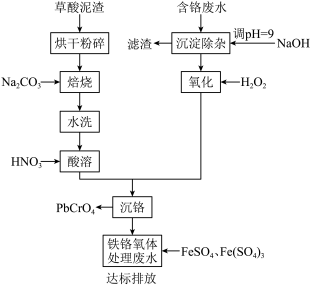
6 . 铬酸铅俗称铬黄,主要用于油漆、油墨、塑料以及橡胶等行业。一种以含铬废水(含Cr3+、Fe3+、Cu2+)和草酸泥渣(含草酸铅、硫酸铅)为原料制备铬酸铅的工艺流程如下:
回答下列问题
(1)草酸泥渣“粉碎”的目的是___________ ,“焙烧”时加入碳酸钠是为了将硫酸铅转化为PbO,同时放出CO2,该转化过程的化学方程式为___________ 。
(2)滤渣的主要成分为___________ 、___________ 。(填化学式)
(3)“沉淀除杂”所得滤液中含铬化合物主要为___________ 。(填化学式)
(4)“氧化”工序中发生反应的离子方程式为___________ 。
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因:___________ 。
(6)处理含 的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为___________ mol。

回答下列问题
(1)草酸泥渣“粉碎”的目的是
(2)滤渣的主要成分为
(3)“沉淀除杂”所得滤液中含铬化合物主要为
(4)“氧化”工序中发生反应的离子方程式为
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因:
(6)处理含
 的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
您最近半年使用:0次
2024-04-21更新
|
130次组卷
|
2卷引用:东北三省四城市联考暨沈阳市高三下学期质量监测(二)化学试题
2024高三下·全国·专题练习
解题方法
7 . 钒是重要的战略资源,以硫酸工业产生的废钒催化剂为原料(含 、
、 、
、 、
、 以及少量的
以及少量的 等),综合回收利用钒、硅、钾实现变废为宝、保护环境的目的,回收工艺流程如下:
等),综合回收利用钒、硅、钾实现变废为宝、保护环境的目的,回收工艺流程如下: 、
、 存在,
存在, 增大时
增大时 可转化为
可转化为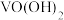 沉淀。
沉淀。
“萃取”时选择有机萃取剂,原理是: (有机层)
(有机层)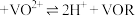 (有机层),“反萃取”应选择在
(有机层),“反萃取”应选择在___________ 环境中进行(选填“酸性”、“中性”或“碱性”)。
 、
、 、
、 、
、 以及少量的
以及少量的 等),综合回收利用钒、硅、钾实现变废为宝、保护环境的目的,回收工艺流程如下:
等),综合回收利用钒、硅、钾实现变废为宝、保护环境的目的,回收工艺流程如下: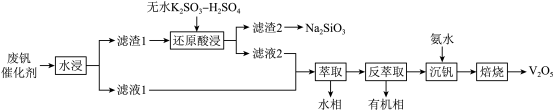
 、
、 存在,
存在, 增大时
增大时 可转化为
可转化为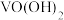 沉淀。
沉淀。“萃取”时选择有机萃取剂,原理是:
 (有机层)
(有机层)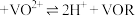 (有机层),“反萃取”应选择在
(有机层),“反萃取”应选择在
您最近半年使用:0次
2024高三下·全国·专题练习
8 . 推动 的综合利用、实现碳中和是党中央作出的重大战略决策。
的综合利用、实现碳中和是党中央作出的重大战略决策。
(1) 一定条件可转化为
一定条件可转化为 ,
,
②恒压下,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,分子筛膜能选择性分离出 。P点甲醇产率高于T点的原因为
。P点甲醇产率高于T点的原因为___________ 。 与丙烯催化合成甲基丙烯酸。催化剂在温度不同时对
与丙烯催化合成甲基丙烯酸。催化剂在温度不同时对 转化率的影响如图所示,
转化率的影响如图所示, 时
时 转化率低于
转化率低于 和
和 的原因可能为
的原因可能为___________ 。
 的综合利用、实现碳中和是党中央作出的重大战略决策。
的综合利用、实现碳中和是党中央作出的重大战略决策。(1)
 一定条件可转化为
一定条件可转化为 ,
,
②恒压下,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,分子筛膜能选择性分离出
 。P点甲醇产率高于T点的原因为
。P点甲醇产率高于T点的原因为
 与丙烯催化合成甲基丙烯酸。催化剂在温度不同时对
与丙烯催化合成甲基丙烯酸。催化剂在温度不同时对 转化率的影响如图所示,
转化率的影响如图所示, 时
时 转化率低于
转化率低于 和
和 的原因可能为
的原因可能为
您最近半年使用:0次
2024高三下·全国·专题练习
9 . 丙烯是三大合成材料的基本原料之一,可用于生产多种重要有机化工原料。由丙烷制丙烯的两种方法如下:
I.丙烷无氧脱氢法:
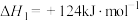
II.丙烷氧化脱氢法: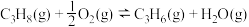

请回答下列问题:
(1)对于反应I,下列条件有利于提高 的平衡转化率的是___________(填字母)
的平衡转化率的是___________(填字母)
(2)某温度下,在刚性密闭容器中充入 发生反应I,起始压强为
发生反应I,起始压强为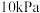 ,平衡时总压强为
,平衡时总压强为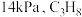 的平衡转化率为
的平衡转化率为___________ 。
(3)一定压强下,向密闭容器中充入一定量的 和
和 ,发生反应
,发生反应
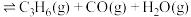 ,
, 的平衡转化率在不同投料比
的平衡转化率在不同投料比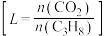 下与温度的关系如图所示,投料比L由小到大的顺序为
下与温度的关系如图所示,投料比L由小到大的顺序为___________ ,判断依据是___________ 。 等副产物,在催化剂的作用下,
等副产物,在催化剂的作用下, 的转化率和
的转化率和 的产率随温度的变化关系如图所示,
的产率随温度的变化关系如图所示, 的选择性:550℃
的选择性:550℃___________ 575℃(填“>”或“<”)。
I.丙烷无氧脱氢法:

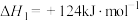
II.丙烷氧化脱氢法:
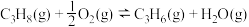

请回答下列问题:
(1)对于反应I,下列条件有利于提高
 的平衡转化率的是___________(填字母)
的平衡转化率的是___________(填字母)| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
 发生反应I,起始压强为
发生反应I,起始压强为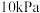 ,平衡时总压强为
,平衡时总压强为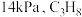 的平衡转化率为
的平衡转化率为(3)一定压强下,向密闭容器中充入一定量的
 和
和 ,发生反应
,发生反应
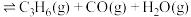 ,
, 的平衡转化率在不同投料比
的平衡转化率在不同投料比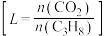 下与温度的关系如图所示,投料比L由小到大的顺序为
下与温度的关系如图所示,投料比L由小到大的顺序为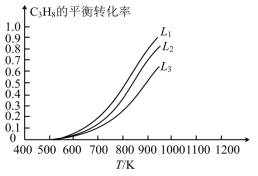
 等副产物,在催化剂的作用下,
等副产物,在催化剂的作用下, 的转化率和
的转化率和 的产率随温度的变化关系如图所示,
的产率随温度的变化关系如图所示, 的选择性:550℃
的选择性:550℃
您最近半年使用:0次
解题方法
10 . 室温下,1体积的水能溶解约2体积的Cl2.用试管收集Cl2后进行如图所示实验,下列对实验现象的分析或预测正确的是
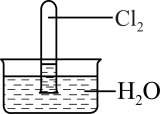
| A.试管内液面上升,证明Cl2与水发生了反应 |
| B.取出试管中的溶液,加入少量CaCO3粉末,溶液漂白能力减弱 |
C.取出试管中的溶液,光照一段时间后pH下降,与反应2HClO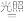 2HCl+O2↑有关 2HCl+O2↑有关 |
| D.取出试管中的溶液,滴加紫色石蕊溶液,溶液先变红后褪色,加热后颜色又变为红色 |
您最近半年使用:0次




