1 . 大气中 能通过高温下与
能通过高温下与 反应进行协同转化处理。反应原理为:
反应进行协同转化处理。反应原理为: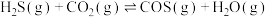 ,工业中测得的产物中有
,工业中测得的产物中有 、
、 、CO等副产物。
、CO等副产物。
(1)一定温度下,在恒容密闭容器中发生以上反应,下列条件能判断反应达到平衡状态的是___________。
(2)在573K下,向2L恒容密闭容器中通入2mol 和1mol
和1mol  ,反应达到平衡后水蒸气的物质的量分数为0.2。
,反应达到平衡后水蒸气的物质的量分数为0.2。
①上述条件下 的平衡转化率
的平衡转化率
___________ %。
②在上述平衡体系中再加2mol 和2mol
和2mol  ,通过数据说明平衡移动的方向
,通过数据说明平衡移动的方向___________ 。
(3)在不同温度下,向密闭容器甲、乙中分别充入2mol 和1mol
和1mol  ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。___________ 。
A.甲 B.乙 C.甲、乙中任一个
②1173K以后平衡转化率变化的原因可能是___________ 。
 能通过高温下与
能通过高温下与 反应进行协同转化处理。反应原理为:
反应进行协同转化处理。反应原理为: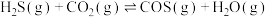 ,工业中测得的产物中有
,工业中测得的产物中有 、
、 、CO等副产物。
、CO等副产物。(1)一定温度下,在恒容密闭容器中发生以上反应,下列条件能判断反应达到平衡状态的是___________。
A.容器内 不再生成 不再生成 | B.容器内压强不再发生变化 |
| C.容器内气体密度不再发生变化 | D. |
(2)在573K下,向2L恒容密闭容器中通入2mol
 和1mol
和1mol  ,反应达到平衡后水蒸气的物质的量分数为0.2。
,反应达到平衡后水蒸气的物质的量分数为0.2。①上述条件下
 的平衡转化率
的平衡转化率
②在上述平衡体系中再加2mol
 和2mol
和2mol  ,通过数据说明平衡移动的方向
,通过数据说明平衡移动的方向(3)在不同温度下,向密闭容器甲、乙中分别充入2mol
 和1mol
和1mol  ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。
A.甲 B.乙 C.甲、乙中任一个
②1173K以后平衡转化率变化的原因可能是
您最近半年使用:0次
2 . 根据实验目的,下列实验操作及现象与结论均正确的是
| 选项 | 实验目的 | 实验操作及现象 | 结论 |
| A | 比较CH3COO-和 的水解常数 的水解常数 | 分别测浓度均为0.1mol·L-1的CH3COONH4和NaHCO3溶液的pH, 后者大于前者 | Kh(CH3COO-)<Kh( ) ) |
| B | 验证Cl2与H2O的反应存在限度 | 取两份新制氯水,分别滴加AgNO3溶液和淀粉-KI溶液,前者有白色沉淀,后者溶液变蓝色 | 氯气与水的反应存在限度 |
| C | 探究氢离子浓度对 (黄色)。 (黄色)。 (橙红色)相互转化的影响 (橙红色)相互转化的影响 | 向K2CrO4溶液中缓慢滴加硫酸溶液,黄色变为橙红色 | 增大c(H+),转化平衡向生成 的方向移动 的方向移动 |
| D | 比较AgCl与AgI的溶度积大小 | 向2mL0.1 AgNO3溶液中先滴加4滴0.1 AgNO3溶液中先滴加4滴0.1 KCl溶液,再滴加4滴0.1 KCl溶液,再滴加4滴0.1 KI溶液,先产生白色沉淀,再产生黄色沉淀 KI溶液,先产生白色沉淀,再产生黄色沉淀 | AgCl转化为AgI,AgI的溶度积小于AgCl的 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
3 . 在恒温恒容条件下将一定量NO2和N2O4的混合气体通入密闭容器中,发生反应。反应中各组分浓度随时间变化关系如图。下列说法中正确的是
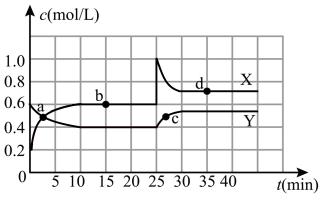
| A.前10 min内用v(NO2)表示的化学反应速率为 0.04 mol/(L•min) |
| B.a点,用v(NO2)表示的化学反应速率等于用v(N2O4)表示的化学反应速率 |
| C.a、b、c、d 四个点中,只有b点的化学反应处于平衡态 |
| D.25 min 时,导致平衡移动的原因是升高温度 |
您最近半年使用:0次
名校
4 . 环己烯是工业常用的化工原料。工业上通过热铂基催化剂重整将环己烷脱氢制备环己烯,其热化学方程式为
 。
。
(1)几种共价键的键能数据如下:
则a=_______  。
。
(2)在恒温恒容密闭容器中充入环己烷气体,仅发生上述反应。下列叙述正确的是_______ (填字母)。
a.混合气体的密度不随时间变化时说明该反应达到平衡状态
b.平衡后再充入环己烷气体,平衡向右移动
c.加入高效催化剂,单位时间内环己烯的产率可能会增大
d.增大固体催化剂的质量,一定能提高正、逆反应速率
(3)环己烷的平衡转化率和环己烯的选择性(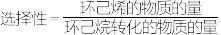 )随温度的变化如图所示:
)随温度的变化如图所示:
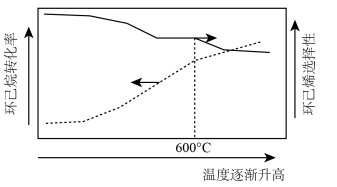
①随着温度升高,环己烷平衡转化率增大的原因是_______ 。
②当温度高于600℃时,可能的副产物有_______ (任写出其中一种结构简式)。
(4)在873K、100kPa条件下,向反应器中充入氩气和环己烷的混合气体,仅发生反应: 。
。
①环己烷的平衡转化率随 的增大而
的增大而_______ (填“升高”或“降低”或“不变”),其原因是_______ 。
②当 时,达到平衡所需时间为20min,环己烷的平衡转化率为
时,达到平衡所需时间为20min,环己烷的平衡转化率为 ,则平衡时环己烷的分压为
,则平衡时环己烷的分压为_______ kPa(保留2位小数),该环己烷脱氢反应的压强平衡常数
_______ kPa(保留2位小数)。[注:用分压计算的平衡常数为压强平衡常数( ),分压=总压×物质的量分数]
),分压=总压×物质的量分数]

 。
。(1)几种共价键的键能数据如下:
| 共价键 |  |  |  |  |
键能/ | 436 | 413 | 348 | a |
 。
。(2)在恒温恒容密闭容器中充入环己烷气体,仅发生上述反应。下列叙述正确的是
a.混合气体的密度不随时间变化时说明该反应达到平衡状态
b.平衡后再充入环己烷气体,平衡向右移动
c.加入高效催化剂,单位时间内环己烯的产率可能会增大
d.增大固体催化剂的质量,一定能提高正、逆反应速率
(3)环己烷的平衡转化率和环己烯的选择性(
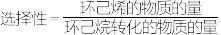 )随温度的变化如图所示:
)随温度的变化如图所示:
①随着温度升高,环己烷平衡转化率增大的原因是
②当温度高于600℃时,可能的副产物有
(4)在873K、100kPa条件下,向反应器中充入氩气和环己烷的混合气体,仅发生反应:
 。
。①环己烷的平衡转化率随
 的增大而
的增大而②当
 时,达到平衡所需时间为20min,环己烷的平衡转化率为
时,达到平衡所需时间为20min,环己烷的平衡转化率为 ,则平衡时环己烷的分压为
,则平衡时环己烷的分压为
 ),分压=总压×物质的量分数]
),分压=总压×物质的量分数]
您最近半年使用:0次
名校
5 . 下列叙述不能用勒夏特列原理解释的是
| A.氯气在饱和食盐水中的溶解度比在水中小 |
| B.利用TiCl4水解制备TiO2时,需加入大量水并加热 |
| C.由H2、I2(g)和HI组成的平衡体系,加压后颜色变深 |
| D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置后溶液颜色变浅或褪去 |
您最近半年使用:0次
名校
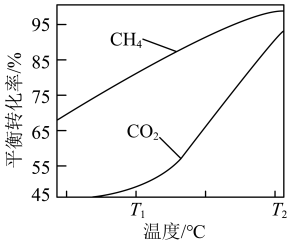
6 . 已知CH4-CO2重整制氢的主要反应如下:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ: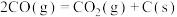

 下,将
下,将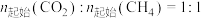 的混合气体置于密闭容器中时,在不同温度下重整体系中CH4和CO2的平衡转化率如右图所示(T2>T1)。下列说法正确的是
的混合气体置于密闭容器中时,在不同温度下重整体系中CH4和CO2的平衡转化率如右图所示(T2>T1)。下列说法正确的是
反应Ⅰ:


反应Ⅱ:


反应Ⅲ:
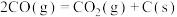

 下,将
下,将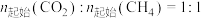 的混合气体置于密闭容器中时,在不同温度下重整体系中CH4和CO2的平衡转化率如右图所示(T2>T1)。下列说法正确的是
的混合气体置于密闭容器中时,在不同温度下重整体系中CH4和CO2的平衡转化率如右图所示(T2>T1)。下列说法正确的是
A.由图可知 |
| B.向重整体系中通入适量的H2O(g),不能减少C(s)的生成 |
| C.选择合适的催化剂可以提高T1时CH4的平衡转化率 |
D.相对 时, 时, 温度下 温度下 和 和 的转化率接近的主要原因是从 的转化率接近的主要原因是从 到 到 反应Ⅱ变化幅度大于反应Ⅲ变化幅度 反应Ⅱ变化幅度大于反应Ⅲ变化幅度 |
您最近半年使用:0次
名校
7 . 实验室以活性炭为催化剂,由CoCl2·6H2O制备[Co(NH3)6]Cl3的流程如下。

已知:Co2+在pH=9.4时完全沉淀为Co(OH)2。
下列说法错误的是

已知:Co2+在pH=9.4时完全沉淀为Co(OH)2。
下列说法错误的是
| A.步骤①中NH4Cl可抑制NH3·H2O电离,防止生成Co(OH)2 |
B.步骤②中的反应为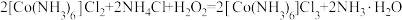 |
| C.温度越高,越有利于[Co(NH3)6]Cl3的生成 |
| D.步骤③中加入浓盐酸,降低了[Co(NH3)6]Cl3在水中的溶解度 |
您最近半年使用:0次
名校
8 . CO2是一种温室气体,对人类的生存环境产生巨大的影响,将CO2作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l) H2O(l)+NH2CONH2(l) ΔH=
H2O(l)+NH2CONH2(l) ΔH=___________ kJ/mol。
Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(2)制备“合成气”反应历程分两步:
上述反应中C(ads)为吸附性活性炭,反应历程的能量图变化如下图所示:
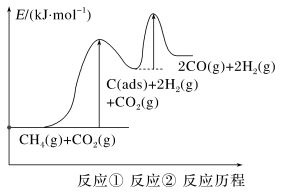
①反应速率快慢比较:反应①___________ 反应②(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因___________ 。
②一定温度下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=___________ (用k1、k2、k3、k4表示)。
(3)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:
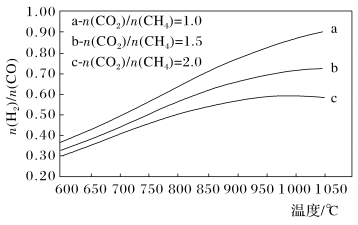
随着进料比 的增加,
的增加, 的值
的值___________ (填“增大”、“不变”或“减小”),其原因是___________ 。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l)
 H2O(l)+NH2CONH2(l) ΔH=
H2O(l)+NH2CONH2(l) ΔH=Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。(2)制备“合成气”反应历程分两步:
| 步骤 | 反应 | 正反应速率方程 | 逆反应速率方程 |
| 反应① | CH4(g) C(ads)+2H2(g) C(ads)+2H2(g) | v正=k1·c(CH4) | v逆=k2·c2(H2) |
| 反应② | C(ads)+CO2(g) 2CO(g) 2CO(g) | v正=k3·c(CO2) | v逆=k4·c2(CO) |

①反应速率快慢比较:反应①
②一定温度下,反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=(3)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:
随着进料比
 的增加,
的增加, 的值
的值
您最近半年使用:0次
名校
9 . 在 催化作用下发生反应:
催化作用下发生反应: 。其反应的机理如下图所示。下列说法不正确的是
。其反应的机理如下图所示。下列说法不正确的是
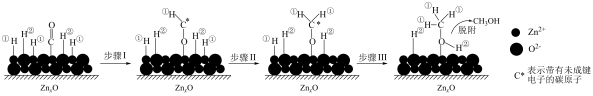
 催化作用下发生反应:
催化作用下发生反应: 。其反应的机理如下图所示。下列说法不正确的是
。其反应的机理如下图所示。下列说法不正确的是
A.吸附在 上的H带正电荷 上的H带正电荷 |
| B.步骤Ⅰ、Ⅱ、Ⅲ均吸收能量 |
C.该过程中有s—  键的形成 键的形成 |
D.合成 过程中不断分离出 过程中不断分离出 ,有利于平衡正向移动 ,有利于平衡正向移动 |
您最近半年使用:0次
名校
10 . 含铬化合物在生产生活中有着广泛的用途。利用含铬废液(主要含Cr3+、Cl-、K+、 等)可制备强氧化剂K2Cr2O7。
等)可制备强氧化剂K2Cr2O7。

已知:pH>6.5时Cr(Ⅵ)主要以 的形式存在,pH<6.5时Cr(Ⅵ)主要以
的形式存在,pH<6.5时Cr(Ⅵ)主要以 的形式存在。
的形式存在。
(1)含铬废液中存在Cr3+,该微粒的核外电子排布式为___________ 。
(2)写出调节pH的为12时Cr3+被氧化为Cr(Ⅵ)的离子方程式:___________ 。
(3)加稀硫酸至溶液pH约为1,若“酸化”前不将溶液煮沸,则K2Cr2O7产率明显偏低,原因是___________ 。
(4)利用K2Cr2O7制备Cr2O3。向密闭反应釜中加入1L1mol/L K2Cr2O7溶液,再加入蔗糖(C12H22O11)充分反应生成Cr(OH)3、K2CO3和CO2。焙烧Cr(OH)3得到Cr2O3。理论上需要向反应釜中加入蔗糖的物质的量为___________ 。
(5)利用K2Cr2O7滴定法测定钢渣(主要含有Fe、Fe2O3、FeO及少量惰性杂质)中Fe的含量的方法如下:取钢渣样品0.2500g,加入足量FeCl3溶液充分反应(Fe2O3、FeO及惰性杂质不反应)后过滤,洗涤滤渣。将洗涤液与滤液合并,用0.1000mol/L K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液20.00mL。计算钢渣中Fe的质量分数_______ (写出计算过程,结果保留1位小数)。
 等)可制备强氧化剂K2Cr2O7。
等)可制备强氧化剂K2Cr2O7。
已知:pH>6.5时Cr(Ⅵ)主要以
 的形式存在,pH<6.5时Cr(Ⅵ)主要以
的形式存在,pH<6.5时Cr(Ⅵ)主要以 的形式存在。
的形式存在。(1)含铬废液中存在Cr3+,该微粒的核外电子排布式为
(2)写出调节pH的为12时Cr3+被氧化为Cr(Ⅵ)的离子方程式:
(3)加稀硫酸至溶液pH约为1,若“酸化”前不将溶液煮沸,则K2Cr2O7产率明显偏低,原因是
(4)利用K2Cr2O7制备Cr2O3。向密闭反应釜中加入1L1mol/L K2Cr2O7溶液,再加入蔗糖(C12H22O11)充分反应生成Cr(OH)3、K2CO3和CO2。焙烧Cr(OH)3得到Cr2O3。理论上需要向反应釜中加入蔗糖的物质的量为
(5)利用K2Cr2O7滴定法测定钢渣(主要含有Fe、Fe2O3、FeO及少量惰性杂质)中Fe的含量的方法如下:取钢渣样品0.2500g,加入足量FeCl3溶液充分反应(Fe2O3、FeO及惰性杂质不反应)后过滤,洗涤滤渣。将洗涤液与滤液合并,用0.1000mol/L K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液20.00mL。计算钢渣中Fe的质量分数
您最近半年使用:0次



