名校
解题方法
1 . 常见的锂离子聚合物电池材料有石墨、LiCl、LiAsF6、LiPF6等。回答下列问题:
(1)Li、O、P、As四种元素电负性由大到小的顺序为___ (填元素符号);H2O、PH3的沸点关系为H2O___ (填“>”、“<”或“=”,下同)PH3;PH3、AsH3的键角大小关系为PH3___ AsH3。
(2)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。

①Li+与X的空腔大小相近,恰好能进入到X的环内,且与氧原子的一对孤电子对作用形成如图所示的稳定结构W。基态碳原子的价电子轨道表示式为___ 。W中Li+与孤对电子之间的作用属于___ (填标号)。
A.离子键 B.金属键 C.氢键 D.配位键
②冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构,理由是___ 。
(3)一种类石墨的聚合物g—C3N4可由三聚氰胺(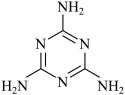 )制得。三聚氰胺分子中环上的氮原子杂化类型是
)制得。三聚氰胺分子中环上的氮原子杂化类型是___ ;三聚氰胺分子不溶于冷水,溶于热水,主要原因是___ 。
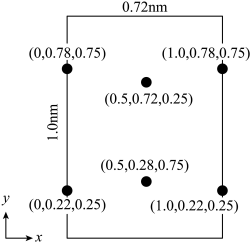
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,记为原子坐标。LiCl·3H2O属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Cl原子的分布图和原子坐标。据此推断该晶胞中Cl原子的数目为___ 。LiCl·3H2O的摩尔质量为Mg·mol-1,设NA为阿伏加德罗常数的值,则LiCl·3H2O晶体的密度为___ g·cm-3(列出计算表达式,不必化简)。
(1)Li、O、P、As四种元素电负性由大到小的顺序为
(2)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。

①Li+与X的空腔大小相近,恰好能进入到X的环内,且与氧原子的一对孤电子对作用形成如图所示的稳定结构W。基态碳原子的价电子轨道表示式为
A.离子键 B.金属键 C.氢键 D.配位键
②冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构,理由是
(3)一种类石墨的聚合物g—C3N4可由三聚氰胺(
 )制得。三聚氰胺分子中环上的氮原子杂化类型是
)制得。三聚氰胺分子中环上的氮原子杂化类型是(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,记为原子坐标。LiCl·3H2O属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Cl原子的分布图和原子坐标。据此推断该晶胞中Cl原子的数目为

您最近一年使用:0次
解题方法
2 . 回答下列问题:
(1)某二价金属离子有9个价电子,价电子的能级为3d。该元素位于周期表中的第四周期、第_______ 族。
(2)在氰酸钾(KOCN)的组成元素中,第一电离能最大的是_______ (填元素符号、下同)、电负性最小的是_______ ;其中阴离子的空间结构是_______ ,C的杂化方式为_______ 。
(3)将少量无水硫酸铜溶解在水中,形成蓝色溶液,再加入过量氨水,溶液变为蓝色。深蓝色离子的结构如图所示,1mol该离子中所含 键为
键为_______ mol(包括配位键);向深蓝色溶液中缓慢加入乙醇,得到蓝色晶体,加热该晶体先失去组分b的原因是_______
(4)已知阿伏加德罗常数为NA,立方硫化锌(M=97g/mol)晶胞如图所示:

其晶胞棱长为δpm、则其密度为_______ g/cm3(用含δ的代数式表示);其中顶点位置a的S2-离子与其相邻位置b的Zn2+离子之间的距离为_______ pm(用含δ的代数式表示)。b位置的Zn2+离子的原子分数坐标为:_______ 。(已知:1m=102cm=1012pm)
(1)某二价金属离子有9个价电子,价电子的能级为3d。该元素位于周期表中的第四周期、第
(2)在氰酸钾(KOCN)的组成元素中,第一电离能最大的是
(3)将少量无水硫酸铜溶解在水中,形成蓝色溶液,再加入过量氨水,溶液变为蓝色。深蓝色离子的结构如图所示,1mol该离子中所含
 键为
键为
(4)已知阿伏加德罗常数为NA,立方硫化锌(M=97g/mol)晶胞如图所示:

其晶胞棱长为δpm、则其密度为
您最近一年使用:0次
名校
3 . 短周期主族元素X、Y、Z、W的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法不正确的是( )

| A.Y、Z、W三种元素电负性:W>Z>Y |
| B.Y、Z、W三种元素的第一电离能:W>Z>Y |
| C.Y、Z、W与氢元素均可形成含非极性键的二元化合物 |
| D.由X、Y、Z、W构成的化合物中可能含有离子键 |
您最近一年使用:0次
2020-11-25更新
|
489次组卷
|
5卷引用:山东省济南市第一中学2021届高三上学期期中考试化学试题
解题方法
4 . 铂(Pt)及其化合物用途广泛。
(1)在元素周期表中,铂元素与铁元素同族,则铂元素位于______ 。
A.s区 B.p区 C.d区 D.ds区 E.f区
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体。科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①Cl-的最外层电子排布式为______ 。
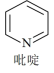
②吡啶分子是大体积平面配体,其结构简式如图所示,该配体的配位原子是___ 。吡啶分子中,碳、氮原子的轨道杂化方式分别是____ 、_____ ,各元素的电负性由大到小的顺序为____ 。
③二氯二吡啶合铂分子中存在的微粒间作用力有___  填序号
填序号 。
。
a.离子键 b.配位键 c.金属键 d.非极性键 e.氢键
④反式二氯二吡啶合铂分子结构如图所示,该分子是___ 分子 选填“极性”、“非极性”
选填“极性”、“非极性” 。
。

(3)已知金属铂的密度为d g/cm3,NA代表阿伏加德罗常数的值,金属铂的相对原子质量为 M。如图分别表示金属铂原子的堆积方式、晶胞特征,则金属铂的堆积方式为____ , 晶胞参数a =_____ nm (列出计算式即可)。

(1)在元素周期表中,铂元素与铁元素同族,则铂元素位于
A.s区 B.p区 C.d区 D.ds区 E.f区
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体。科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①Cl-的最外层电子排布式为
②吡啶分子是大体积平面配体,其结构简式如图所示,该配体的配位原子是

③二氯二吡啶合铂分子中存在的微粒间作用力有
 填序号
填序号 。
。a.离子键 b.配位键 c.金属键 d.非极性键 e.氢键
④反式二氯二吡啶合铂分子结构如图所示,该分子是
 选填“极性”、“非极性”
选填“极性”、“非极性” 。
。
(3)已知金属铂的密度为d g/cm3,NA代表阿伏加德罗常数的值,金属铂的相对原子质量为 M。如图分别表示金属铂原子的堆积方式、晶胞特征,则金属铂的堆积方式为

您最近一年使用:0次
2020-11-15更新
|
330次组卷
|
2卷引用:山东省济南市平阴县第一中学2021届高三下学期3月月考化学试题
5 . X、Y、Z、W、Q、R均为前4周期元素,且原子序数依次增大。其相关信息如下表所示:
请回答下列问题:
(1)Y元素的基态原子的电子排布式为________________ ;R元素的价电子排布式为___________ 。
(2)元素X、Y、Z电负性由大到小的顺序为_________ (填元素符号);X、Y、Z中第一电离能最大的是__________ (填元素名称)。
(3)W在周期表中的位置是__________ ;X的最简单氢化物分子中键角为__________ ;化合物Q2Z2中所含化学键类型为_____________ 。
(4)YZ2与水反应的离子方程式为___________________ 。
| X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y原子的2p轨道中有3个未成对电子 |
| Z元素的族序数是其周期数的3倍 |
| W原子的第一至第六电离能分别为:I1=578kJ/mol;I2=1817kJ/mol;I3=2745kJ/mol;I4=11575kJ/mol;I5=14830kJ/mol;I6=18376kJ/mol |
| Q为前4周期中电负性最小的元素 |
| 元素R位于周期表的第11列 |
(1)Y元素的基态原子的电子排布式为
(2)元素X、Y、Z电负性由大到小的顺序为
(3)W在周期表中的位置是
(4)YZ2与水反应的离子方程式为
您最近一年使用:0次
2020-08-22更新
|
201次组卷
|
2卷引用:山东省商河县第一中学2020-2021学年高二下学期开学考试化学试题
名校
解题方法
6 . 镓与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____ ,基态As原子核外有_________ 个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____ 和+3。砷的电负性比镓____ (填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:_________ 。
GaF3的熔点超过1000℃,可能的原因是______ 。
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为___ ,草酸根中碳原子的杂化方式为____ 。
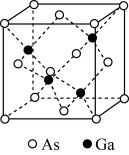

(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_____ ,晶体的密度为____ (设NA为阿伏加 德罗常数的数值,列出算式即可)g·cm−3。
(1)基态Ga原子的核外电子排布式为
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为


(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为
您最近一年使用:0次
2020-08-15更新
|
79次组卷
|
10卷引用:山东省济南市章丘区2018届高三3月模拟联考理综化学试题
山东省济南市章丘区2018届高三3月模拟联考理综化学试题河北省邢台市2018届高三上学期期末考试理综化学试题湖南省邵阳市2018届高三上学期期末考试理综化学试题山西省六校(长治二中,晋城一中、康杰中学、临汾一中等)2018届高三第四次名校联合考试(百日冲刺)理综化学试题四川省泸县第四中学2019届高三二诊模拟理综-化学试题【全国百强校】广东省汕头市金山中学2018-2019学年高二下学期第一次月考化学试题河北省藁城市第一中学2019届高三下学期4月月考化学试题河北省沧州市泊头市第一中学2020届高三上学期第四次月考化学试题湖南省湘潭一中、双峰一中,邵东一中2019-2020学年高二下学期联考化学试题高二选择性必修2(人教版2019)全书综合训练
7 . 短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是
| 元素 | X | Y | Z | W |
| 最高价氧化物的水化物 | H3ZO4 | |||
 溶液对应的pH(25℃) 溶液对应的pH(25℃) | 1.00 | 13.00 | 1.57 | 0.70 |
| A.元素电负性:Z<W | B.简单离子半径:W<Y |
| C.元素第一电离能:Z<W | D.简单氢化物的沸点:X<Z |
您最近一年使用:0次
2020-07-11更新
|
8433次组卷
|
44卷引用:山东省济南大学城实验高级中学2021届高三4月阶段性测试化学试题
山东省济南大学城实验高级中学2021届高三4月阶段性测试化学试题2020年天津卷化学高考试题(已下线)专题06 物质结构 元素周期律-2020年高考真题和模拟题化学分项汇编(已下线)第8单元 原子结构 元素周期律(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷山东省潍坊市诸城一中2021届高三11月份模拟化学试题(已下线)小题必刷22 元素周期表(律)及其应用——2021年高考化学一轮复习小题必刷(通用版)(人教版2019)选择性必修2 第一章 原子结构与性质 章末综合检测卷(已下线)热点6 物质结构与元素周期律-2021年高考化学专练【热点·重点·难点】(新高考)(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)专题04 物质结构和元素周期律——备战2021年高考化学纠错笔记(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练甘肃省兰州市第一中学2020-2021学年高二下学期4月月考化学试题湖北省沙市第五中学2020-2021学年高二下学期3月月考化学试题(已下线)小题15 元素周期表、律(根据物质性质角度的元素推断)——备战2021年高考化学经典小题考前必刷(全国通用)河南省开封市铁路中学2020-2021学年高二下学期期中考试化学试题(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第36讲 原子结构与性质(精练)-2022年一轮复习讲练测(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题04 物质结构与元素周期律—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)2020年天津卷化学高考真题变式题1-12湖北省沙市中学2021-2022学年高二上学期期末考试化学试题广东省云浮市云安区云安中学2021-2022学年高二下学期第一次统测化学试题(已下线)考点07 元素周期律和元素周期表-备战2023年高考化学一轮复习考点帮(全国通用)福建省福州第一中学2021-2022学年高二下学期期中考试化学试题专题1~2 综合检测(提升卷)(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第29讲 原子结构与性质(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第29讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)北京市第八十中学2022-2023学年高三上学期期末测试化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型80 用表格承载信息考查元素周期律(已下线)第五章 物质结构与性质元素周期律 第27练 元素周期表和元素周期律北京市第八十中学2023届高三下学期二模适应考试化学试题(已下线)专题07 元素周期表与元素周期律(已下线)第2讲 元素素周期表 元素周期律天津市耀华中学2023-2024学年度高三上学期开学检测化学试题天津市红桥区2023-2024学年高三上学期期中考试化学试题河北省保定市唐县第一中学2023-2024学年高二上学期12月期中考试化学试题河南省南阳市第一中学校2023-2024学年高二上学期12月月考化学试题北京师范大学附属实验中学2023-2024学年高二下学期开学检测化学试题云南省保山市腾冲市第八中学2024届高三上学期期末模拟考试化学试卷广东省四会中学、广信中学2023-2024学年高二下学期第一次联合考试化学试题
名校
解题方法
8 . 铁氧体是一种磁性材料,具有广泛的应用。
(1)铁元素位于元素周期表的_________ 区,其基态原子有___________ 种能量不同的电子。
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH)2]2、醋酸钠等碱性物质,尿素分子中四种不同元素的电负性由大到小的顺序是________ ,醋酸钠中碳原子的杂化类型是_______ 。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解, 的结构式为
的结构式为___________ (标出配位键),与 互为等电子体的分子有
互为等电子体的分子有____________ (任写一种)。铵盐大多不稳定,NH4F、NH4I中,较易分解的是_______________ 。
(4)晶体Fe3O4的晶胞如图所示,该晶体是一种磁性材料,能导电。
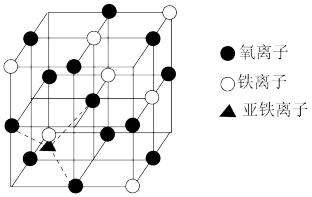
①晶胞中亚铁离子处于氧离子围成的_______________ (填空间结构)空隙。
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为______ 。
③解释Fe3O4晶体能导电的原因_________ ;若晶胞的体对角线长为a nm,则Fe3O4晶体的密度为_____________ g·cm-3(阿伏加 德罗常数用NA表示)。
(1)铁元素位于元素周期表的
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH)2]2、醋酸钠等碱性物质,尿素分子中四种不同元素的电负性由大到小的顺序是
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,
 的结构式为
的结构式为 互为等电子体的分子有
互为等电子体的分子有(4)晶体Fe3O4的晶胞如图所示,该晶体是一种磁性材料,能导电。

①晶胞中亚铁离子处于氧离子围成的
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为
③解释Fe3O4晶体能导电的原因
您最近一年使用:0次
2020-07-02更新
|
231次组卷
|
3卷引用:山东省实验中学2020届高三下学期打靶模拟考试化学试题
山东省实验中学2020届高三下学期打靶模拟考试化学试题(已下线)第18周 晚练题-备战2022年高考化学周测与晚练(新高考专用)广东省韶关市北江中等职业学校等九校 2021-2022学年高三上学期11月联考化学试题
名校
解题方法
9 . 镁、铝、硅、银、铁的单质及其化合物在建筑业、飞机制造业、电子工业和石油化工等方面应用广泛。回答下列问题:
(1)Fe3+价层电子的轨道表达式(电子排布图)为__ 。
(2)晶体硅属于______ 晶体。硅能形成多种化合物(如SiH4、Si2H4等),SiH4的分子的立体构型为____ ;Si2H4分子中含有的σ键和π键的数目之比为____ 。
有机物种类繁多的原因其中之一就是因为碳原子之间既可以形成单键又可以形成双键和三键,Si和Ge与C是同主族价电子数相同,但是Si和Ge就难形成双键或三键,原因是________
(3)Mg、Al、Si的第一电离能由大到小顺序:______________
(4)Ca和Fe属于同一周期,且核外最外层电子构型相同,但金属Ca的熔点、沸点等都比金属Fe低,原因是______ 。
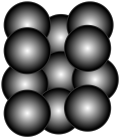
(5)Ag晶体的堆积方式为面心立方最密堆积(如图所示),晶胞中Ag原子的配位数为______ ;设Ag原子半径为rcm,阿伏加 德罗常数的值用NA表示,则Ag晶体的密度为______ g·cm-3(写出表达式)。
(1)Fe3+价层电子的轨道表达式(电子排布图)为
(2)晶体硅属于
有机物种类繁多的原因其中之一就是因为碳原子之间既可以形成单键又可以形成双键和三键,Si和Ge与C是同主族价电子数相同,但是Si和Ge就难形成双键或三键,原因是
(3)Mg、Al、Si的第一电离能由大到小顺序:
(4)Ca和Fe属于同一周期,且核外最外层电子构型相同,但金属Ca的熔点、沸点等都比金属Fe低,原因是
(5)Ag晶体的堆积方式为面心立方最密堆积(如图所示),晶胞中Ag原子的配位数为

您最近一年使用:0次
名校
10 . 下列关系不正确的是
| A.等物质的量的物质燃烧耗O2量:乙烷>乙烯=乙醇>乙炔 |
| B.熔点:MgO>CaO>硫磺>Br2 |
| C.下列物质的稳定性:H2O>H2S>H2Se |
| D.电负性:N>O>Si>Mg |
您最近一年使用:0次



