名校
解题方法
1 . H、C、N、O、Na、Mg、Cl、Cu是8种中学化学中常见的元素。
(1)原子结构与元素性质
① 5种元素H、C、N、O、Na中,电负性最大的是___________ 。
② 3种元素Na、Mg、Cl中,原子半径最大的是___________ 。
③ 基态Cu的价电子排布式为___________ 。
(2)微粒间相互作用与物质性质
① 下列物质的分子中同时存在σ键和π键的是___________ (填字母)。
a.H2 b.N2 c.Cl2 d.NH3
② NH3分子与酸反应形成NH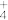 的原因是
的原因是___________ 。
③ 相同条件下,SO2在水中的溶解度大于CO2的,理由是___________ 。
(3)不同聚集状态的物质与性质___________ 。
②金属钠能导电的原因是___________ 。
③NaCl、NaBr、NaI中,熔点最高的是___________ 。
④ 金刚石和石墨是碳的两种常见单质,下列叙述正确的是___________ (填字母)。
a.金刚石和石墨都是共价晶体
b.晶体中共价键的键角:金刚石>石墨
c.金刚石中碳原子杂化类型为sp3杂化,石墨中碳原子杂化类型为sp2杂化
(1)原子结构与元素性质
① 5种元素H、C、N、O、Na中,电负性最大的是
② 3种元素Na、Mg、Cl中,原子半径最大的是
③ 基态Cu的价电子排布式为
(2)微粒间相互作用与物质性质
① 下列物质的分子中同时存在σ键和π键的是
a.H2 b.N2 c.Cl2 d.NH3
② NH3分子与酸反应形成NH
 的原因是
的原因是③ 相同条件下,SO2在水中的溶解度大于CO2的,理由是
(3)不同聚集状态的物质与性质
②金属钠能导电的原因是
③NaCl、NaBr、NaI中,熔点最高的是
④ 金刚石和石墨是碳的两种常见单质,下列叙述正确的是
a.金刚石和石墨都是共价晶体
b.晶体中共价键的键角:金刚石>石墨
c.金刚石中碳原子杂化类型为sp3杂化,石墨中碳原子杂化类型为sp2杂化
您最近一年使用:0次
名校
解题方法
2 . 如表所示为三种同一短周期元素的各级电离能数据(单位:kJ·mol-1)。下列说法正确的是
| 电离能 元素代号 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 740 | 1500 | 7700 | 10500 |
| Z | 580 | 1800 | 2700 | 11600 |
| A.电负性:Y>Z |
| B.同周期元素第一电离能大于Y的有5种元素 |
| C.X位于s区,Y、Z位于p区 |
| D.X元素可能是Li |
您最近一年使用:0次
3 . 孔雀石(主要成分为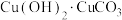 )和蓝铜矿(主要成分为
)和蓝铜矿(主要成分为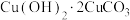 )是两种常见颜料。下列说法
)是两种常见颜料。下列说法不正确 的是
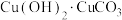 )和蓝铜矿(主要成分为
)和蓝铜矿(主要成分为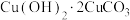 )是两种常见颜料。下列说法
)是两种常见颜料。下列说法A.原子半径: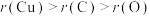 | B.电负性: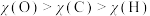 |
| C.孔雀石、蓝铜矿颜料不易被空气氧化 | D.基态Cu+离子3d轨道上有9个电子 |
您最近一年使用:0次
名校
解题方法
4 . 自然界中,纯粹的典型晶体是不多的,大多数晶体是分子晶体、共价晶体、金属晶体和离子晶体之间的过渡晶体。以下列出了第三周期几种氧化物晶体中离子键的百分数。
提示:离子键的百分数是通过电负性的差值计算出来的,电负性的差值越大,离子键的百分数越大。
(1)从原子结构角度解释,为什么一般认为氧化镁属于离子晶体,而二氧化硅属于共价晶体:___________ 。
(2)硅元素位于元素周期表的___________ 区。基态硅原子的价层电子排布式为___________ 。
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,已知该晶体中晶胞各边长度分别为apm、apm和cpm,两条底边夹角为120°,距离最近的两个B原子之间距离为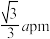 。
。
①该物质化学式为___________ ;
②距离每个B原子最近的Mg原子有___________ 个;
③该晶体密度为___________  。
。 含量。
含量。
(ⅰ)称取m克硅酸钠样品加热溶解后,配置为250mL待测液。
(ⅱ)移取50mL待测液至250mL锥形瓶中,加入10滴甲基红指示剂【HIn(红色) (黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为
(黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为 ,体系中有沉淀。
,体系中有沉淀。
(ⅲ)加入3.0g氟化钠固体,充分反应。
(ⅳ)用0.5000mol/L HCl标准溶液滴定至溶液为玫瑰红色并继续加入至过量,共加入 。
。
(ⅴ)用0.5000mol/L NaOH标准溶液滴定至溶液变为亮黄色,消耗NaOH溶液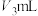 。
。
已知: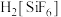 为强电解质,回答问题:
为强电解质,回答问题:
①步骤(ⅲ)中加入NaF后发生化学反应的离子方程式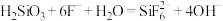 ,则加入NaF后的实验现象为
,则加入NaF后的实验现象为___________ 。
②样品中硅酸钠的纯度为___________ (用质量分数表示)。
| 氧化物 |  | MgO |  |  |
| 离子键百分数 | 62 | 50 | 41 | 33 |
(1)从原子结构角度解释,为什么一般认为氧化镁属于离子晶体,而二氧化硅属于共价晶体:
(2)硅元素位于元素周期表的
(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,已知该晶体中晶胞各边长度分别为apm、apm和cpm,两条底边夹角为120°,距离最近的两个B原子之间距离为
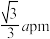 。
。①该物质化学式为
②距离每个B原子最近的Mg原子有
③该晶体密度为
 。
。
 含量。
含量。(ⅰ)称取m克硅酸钠样品加热溶解后,配置为250mL待测液。
(ⅱ)移取50mL待测液至250mL锥形瓶中,加入10滴甲基红指示剂【HIn(红色)
 (黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为
(黄色)】,摇匀后用0.2000mol/L HCl标准溶液滴定至体系为玫瑰红色,消耗盐酸体积为 ,体系中有沉淀。
,体系中有沉淀。(ⅲ)加入3.0g氟化钠固体,充分反应。
(ⅳ)用0.5000mol/L HCl标准溶液滴定至溶液为玫瑰红色并继续加入至过量,共加入
 。
。(ⅴ)用0.5000mol/L NaOH标准溶液滴定至溶液变为亮黄色,消耗NaOH溶液
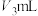 。
。已知:
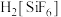 为强电解质,回答问题:
为强电解质,回答问题:①步骤(ⅲ)中加入NaF后发生化学反应的离子方程式
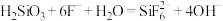 ,则加入NaF后的实验现象为
,则加入NaF后的实验现象为②样品中硅酸钠的纯度为
您最近一年使用:0次
解题方法
5 . 氢气是重要的资源,可通过多种途径制备得到。
(1)氨硼烷( )在催化剂的作用下与水反应释放
)在催化剂的作用下与水反应释放 并生成
并生成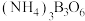 。
。
①氨硼烷分子中所有原子均达到稳定结构,其电子式为_______ 。
②已知 含有
含有 、
、 相间的六元环的结构(环上含有6个原子),
相间的六元环的结构(环上含有6个原子), 原子采取
原子采取 杂化,
杂化, 的结构式可表示为
的结构式可表示为_______ 。
(2) 的强碱溶液在
的强碱溶液在 改性的
改性的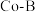 催化剂作用下与水反应生成
催化剂作用下与水反应生成 的部分反应机理如图所示。
的部分反应机理如图所示。 与
与 反应最多产生
反应最多产生 的物质的量为
的物质的量为_______ 。
②若用 代替
代替 ,步骤2中生成气体的化学式为
,步骤2中生成气体的化学式为_______ 。
(3)在密闭容器中,通过铁粉与 溶液反应可以制得
溶液反应可以制得 和
和 。活性
。活性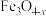 是
是 转化为
转化为 的催化剂,其可能反应机理如图所示:
的催化剂,其可能反应机理如图所示: 酸性强于
酸性强于 的原因是
的原因是_______ 。
②根据元素电负性的变化规律,图中所示的反应步骤Ⅰ可描述为_______ 。
(1)氨硼烷(
 )在催化剂的作用下与水反应释放
)在催化剂的作用下与水反应释放 并生成
并生成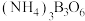 。
。①氨硼烷分子中所有原子均达到稳定结构,其电子式为
②已知
 含有
含有 、
、 相间的六元环的结构(环上含有6个原子),
相间的六元环的结构(环上含有6个原子), 原子采取
原子采取 杂化,
杂化, 的结构式可表示为
的结构式可表示为(2)
 的强碱溶液在
的强碱溶液在 改性的
改性的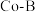 催化剂作用下与水反应生成
催化剂作用下与水反应生成 的部分反应机理如图所示。
的部分反应机理如图所示。
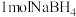 与
与 反应最多产生
反应最多产生 的物质的量为
的物质的量为②若用
 代替
代替 ,步骤2中生成气体的化学式为
,步骤2中生成气体的化学式为(3)在密闭容器中,通过铁粉与
 溶液反应可以制得
溶液反应可以制得 和
和 。活性
。活性 是
是 转化为
转化为 的催化剂,其可能反应机理如图所示:
的催化剂,其可能反应机理如图所示: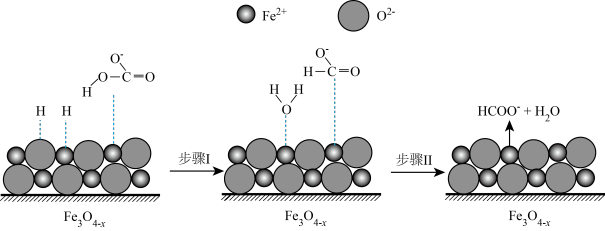
 酸性强于
酸性强于 的原因是
的原因是②根据元素电负性的变化规律,图中所示的反应步骤Ⅰ可描述为
您最近一年使用:0次
解题方法
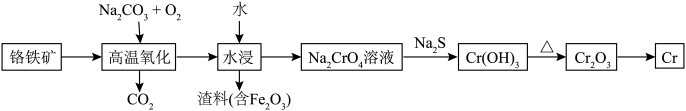
6 . 铬用于制不锈钢、汽车零件、工具、磁带和录像带等,铬铁矿炼铬过程中部分物质之间的转化关系如图。 原子的价电子排布式为
原子的价电子排布式为___________ ,最高能层上的电子占据的原子轨道轮廓图为___________ 形。
(2) 元素的电负性由小到大的顺序是
元素的电负性由小到大的顺序是___________ 。
(3) 的立体构型为
的立体构型为___________ 形,其中C的杂化轨道类型为___________ 。
(4)K和 位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为
位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为___________ 。
(5)将 糊状物用盐酸溶解,经过一系列操作可制得
糊状物用盐酸溶解,经过一系列操作可制得 晶体,已知
晶体,已知 晶体有3种不同颜色,其配位数均为6,实验测得
晶体有3种不同颜色,其配位数均为6,实验测得 不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。
不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。
写出浅绿色晶体配合物的化学式:___________ 。
(6) 晶体为六方晶系,结构如图所示。图中“
晶体为六方晶系,结构如图所示。图中“ ”代表
”代表___________ (填“ ”或“
”或“ ”)。已知:六棱柱底边边长为
”)。已知:六棱柱底边边长为 ,高为
,高为 ,
, ,
,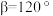 ,
, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。 晶体的密度为
晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。
 原子的价电子排布式为
原子的价电子排布式为(2)
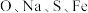 元素的电负性由小到大的顺序是
元素的电负性由小到大的顺序是(3)
 的立体构型为
的立体构型为(4)K和
 位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为
位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为(5)将
 糊状物用盐酸溶解,经过一系列操作可制得
糊状物用盐酸溶解,经过一系列操作可制得 晶体,已知
晶体,已知 晶体有3种不同颜色,其配位数均为6,实验测得
晶体有3种不同颜色,其配位数均为6,实验测得 不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。
不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。| 晶体颜色 | 深绿色 | 浅绿色 | 紫色 |
 沉淀的物质的量/ 沉淀的物质的量/ | 1 | 2 | 3 |
(6)
 晶体为六方晶系,结构如图所示。图中“
晶体为六方晶系,结构如图所示。图中“ ”代表
”代表 ”或“
”或“ ”)。已知:六棱柱底边边长为
”)。已知:六棱柱底边边长为 ,高为
,高为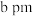 ,
, ,
,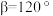 ,
, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。 晶体的密度为
晶体的密度为 (列出计算式即可)。
(列出计算式即可)。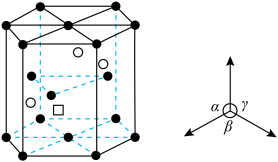
您最近一年使用:0次
名校
解题方法
7 . 氮族元素可以形成多种多样的化合物,回答下列问题:
(1)基态As原子的价电子的轨道表示式是______ 。
(2)叠氮酸(HN3)常用于引爆剂,可用联氨( )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
______ 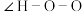 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: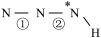 ,
, 为
为 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①______ ②。
(3)乙胺( )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是______ 。
(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是______ 。

(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为 ,晶胞参数为
,晶胞参数为 ,
, 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是______ ,n原子的分数坐标是______ ,若阿伏加德罗常数值为 ,该晶体密度是
,该晶体密度是______  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)基态As原子的价电子的轨道表示式是
(2)叠氮酸(HN3)常用于引爆剂,可用联氨(
 )制取。比较联氨与双氧水分子中键角大小:
)制取。比较联氨与双氧水分子中键角大小:
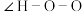 (填“>”、“=”或“<”,下同)。叠氮酸结构如图所示:
(填“>”、“=”或“<”,下同)。叠氮酸结构如图所示: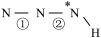 ,
, 为
为 杂化,已知参与形成π键的电子越多,键长越短,则键长;①
杂化,已知参与形成π键的电子越多,键长越短,则键长;①(3)乙胺(
 )和2-羟基乙胺(
)和2-羟基乙胺( )都可用于染料的合成,乙胺碱性更强,原因是
)都可用于染料的合成,乙胺碱性更强,原因是(4)磷酸一氢盐受热易脱水聚合,生成环状的偏磷酸根。环状三偏磷酸根的结构如图所示,则由n个磷氧四面体连接形成的环状偏磷酸根的通式是

(5)砷与金属钠、铁、铜可形成一种绝缘体材料,其晶胞结构图钠原子沿z轴投影如图所示,已知m原子的分数坐标为
 ,晶胞参数为
,晶胞参数为 ,
, 。铜周围距离最近的砷原子的个数是
。铜周围距离最近的砷原子的个数是 ,该晶体密度是
,该晶体密度是 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-05-21更新
|
531次组卷
|
2卷引用:山东省潍坊市2024届高三下学期二模化学试题
解题方法
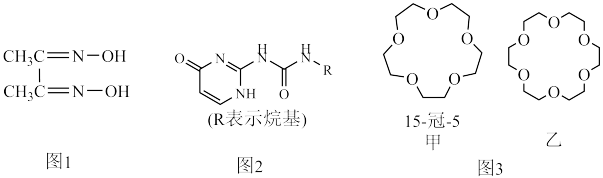
8 . 配合物和超分子广泛应用于新材料合成、物质的鉴别和分离。如丁二酮肟(如图1)可用于鉴别 Ni2+,嘧啶衍生物(如图2)是形成高韧性超分子的单体,冠醚(如图3)是皇冠状分子,可有大小不同的空穴适配不同大小的碱金属离子。
(1)基态 Ni2+核外未成对电子的数目为______ 。
(2)丁二酮肟与 Ni²⁺生成血红色配合物的结构为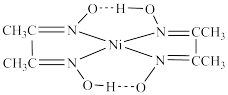 ,相同压强下,该配合物的沸点低于干二酮肟的原因为
,相同压强下,该配合物的沸点低于干二酮肟的原因为_______ 。
(3)Ni在一定条件下可与CO形成 Ni(CO)x,分子中每个Ni原子的价电子数及其周围CO提供的成键电子数之和为18,则x=_______ 。
(4)图2所示分子所含元素电负性由小到大的顺序为______ 。
(5)冠醚是状如皇冠的一类醚,分子中存在空穴,图3中甲、乙两种冠醚可分别识别 Na+、K+,其主要原因为________ ;乙的名称为______ 。
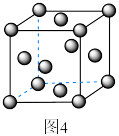
(6)金属Ni的立方晶胞结构如图4所示,则Ni的空间利用率为________ (用含π的代式表示)。
(1)基态 Ni2+核外未成对电子的数目为
(2)丁二酮肟与 Ni²⁺生成血红色配合物的结构为
 ,相同压强下,该配合物的沸点低于干二酮肟的原因为
,相同压强下,该配合物的沸点低于干二酮肟的原因为(3)Ni在一定条件下可与CO形成 Ni(CO)x,分子中每个Ni原子的价电子数及其周围CO提供的成键电子数之和为18,则x=
(4)图2所示分子所含元素电负性由小到大的顺序为
(5)冠醚是状如皇冠的一类醚,分子中存在空穴,图3中甲、乙两种冠醚可分别识别 Na+、K+,其主要原因为
(6)金属Ni的立方晶胞结构如图4所示,则Ni的空间利用率为
您最近一年使用:0次
名校
解题方法
9 . 铁元素在人体健康和新材料研发中有重要的应用。
I.在血液中,以 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 ,下图为载氧后的血红蛋白分子示意图:
,下图为载氧后的血红蛋白分子示意图:_________ 。
(2)载氧时,血红蛋白分子中 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是_________ (填字母)。
a. b.
b. c.CO
c.CO
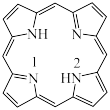
(3)一种最简单的卟啉环结构如图:_________ 。
②比较C和N的电负性大小,并从原子结构角度说明理由:_________ 。
③该卟啉分子在酸性环境中配位能力会减弱,原因是_________ 。
Ⅱ. 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。
(4)该晶体的密度是_________  。
。
(5)距离F最近的Cs的个数为_________ 。
I.在血液中,以
 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 ,下图为载氧后的血红蛋白分子示意图:
,下图为载氧后的血红蛋白分子示意图: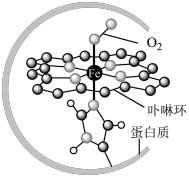
(2)载氧时,血红蛋白分子中
 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是a.
 b.
b. c.CO
c.CO (3)一种最简单的卟啉环结构如图:
②比较C和N的电负性大小,并从原子结构角度说明理由:
③该卟啉分子在酸性环境中配位能力会减弱,原因是
Ⅱ.
 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。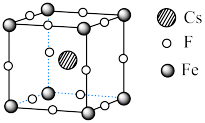
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。(4)该晶体的密度是
 。
。(5)距离F最近的Cs的个数为
您最近一年使用:0次
2024-05-11更新
|
313次组卷
|
3卷引用:北京市海淀区2023-2024学年高三下学期期末练习(二模)化学试题
北京市海淀区2023-2024学年高三下学期期末练习(二模)化学试题天津市耀华中学2024届高三下学期第二次模拟化学试题(已下线)期末押题卷01-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(上海专用)
名校
10 . 下列说法正确的是
| A.元素C、N、O的第一电离能由大到小的顺序为O>N>C |
B. 中电负性最小的元素是N 中电负性最小的元素是N |
C.基态 的价电子排布式为 的价电子排布式为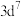 |
D. 的键角为120°, 的键角为120°, 的键角为120° 的键角为120° |
您最近一年使用:0次



