解题方法
1 . Ⅰ.SiC、BN、GaAs 等是人工合成半导体的材料,具有高频、大功率和抗辐射等优点。请回答:
(1)Ga的第一电离能失去的是___________ 能级的电子。
(2)B、C、N的电负性由大到小排列为___________ 。
Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(3)拟卤素(CN)2、(SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足8 电子结构。(SCN)2对应的酸有两种,测得硫氰酸(H—S—C≡N )的沸点低于异硫氰酸(H-N=C=S),其原因是___________ 。
(4)卤化物 RbICl2 在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式为___________ ;I 属于多卤素阳离子,其空间构型为
属于多卤素阳离子,其空间构型为___________ 。
(5)卤素互化物如IBr、ICl等与卤素单质结构和性质相似。Cl2、IBr、ICl沸点由高到低的顺序为___________ 。
(6)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为___________ (填序号)。
III.金属铁是生活中最常见的金属,其晶胞为体心立方堆积。
(7)其晶胞的俯视图为____ (填字母序号)。
(8)若铁的密度为a g/cm3,则铁晶胞中最近的两个铁原子的核间距离是____ pm(列表达式即可)。
(1)Ga的第一电离能失去的是
(2)B、C、N的电负性由大到小排列为
Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(3)拟卤素(CN)2、(SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足8 电子结构。(SCN)2对应的酸有两种,测得硫氰酸(H—S—C≡N )的沸点低于异硫氰酸(H-N=C=S),其原因是
(4)卤化物 RbICl2 在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式为
 属于多卤素阳离子,其空间构型为
属于多卤素阳离子,其空间构型为(5)卤素互化物如IBr、ICl等与卤素单质结构和性质相似。Cl2、IBr、ICl沸点由高到低的顺序为
(6)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为
III.金属铁是生活中最常见的金属,其晶胞为体心立方堆积。
(7)其晶胞的俯视图为____ (填字母序号)。
A. | B. | C.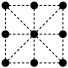 | D. |
您最近一年使用:0次
2021-05-07更新
|
476次组卷
|
3卷引用:吉林省吉林市普通中学2021届高三下学期第四次调研测试理综化学试题
吉林省吉林市普通中学2021届高三下学期第四次调研测试理综化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题河南省名校联盟2022届高三下学期第一次模拟理科综合化学试题
名校
2 . 乙二胺在电刷镀铜溶液中能起到稳定剂的作用。回答下列问题。
(1)基态Cu原子最高能级组电子数为___________ 个。
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:
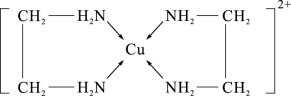
①配离子中含有的化学键类型有___________ 。
②C、N、O的第一电离能由大到小的顺序是___________ 。
③乙二胺分子中氮原子轨道的杂化类型为___________ 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是___________ 。
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的 ,此时晶体的导电性大大增强,导电性增强的原因
,此时晶体的导电性大大增强,导电性增强的原因___________ ;在氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则___________ 是Na+最可能通过途径迁移到空位处(填图中序号)。
·
(4)某镍白铜合金的立方晶胞结构如图所示。
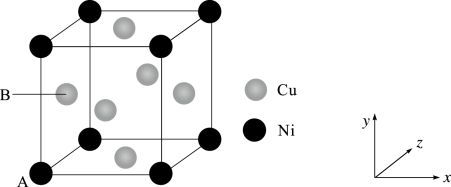
①原子A的原子坐标为(0,0,0),原子B的原子坐标为___________ 。
②若合金的密度为ρg/cm3,Ni原子之间最短距离为___________ nm(列出计算式)。
(1)基态Cu原子最高能级组电子数为
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:

①配离子中含有的化学键类型有
②C、N、O的第一电离能由大到小的顺序是
③乙二胺分子中氮原子轨道的杂化类型为
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的
 ,此时晶体的导电性大大增强,导电性增强的原因
,此时晶体的导电性大大增强,导电性增强的原因·

(4)某镍白铜合金的立方晶胞结构如图所示。

①原子A的原子坐标为(0,0,0),原子B的原子坐标为
②若合金的密度为ρg/cm3,Ni原子之间最短距离为
您最近一年使用:0次
2021-05-07更新
|
979次组卷
|
6卷引用:安徽省宿州市2021届高三下学期第三次模拟考试理综化学试题
安徽省宿州市2021届高三下学期第三次模拟考试理综化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题(已下线)押山东卷第17题 物质结构与性质综合题-备战2021年高考化学临考题号押题(山东卷)江西省抚州市临川第一中学2021届高考5月模拟考试理综化学试题2021年山东高考化学试题变式题11-202022届江西省赣州市高三适应性考试(二模)理综化学试题
解题方法
3 . 离子液体被认为是21世纪理想的绿色溶剂,是指室温或者接近室温时呈液态,而本身由阴、阳离子构成的化合物。氯代 丁基
丁基 甲基咪唑离子液
甲基咪唑离子液 可以与
可以与 混合形成离子液体;
混合形成离子液体;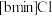 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是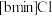 与
与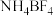 离子交换反应合成离子液体
离子交换反应合成离子液体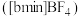 的流程:
的流程:

(1)请画出基态 原子的价电子排布图
原子的价电子排布图___________ ;同周期元素中基态原子未成对电子数与硼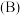 原子相同的有
原子相同的有___________ (填元素符号)。
(2)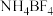 中N原子的杂化方式为
中N原子的杂化方式为___________ ,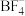 的空间构型为
的空间构型为___________ , 中几种元素电负性由大到小的顺序为
中几种元素电负性由大到小的顺序为___________ 。
(3)已知分子中的大 键可以用
键可以用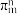 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则
键中的电子数,则 中大
中大 键可以表示为
键可以表示为___________ 。
(4) 熔点为
熔点为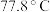 ,则
,则 的晶体类型为
的晶体类型为___________ , 和
和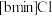 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: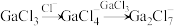 ,请画出
,请画出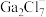 的结构式
的结构式___________ 。
(5)某种 的晶胞结构如图所示,
的晶胞结构如图所示, 以六方最密方式堆积,
以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在
在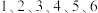 构成的八面体体心)。
构成的八面体体心)。
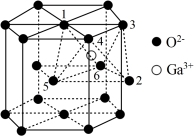
①该晶胞中 的配位数为
的配位数为___________ 。
②该晶胞有___________  (保留一位小数)八面体空隙未填充阳离子。
(保留一位小数)八面体空隙未填充阳离子。
③已知氧离子半径为 ,晶胞的高为
,晶胞的高为 代表阿伏加德罗常数的值,该晶体的密度为
代表阿伏加德罗常数的值,该晶体的密度为___________  (用含
(用含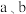 和
和 的代数式表示)。
的代数式表示)。
 丁基
丁基 甲基咪唑离子液
甲基咪唑离子液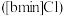 可以与
可以与 混合形成离子液体;
混合形成离子液体;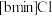 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是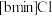 与
与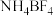 离子交换反应合成离子液体
离子交换反应合成离子液体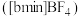 的流程:
的流程:
(1)请画出基态
 原子的价电子排布图
原子的价电子排布图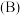 原子相同的有
原子相同的有(2)
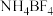 中N原子的杂化方式为
中N原子的杂化方式为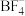 的空间构型为
的空间构型为 中几种元素电负性由大到小的顺序为
中几种元素电负性由大到小的顺序为(3)已知分子中的大
 键可以用
键可以用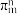 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则
键中的电子数,则 中大
中大 键可以表示为
键可以表示为(4)
 熔点为
熔点为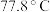 ,则
,则 的晶体类型为
的晶体类型为 和
和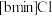 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: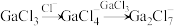 ,请画出
,请画出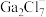 的结构式
的结构式(5)某种
 的晶胞结构如图所示,
的晶胞结构如图所示, 以六方最密方式堆积,
以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在
在 构成的八面体体心)。
构成的八面体体心)。
①该晶胞中
 的配位数为
的配位数为②该晶胞有
 (保留一位小数)八面体空隙未填充阳离子。
(保留一位小数)八面体空隙未填充阳离子。③已知氧离子半径为
 ,晶胞的高为
,晶胞的高为 代表阿伏加德罗常数的值,该晶体的密度为
代表阿伏加德罗常数的值,该晶体的密度为 (用含
(用含 和
和 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2021-04-19更新
|
297次组卷
|
2卷引用:重庆市普通高中学业水平选择性考试2021届高三第二次联合诊断检测化学试题
名校
解题方法
4 . 人体血红蛋白中含有Fe2+一卟啉环配合物,结合O2后,其基本结构如图(烃基略去)。回答下列问题:
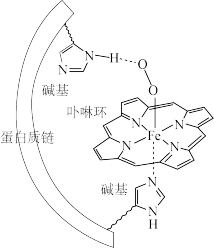
(1)Fe、N、C、H四种元素中电负性最大的是____ (填写元素符号);血红蛋白结合O2前后的中心Fe均为正二价,其基态时3d轨道中电子数为____ 。
(2)卟啉环中所有原子共平面,其中N的杂化方式为____ ,C-Nσ键有____ 个。
(3)图中Fe2+的配位数为__________ ;其中一个碱基通过 ____ 作用与O2分子结合,另一碱基的N原子提供____ 与Fe2+配位。
(4)已知气态O2的氧氧间距比图中更短。判断血红蛋白结合O2后O2活性更___ (填“高”或“低”),说明理由____ 。
(5)从298K升温到1200K时,体心立方型的δ -Fe变化为面心立方最密堆积,配位数____ (填“变大”、“不变”或“变小”)。假定升温时Fe原子半径不变,体积变为低温时的___ %(已知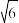 =2.45,结果保留两位有效数字)。
=2.45,结果保留两位有效数字)。

(1)Fe、N、C、H四种元素中电负性最大的是
(2)卟啉环中所有原子共平面,其中N的杂化方式为
(3)图中Fe2+的配位数为
(4)已知气态O2的氧氧间距比图中更短。判断血红蛋白结合O2后O2活性更
(5)从298K升温到1200K时,体心立方型的δ -Fe变化为面心立方最密堆积,配位数
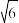 =2.45,结果保留两位有效数字)。
=2.45,结果保留两位有效数字)。
您最近一年使用:0次
2021-04-04更新
|
532次组卷
|
2卷引用:四川省成都市2021届高三第二次诊断性检测理综化学试题
名校
解题方法
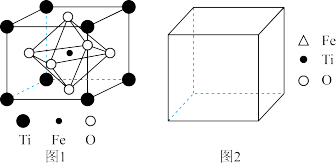
5 . 12月 17日凌晨,嫦娥五号完成“ 挖土” 之旅返回地球。查阅资料,月球玄武岩是构成月球的岩石之一,主要由辉石(主要成分硅酸盐)和钛铁矿(主要成分 FeTiO3)等组成。回答下列问题:
(1)基态铁原子的价电子排布式为:______ 。
(2)与 Fe同周期,且最外层电子数相同的主族元素是______ (填元素符号)。
(3)基态 Ti原子核外电子占据的最高能层符号为______ ;其最外层电子的电子云轮廓图为______ 。
(4)1molFe3[Fe(CN)6]2中含有 σ键数为______ ,[Fe(CN)6]3-中配体为______ ,其中 C原子的杂化轨道类型为______ ,H、C、N、Si四种元素的电负性由大到小的顺序为______ 。
(5)FeTiO3的结构如图 1所示,其中由 O围成的______ (填“ 四面体空隙” 或“ 八面体空隙” )被 Fe占据。在图 2中画出 FeTiO3结构的另一种表示______ (要求:Fe处于晶胞的顶点),Ti的配位数为______ 。
(6)已知该晶胞的密度为 ρg/cm3,NA表示阿伏加德罗常数的值。计算晶胞参数 a=______ pm。(列出计算表达式)
(1)基态铁原子的价电子排布式为:
(2)与 Fe同周期,且最外层电子数相同的主族元素是
(3)基态 Ti原子核外电子占据的最高能层符号为
(4)1molFe3[Fe(CN)6]2中含有 σ键数为
(5)FeTiO3的结构如图 1所示,其中由 O围成的
(6)已知该晶胞的密度为 ρg/cm3,NA表示阿伏加德罗常数的值。计算晶胞参数 a=

您最近一年使用:0次
2021-03-14更新
|
850次组卷
|
3卷引用:河南省洛阳市2021届高三3月调研考试理综化学试题
河南省洛阳市2021届高三3月调研考试理综化学试题湖南省娄底市第五中学2021-2022学年高三下学期期中考试化学试题(已下线)01 物质结构与性质综合题型集训(1) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
名校
解题方法
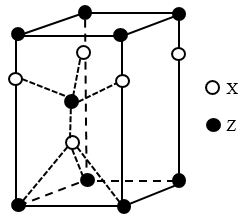
6 . 原子序数小于等于36的Q、W、X、Y、Z五种元素,其中Q是形成化合物种类最多的元素,W和Y的基态原子2p能级所含成单电子数均为2,Z的基态原子核外含有13种运动状态不同的电子。回答下列问题(涉及元素时用对应的元素符号表示):
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是______ 。
(2)1molQWX与1molWQ2Y所含σ键的比值为______ 。
(3)根据等电子体理论可以预测WXY-的空间构型为______ 。
(4)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为______ 。
(5)实验室合成一种由W和X两种元素形成的化合物,该化合物具有空间网状结构,其中每个W原子与4个X原子形成共价键,每个X原子与3个W原子形成共价键。
①该化合物的化学式为。______ 。
②该化合物所属晶体类型为______ 晶体,预测其熔点应______ 金刚石(填“高于”或“低于”)。
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是
(2)1molQWX与1molWQ2Y所含σ键的比值为
(3)根据等电子体理论可以预测WXY-的空间构型为
(4)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为

(5)实验室合成一种由W和X两种元素形成的化合物,该化合物具有空间网状结构,其中每个W原子与4个X原子形成共价键,每个X原子与3个W原子形成共价键。
①该化合物的化学式为。
②该化合物所属晶体类型为
您最近一年使用:0次
2021-03-14更新
|
325次组卷
|
3卷引用:江苏省如皋中学2020届高三阶段检测化学试题
名校
解题方法
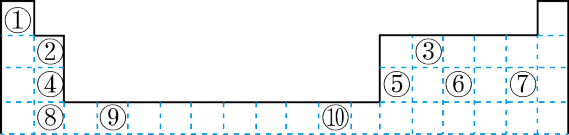
7 . 下表为长式周期表的一部分其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于 ds 区的元素是___________ (填元素符号)它的基态原子的价电子排布式为___________ 。
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为___________ ,其中元素③的基态原子的电子排布图为_______ ;①和⑥形成的一种常见四原子分子的化学式为_______ ,该分子的立体构型为______ 。
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为___________ ;该元素与元素①形成的最简单分子 X 的电子式为___________ 。
(4)元素⑤的电负性___________ ④元素的电负性(选填>、=、<下同);元素⑥的第一电离能___________ 原子序数为 16 的元素的第一电离能。
(5)用电子式表示元素④和⑦组成的化合物的形成过程___________ 。

请回答下列问题:
(1)表中属于 ds 区的元素是
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为
(4)元素⑤的电负性
(5)用电子式表示元素④和⑦组成的化合物的形成过程
您最近一年使用:0次
解题方法
8 . 草酸铁铵{(NH4)3[Fe(C2O4)3]}常用于摄影和蓝色印刷等,其制备原理为:Fe(OH)3+3NH4HC2O4=(NH4)3[Fe(C2O4)3]+3H2O。
回答下列问题:
(1)基态C原子核外电子云有__ 种形状;基态铁原子最先失去__ 能级(填能级符号)上的电子。
(2)(NH4)3[Fe(C2O4)3]中C2O 作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。
作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。
①该配合物中所含非金属元素的电负性由大到小的顺序为__ (用元素符号表示)。
②上述配合物的中心离子配位数为___ 。
③1molC2O 中含有σ键的数目为
中含有σ键的数目为__ 在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键简称大π键。如苯的大π键可表示为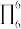 (π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O
(π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O 的大π键可表示为
的大π键可表示为__ 。
(3)写出一种与NH 所含价电子数和原子总数均相等微粒的化学式
所含价电子数和原子总数均相等微粒的化学式__ ;N元素的一种同素异形体N4中所有原子均满足8电子稳定结构,N4的结构式为__ ;CH4、NH3、H2O分子中键角由大到小的顺序为__ 。
(4)铁的某种晶胞沿面对角线的位置切下之后可以得到如图所示的藏面。假设铁原子半径为rpm,NA为阿伏加德罗常数的值,则铁晶体密度为__ g·cm-3。

回答下列问题:
(1)基态C原子核外电子云有
(2)(NH4)3[Fe(C2O4)3]中C2O
 作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。
作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。①该配合物中所含非金属元素的电负性由大到小的顺序为
②上述配合物的中心离子配位数为
③1molC2O
 中含有σ键的数目为
中含有σ键的数目为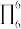 (π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O
(π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O 的大π键可表示为
的大π键可表示为(3)写出一种与NH
 所含价电子数和原子总数均相等微粒的化学式
所含价电子数和原子总数均相等微粒的化学式(4)铁的某种晶胞沿面对角线的位置切下之后可以得到如图所示的藏面。假设铁原子半径为rpm,NA为阿伏加德罗常数的值,则铁晶体密度为

您最近一年使用:0次
2021-01-31更新
|
549次组卷
|
2卷引用:贵州省盘州市2021届高三第一次模拟考试理科综合化学试题
解题方法
9 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)Co3+的价电子排布图为:___ ;基态磷原子有___ 种空间运动状态不同的电子。
(2)Li、O、P三种元素的电负性由大到小的顺序是:___ 。
(3)写出一种与PO 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:___ ,该分子的中心原子的价层电子对数等于___ 。
(4)已知无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有:___ 。
A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(5)N和P是同主族元素,但是NH3分子中的键角大于PH3分子中的键角,原因是:___ 。
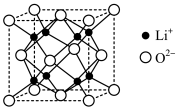
(6)Li2O为离子晶体,具有反萤石结构,晶胞如下图所示。则O2-配位数为:___ ,若晶胞参数为bnm,阿伏加德罗常数的值为NA,则Li2O的密度为___ g·cm-3(列出计算式即可),O2-和Li+的最短距离等于__ nm(用含b的代数式表示)。
(1)Co3+的价电子排布图为:
(2)Li、O、P三种元素的电负性由大到小的顺序是:
(3)写出一种与PO
 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:(4)已知无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有:
A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(5)N和P是同主族元素,但是NH3分子中的键角大于PH3分子中的键角,原因是:
(6)Li2O为离子晶体,具有反萤石结构,晶胞如下图所示。则O2-配位数为:

您最近一年使用:0次
名校
解题方法
10 . 钛单质及其化合物在医疗器械和军工业生产中有重要应用。
(1)基态钛原子核外电子排布式为___________ ;同周期与其未成对电子数相等的基态原子还有___________ 种。
(2)氢氟酸是钛的最强溶剂,可发生反应:Ti+4HF=TiF4+2H2↑。
①上述反应涉及的三种元素电负性由强到弱的顺序为___________ 。
②HF和HCl相比较,沸点较高的是___________ ,原因为___________ 。
(3)钛酸钡(BaTiO3)被誉为“电子陶瓷工业的支柱”,其制备原理为BaTiO(C2O4)2·4H2O BaTiO3+2CO↑+2CO2↑+4H2O。
BaTiO3+2CO↑+2CO2↑+4H2O。
①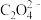 中碳原子的杂化方式为
中碳原子的杂化方式为___________ ;CO2分子的空间构型为___________ 。
②钛酸钡(BaTiO3)的晶胞为立方晶胞,结构如下图。其中部分原子坐标为W(0,0, 0)、M(1/2,1/2,1/2)、N(1/2,0,0)。

晶胞中Ba与Ti的配位数分别为___________ 、___________ ;X点的坐标为___________ ;若晶胞参数为a pm,则该晶胞的密度为___________ (NA表示阿伏加德罗常数的值,列出代数式)g·cm-3。
(1)基态钛原子核外电子排布式为
(2)氢氟酸是钛的最强溶剂,可发生反应:Ti+4HF=TiF4+2H2↑。
①上述反应涉及的三种元素电负性由强到弱的顺序为
②HF和HCl相比较,沸点较高的是
(3)钛酸钡(BaTiO3)被誉为“电子陶瓷工业的支柱”,其制备原理为BaTiO(C2O4)2·4H2O
 BaTiO3+2CO↑+2CO2↑+4H2O。
BaTiO3+2CO↑+2CO2↑+4H2O。①
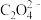 中碳原子的杂化方式为
中碳原子的杂化方式为②钛酸钡(BaTiO3)的晶胞为立方晶胞,结构如下图。其中部分原子坐标为W(0,0, 0)、M(1/2,1/2,1/2)、N(1/2,0,0)。

晶胞中Ba与Ti的配位数分别为
您最近一年使用:0次



