名校
解题方法
1 . I.非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态 原子核外电子的运动状态有
原子核外电子的运动状态有___________ 种
(2) 、
、 、
、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为___________ 。
(3) 中
中 的杂化类型是
的杂化类型是___________ ; 分子的空间结构为
分子的空间结构为___________ 。
(4) 的熔、沸点
的熔、沸点___________ (填“高于”或“低于”) ,原因是
,原因是___________ 。
II.过渡金属元素铬()是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(5)对于基态 原子,下列叙述正确的是
原子,下列叙述正确的是___________ 。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B. 电子能量较高,总是在比
电子能量较高,总是在比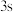 电子离核更远的地方运动
电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(1)基态
 原子核外电子的运动状态有
原子核外电子的运动状态有(2)
 、
、 、
、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为(3)
 中
中 的杂化类型是
的杂化类型是 分子的空间结构为
分子的空间结构为(4)
 的熔、沸点
的熔、沸点 ,原因是
,原因是II.过渡金属元素铬()是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(5)对于基态
 原子,下列叙述正确的是
原子,下列叙述正确的是A.轨道处于半充满时体系总能量低,核外电子排布应为

B.
 电子能量较高,总是在比
电子能量较高,总是在比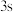 电子离核更远的地方运动
电子离核更远的地方运动C.电负性比钾高,原子对键合电子的吸引力比钾大
您最近一年使用:0次
2 . 中国较早时期就有炼铜、炼锌技术的记录,铜、锌元素也是人体必需的微量元素之一。回答下列问题:
(1)基态Cu原子核外的最高能层符号是___ ,基态Zn价电子排布式为___ 。
(2)硫酸铜溶于氨水形成[Cu(NH3)4]SO4溶液,组成[Cu(NH3)4]SO4的元素中,除Cu外其余元素的电负性由大到小排序为___ 。
(3)向[Cu(NH3)4]SO4溶液中逐滴滴加NaOH溶液,未出现浑浊,其原因是___ 。
(4)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是___ 。
(5)[Zn(CN)4]2-发生反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
①HOCH2CN分子中碳原子轨道的杂化类型是___ 。
②与H2O分子互为等电子体的阴离子为___ 。
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为___ 。
(6)金属锌晶体的晶胞如图所示,若锌原子的半径为rnm,则金属锌晶体的空间利用率是___ (用含π的代数式表示)。
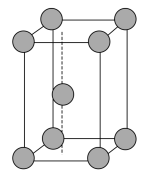
(1)基态Cu原子核外的最高能层符号是
(2)硫酸铜溶于氨水形成[Cu(NH3)4]SO4溶液,组成[Cu(NH3)4]SO4的元素中,除Cu外其余元素的电负性由大到小排序为
(3)向[Cu(NH3)4]SO4溶液中逐滴滴加NaOH溶液,未出现浑浊,其原因是
(4)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是
(5)[Zn(CN)4]2-发生反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
①HOCH2CN分子中碳原子轨道的杂化类型是
②与H2O分子互为等电子体的阴离子为
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为
(6)金属锌晶体的晶胞如图所示,若锌原子的半径为rnm,则金属锌晶体的空间利用率是

您最近一年使用:0次
解题方法
3 . 磷及其化合物在工农业生产中都有重要作用。
(1)磷原子核外电子排布式为_______ 。
(2)羟基磷灰石[Ca5(PO4)3OH]是牙齿中的重要矿物质,其中羟基(-OH)中氧原子的杂化方式为_______ , 的空间构型为
的空间构型为_______ ,该化合物中所含元素电负性最大的是_______ 。
(3)磷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:
B:(0,0,0);( ,
, ,0);(
,0);( ,0,
,0, );(0,
);(0, ,
, )……
)……
P:( ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, )……
)……
①请在图中画出磷化硼晶胞的俯视图_______ 。
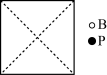
②与每个磷原子紧邻的硼原子有_______ 个,与每个硼原子紧邻的硼原子有_______ 个。
(4)磷钇矿可提取稀土元素钇(Y),某磷钇矿的结构如图所示。该磷钇矿的化学式为_______ ,与 互为等电子体的阴离子有
互为等电子体的阴离子有_______ (写出一种离子符号)。已知晶胞参数a=0.69nm,c=0.60nm,阿伏加德罗常数的值为NA,则该磷钇矿的密度为_______ g·cm-3(列出计算式)。

(1)磷原子核外电子排布式为
(2)羟基磷灰石[Ca5(PO4)3OH]是牙齿中的重要矿物质,其中羟基(-OH)中氧原子的杂化方式为
 的空间构型为
的空间构型为(3)磷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:
B:(0,0,0);(
 ,
, ,0);(
,0);( ,0,
,0, );(0,
);(0, ,
, )……
)……P:(
 ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, )……
)……①请在图中画出磷化硼晶胞的俯视图

②与每个磷原子紧邻的硼原子有
(4)磷钇矿可提取稀土元素钇(Y),某磷钇矿的结构如图所示。该磷钇矿的化学式为
 互为等电子体的阴离子有
互为等电子体的阴离子有
您最近一年使用:0次
2021-07-13更新
|
401次组卷
|
3卷引用:青海省西宁市大通回族土族自治县2021届高三下学期高考二模化学试题
青海省西宁市大通回族土族自治县2021届高三下学期高考二模化学试题(已下线)专题35 磷、砷及其化合物-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)湖南省长沙市宁乡市2022届高三下学期5月模拟考试化学试题
解题方法
4 . 近来,嫦娥五号完成“挖土”之旅返回地球。查阅资料知,月球玄武岩是构成月球的岩石之一,主要由辉石(主要成分硅酸盐)和钛铁矿(主要成分 )等组成。回答下列问题:
)等组成。回答下列问题:
(1)基态铁原子的价电子排布式为:___________ 。
(2)与Fe同周期,且最外层电子数相同的主族元素是___________ (填元素符号)。
(3)基态Ti原子核电子占据的最高能层符号为___________ ;其最外层电子的电子云轮廓图为___________ 。
(4) 中含有
中含有 键数为
键数为___________ , 中配体为
中配体为___________ ,其中C原子的杂化轨道类型为___________ ,H、C、N、Si四种元素的电负性由大到小的顺序为___________ 。
(5) 的结构如图1所示,其中由O围成的
的结构如图1所示,其中由O围成的___________ (填“四面体空隙”或“八面体空隙”)被Fe占据,Ti的配位数为___________ 。
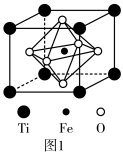
(6)已知该晶胞的密度为 ,
, 表示阿伏加德罗常数的值。计算晶胞参数a=
表示阿伏加德罗常数的值。计算晶胞参数a=___________ pm。(列出计算表达式)
 )等组成。回答下列问题:
)等组成。回答下列问题:(1)基态铁原子的价电子排布式为:
(2)与Fe同周期,且最外层电子数相同的主族元素是
(3)基态Ti原子核电子占据的最高能层符号为
(4)
 中含有
中含有 键数为
键数为 中配体为
中配体为(5)
 的结构如图1所示,其中由O围成的
的结构如图1所示,其中由O围成的
(6)已知该晶胞的密度为
 ,
, 表示阿伏加德罗常数的值。计算晶胞参数a=
表示阿伏加德罗常数的值。计算晶胞参数a=
您最近一年使用:0次
解题方法
5 . 环己酮是重要的化工原料和化工溶剂,某研究小组对其进行了一些探究。
Ⅰ.环己酮的制备。反应原理为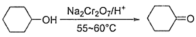 ,还原产物为
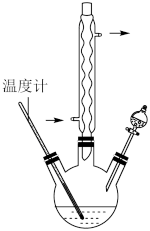
,还原产物为 ,反应过程放热,温度过高时环己酮易进一步被氧化,实验装置如图所示。
,反应过程放热,温度过高时环己酮易进一步被氧化,实验装置如图所示。
已知: 溶液呈橙红色,
溶液呈橙红色, 溶液呈墨绿色。
溶液呈墨绿色。
(1)分液漏斗中盛放的试剂为_______ 。(填字母)
a. 溶液 b.环己醇的硫酸溶液
溶液 b.环己醇的硫酸溶液
(2)三颈烧瓶中反应体系的温度需控制在55~60℃,其加热方式为_______ 。
(3)反应结束后,还需滴加甲醇,直到_______ (填实验现象)为止,随后分离提纯得到环己酮。
(4)若20.0 mL环己醇(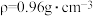 )完全反应并提纯后,得到纯环己酮(
)完全反应并提纯后,得到纯环己酮(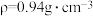 )9.6 mL,则环己酮的产率为
)9.6 mL,则环己酮的产率为_______ 。(计算结果保留2位有效数字)
Ⅱ.环己酮的结构与性质
(5)环己酮中三种元素的电负性由小到大的顺序为_______ 。(用元素符号表示)
(6)若要测定环己酮的相对分子质量,可以采用的波谱分析手段为_______ 。
(7)已知: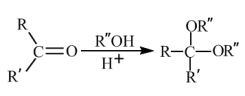 。环己酮和乙二醇在酸性条件下反应生成分子式为
。环己酮和乙二醇在酸性条件下反应生成分子式为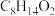 的产物,其结构简式为
的产物,其结构简式为_______ 。
Ⅰ.环己酮的制备。反应原理为
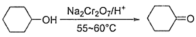 ,还原产物为
,还原产物为 ,反应过程放热,温度过高时环己酮易进一步被氧化,实验装置如图所示。
,反应过程放热,温度过高时环己酮易进一步被氧化,实验装置如图所示。
已知:
 溶液呈橙红色,
溶液呈橙红色, 溶液呈墨绿色。
溶液呈墨绿色。(1)分液漏斗中盛放的试剂为
a.
 溶液 b.环己醇的硫酸溶液
溶液 b.环己醇的硫酸溶液(2)三颈烧瓶中反应体系的温度需控制在55~60℃,其加热方式为
(3)反应结束后,还需滴加甲醇,直到
(4)若20.0 mL环己醇(
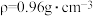 )完全反应并提纯后,得到纯环己酮(
)完全反应并提纯后,得到纯环己酮(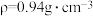 )9.6 mL,则环己酮的产率为
)9.6 mL,则环己酮的产率为Ⅱ.环己酮的结构与性质
(5)环己酮中三种元素的电负性由小到大的顺序为
(6)若要测定环己酮的相对分子质量,可以采用的波谱分析手段为
(7)已知:
 。环己酮和乙二醇在酸性条件下反应生成分子式为
。环己酮和乙二醇在酸性条件下反应生成分子式为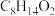 的产物,其结构简式为
的产物,其结构简式为
您最近一年使用:0次
2021-07-02更新
|
420次组卷
|
2卷引用:江苏省泰州市2020-2021学年高二下学期期末考试化学试题
真题
解题方法
6 . 硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
(1)基态硅原子最外层的电子排布图为_______ ,晶体硅和碳化硅熔点较高的是_______ (填化学式);
(2)硅和卤素单质反应可以得到 ,
, 的熔沸点如下表:
的熔沸点如下表:
①0℃时, 、
、 、
、 、
、 呈液态的是
呈液态的是____ (填化学式),沸点依次升高的原因是_____ ,气态 分子的空间构型是
分子的空间构型是_______ ;
② 与N-甲基咪唑
与N-甲基咪唑 反应可以得到
反应可以得到 ,其结构如图所示:
,其结构如图所示:

N-甲基咪唑分子中碳原子的杂化轨道类型为_______ ,H、C、N的电负性由大到小的顺序为_______ ,1个 中含有
中含有_______ 个 键;
键;
(3)下图是 、
、 、
、 三种元素形成的某化合物的晶胞示意图。
三种元素形成的某化合物的晶胞示意图。
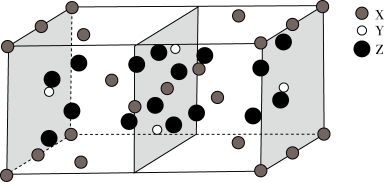
①已知化合物中 和
和 的原子个数比为1:4,图中Z表示
的原子个数比为1:4,图中Z表示_______ 原子(填元素符号),该化合物的化学式为_______ ;
②已知该晶胞的晶胞参数分别为anm、bnm、cnm, ,则该晶体的密度
,则该晶体的密度
_______  (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,用含a、b、c、
,用含a、b、c、 的代数式表示)。
的代数式表示)。
(1)基态硅原子最外层的电子排布图为
(2)硅和卤素单质反应可以得到
 ,
, 的熔沸点如下表:
的熔沸点如下表: |  |  |  | |
| 熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
 、
、 、
、 、
、 呈液态的是
呈液态的是 分子的空间构型是
分子的空间构型是②
 与N-甲基咪唑
与N-甲基咪唑 反应可以得到
反应可以得到 ,其结构如图所示:
,其结构如图所示:
N-甲基咪唑分子中碳原子的杂化轨道类型为
 中含有
中含有 键;
键;(3)下图是
 、
、 、
、 三种元素形成的某化合物的晶胞示意图。
三种元素形成的某化合物的晶胞示意图。
①已知化合物中
 和
和 的原子个数比为1:4,图中Z表示
的原子个数比为1:4,图中Z表示②已知该晶胞的晶胞参数分别为anm、bnm、cnm,
 ,则该晶体的密度
,则该晶体的密度
 (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,用含a、b、c、
,用含a、b、c、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2021-06-09更新
|
8779次组卷
|
14卷引用:2021年新高考湖南化学高考真题
2021年新高考湖南化学高考真题(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)2021年湖南省高考化学试卷变式题11-19(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题19 物质结构与性质-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷15题 物质结构与性质综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题18 物质结构与性质(综合题)-三年(2020-2022)高考真题分项汇编山东省菏泽市单县第二中学2021-2022学年高二3月月考化学试题(已下线)第五章 物质结构与性质 元素周期律 第32讲 物质结构与性质综合题研究(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)
7 . C、S、Cr、Cu及其化合物在化工、材料等方面应用十分广泛。回答下列问题:
(1)二甲基亚砜(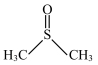 )所含元素的电负性由大到小的顺序为
)所含元素的电负性由大到小的顺序为_______ 。所含碳原子和硫原子的杂化类型分别为_______ 、_______ 。
(2)25℃时,顺-丁烯二酸( )和反-丁烯二酸(
)和反-丁烯二酸(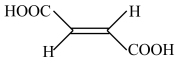 )的电离平衡常数如下表。
)的电离平衡常数如下表。
结合氢键,分析顺-丁烯二酸的K1明显大于反-丁烯二酸的原因是_______ 。
(3)元素Cr位于元素周期表中_______ 区,其基态原子次外层电子数目为_______ 个,其基态原子价层电子的空间运动状态有_______ 种。
(4)某晶体晶胞结构如图所示,其中Cu均匀分散在立方体内,NA为阿伏加德罗常数的值。

①该化合物中铜粒子的价电子排布式为_______ ,a、b氧粒子的坐标参数依次为(0,0,0)、( ,
, ,
, ),则d点粒子的坐标参数为
),则d点粒子的坐标参数为_______ 。
②若a、b间的距离=xcm,计算该晶胞的密度_______ g/cm3(写表达式)。
(1)二甲基亚砜(
 )所含元素的电负性由大到小的顺序为
)所含元素的电负性由大到小的顺序为(2)25℃时,顺-丁烯二酸(
 )和反-丁烯二酸(
)和反-丁烯二酸( )的电离平衡常数如下表。
)的电离平衡常数如下表。| 物质 | 电离平衡常数 | |
| 顺-丁烯二酸 | K1=1.17×10-2 | K2=2.6×10-7 |
| 反-丁烯二酸 | K1=9.3×10-4 | K2=2.9×10-5 |
(3)元素Cr位于元素周期表中
(4)某晶体晶胞结构如图所示,其中Cu均匀分散在立方体内,NA为阿伏加德罗常数的值。

①该化合物中铜粒子的价电子排布式为
 ,
, ,
, ),则d点粒子的坐标参数为
),则d点粒子的坐标参数为②若a、b间的距离=xcm,计算该晶胞的密度
您最近一年使用:0次
解题方法
8 . 2020年某科研团队经多次实验发现一种新型漂白剂(结构见下图),可用于漂白蚕丝等织品,其组成元素均为短周期元素,W、X对应的简单离子核外电子排布相同,且W、Y、Z的最外层电子数之和等于X的最外层电子数,下列说法错误的是


| A.四种元素中X的电负性最大 |
| B.该物质中含有2mol配位键 |
| C.Y的最高价氧化物的水化物是一元弱酸 |
| D.离子半径:Z+˂W2+<X2- |
您最近一年使用:0次
解题方法
9 . 非金属元素及其化合物在生产、生活中占据重要地位。回答下列问题:
(1)基态Se原子核外电子占据的最高能级符号为____ ,该能级的电子云轮廓图形为_____ 形。
(2)H2O、H2S、H2Se的沸点由高到低的顺序为_____ (填化学式,下同),酸性由强到弱的顺序为______ 。
(3)下列分子或离子与CO2具有相同类型的化学键和立体结构的是_______ (填标号)。
a.SO2 b.CS2 c.OF2 d.NO
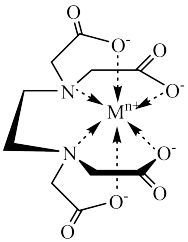
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。EDTA螯合物的结构如下图所示,EDTA的配体数为_____ ,EDTA中C原子的杂化方式为_____ ,1molEDTA通过螯合作用形成了_____ mol五元环。
(1)基态Se原子核外电子占据的最高能级符号为
(2)H2O、H2S、H2Se的沸点由高到低的顺序为
(3)下列分子或离子与CO2具有相同类型的化学键和立体结构的是
a.SO2 b.CS2 c.OF2 d.NO

(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。EDTA螯合物的结构如下图所示,EDTA的配体数为

您最近一年使用:0次
解题方法
10 . 卤族元素是重要的非金属元素,用途广泛。回答下列问题:
(1)卤族元素位于元素周期表___________ 区,其中电负性最大的是___________ (填元素符号)。
(2)基态氟原子核外有___________ 种运动状态不同的电子,其中含有单电子的轨道形状为___________ 。
(3)溴元素对应的含氧酸 HBrO4酸性比 HBrO3酸性___________ (填“强”或“弱”),原因是___________ 。
(4)化合物 I3 AsF6为离子化合物,其中阳离子(I )中心原子的杂化方式为
)中心原子的杂化方式为___________ 。该晶体中不含有的化学键类型为___________ (填选项字母)。
a.配位键 b.金属键 c.极性键 d.非极性键
(5)由钾、氧、碘三种元素构成的晶体晶胞结构如图1所示。则该晶体的化学式为___________ ,晶胞中位置与 K+紧邻的 O 的个数为___________ 。
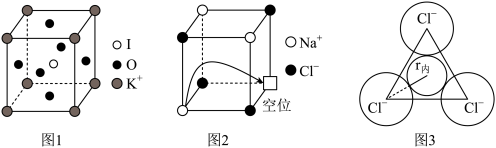
(6)有“点缺陷”的 NaCl 晶体可导电,其结构如图 2 所示。有人认为:高温下有“点缺陷”的 NaCl 晶体能导电,是因为 Na+经过一个由 3 个 Cl-组成的最小三角形窗孔(如图 3 所示),迁移到另一空位而造成的。已知立方体边长 a=282pm,粒子半径 r(Na+)=115pm,r(Cl-)=167pm,计算内切圆半径 r内的值并判断该观点是否正确___________ 。(已知: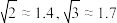 )
)
(1)卤族元素位于元素周期表
(2)基态氟原子核外有
(3)溴元素对应的含氧酸 HBrO4酸性比 HBrO3酸性
(4)化合物 I3 AsF6为离子化合物,其中阳离子(I
 )中心原子的杂化方式为
)中心原子的杂化方式为a.配位键 b.金属键 c.极性键 d.非极性键
(5)由钾、氧、碘三种元素构成的晶体晶胞结构如图1所示。则该晶体的化学式为

(6)有“点缺陷”的 NaCl 晶体可导电,其结构如图 2 所示。有人认为:高温下有“点缺陷”的 NaCl 晶体能导电,是因为 Na+经过一个由 3 个 Cl-组成的最小三角形窗孔(如图 3 所示),迁移到另一空位而造成的。已知立方体边长 a=282pm,粒子半径 r(Na+)=115pm,r(Cl-)=167pm,计算内切圆半径 r内的值并判断该观点是否正确
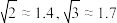 )
)
您最近一年使用:0次



