1 . 氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,制备少量Mg(ClO3)2·6H2O的工艺流程如下:
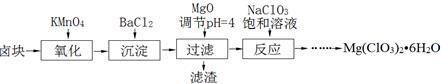
已知:
①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
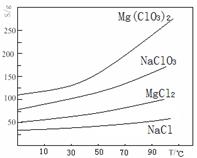
②几种化合物的溶解度(S)随温度(T)变化曲线如右图所示。
(1)过滤所需要的主要玻璃仪器有 ,加MgO后过滤所得滤渣的主要成分为 。
(2)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:
① ;② ;③ ;④过滤、洗涤。
(3)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10 mL于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1 FeSO4溶液,微热。此过程中反应的离子方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7 溶液滴定步骤2中多余的Fe2+至终点。
此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4: ,平均消耗K2Cr2O7 溶液15.00 mL。
①题中所用FeSO4溶液中,常加入适量稀硫酸和铁粉以抑制其变质。其中,加稀硫酸的作用是(用离子方程式解释): 。
②步骤4中空缺的内容为 。
③产品中Mg(ClO3)2·6H2O(摩尔质量为299g/mol)的质量分数为 。

已知:
①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②几种化合物的溶解度(S)随温度(T)变化曲线如右图所示。

(1)过滤所需要的主要玻璃仪器有 ,加MgO后过滤所得滤渣的主要成分为 。
(2)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:
① ;② ;③ ;④过滤、洗涤。
(3)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10 mL于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1 FeSO4溶液,微热。此过程中反应的离子方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7 溶液滴定步骤2中多余的Fe2+至终点。
此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4: ,平均消耗K2Cr2O7 溶液15.00 mL。
①题中所用FeSO4溶液中,常加入适量稀硫酸和铁粉以抑制其变质。其中,加稀硫酸的作用是(用离子方程式解释): 。
②步骤4中空缺的内容为 。
③产品中Mg(ClO3)2·6H2O(摩尔质量为299g/mol)的质量分数为 。
您最近一年使用:0次
11-12高三上·江苏泰州·期中
解题方法
2 . (1)有人研究证明:使用氯气作自来水消毒剂,氯气会与水中有机物反应,生成如CHCl3等物质,这些物质可能是潜在的致癌致畸物质。目前人们已研发多种饮用水的新型消毒剂。下列物质不能作自来水消毒剂的是____________ (填序号)。
(2)高铁(VI)酸盐(如Na2FeO4)是新一代水处理剂。其制备方法有:次氯酸盐氧化法(湿法)和高温过氧化物法(干法)等。湿法是在碱性溶液中用次氯酸盐氧化铁(III)盐,写出该法的离子方程式:
__________________________________________________ 。
(3)用高铁(VI)酸盐设计的高铁(VI)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应:3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH
①写出正极发生的电极反应式:______________________________ 。
②用高铁(VI)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当电池中有0.2molK2FeO4反应时,则在电解池中生成H2________ L(标准状况)。
③下表列出了某厂排放的含锌废水中的含量及国家环保标准值的有关数据:
该厂只用调节pH处理废水,当调整为pH=7时,此时废水中Zn2+的浓度为______________ mg/L,_____________ (填“符合”或“不符合”)国家环保标准。(常温下,Ksp[Zn(OH)2]=1.2×10-17)
| A.硫酸铜 | B.二氧化氯 | C.臭氧 | D.硫酸亚铁 |
(2)高铁(VI)酸盐(如Na2FeO4)是新一代水处理剂。其制备方法有:次氯酸盐氧化法(湿法)和高温过氧化物法(干法)等。湿法是在碱性溶液中用次氯酸盐氧化铁(III)盐,写出该法的离子方程式:
(3)用高铁(VI)酸盐设计的高铁(VI)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应:3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH
①写出正极发生的电极反应式:
②用高铁(VI)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当电池中有0.2molK2FeO4反应时,则在电解池中生成H2
③下表列出了某厂排放的含锌废水中的含量及国家环保标准值的有关数据:
| 某厂含锌废水水质 | 国家环保标准值 | |
| Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
该厂只用调节pH处理废水,当调整为pH=7时,此时废水中Zn2+的浓度为
您最近一年使用:0次



