名校
1 . 废旧显示屏玻璃中含SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得 Ce(OH)4和硫酸铁铵矾[Fe2(SO4) 3•(NH4) 2SO4•24H2O]流程设计如下:
回答以下问题:
(1)反应②中H2O2的作用是___________ 。
(2)反应③的离子方程式是________ 。
(3)已知有机物 HT 能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+ (水层)+ 6HT(有机层) 2CeT3 (有机层)+ 6H+(水层),从平衡角度解释:向 CeT3 (有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是
2CeT3 (有机层)+ 6H+(水层),从平衡角度解释:向 CeT3 (有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是_______ 。
(4)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是___________ 。
(5)用滴定法测定制得的 Ce(OH)4 产品纯度。____ 。(填“偏大”、“偏小”或“无影响”)。

回答以下问题:
(1)反应②中H2O2的作用是
(2)反应③的离子方程式是
(3)已知有机物 HT 能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+ (水层)+ 6HT(有机层)
 2CeT3 (有机层)+ 6H+(水层),从平衡角度解释:向 CeT3 (有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是
2CeT3 (有机层)+ 6H+(水层),从平衡角度解释:向 CeT3 (有机层)加入H2SO4获得较纯的含Ce3+的水溶液的原因是(4)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是
(5)用滴定法测定制得的 Ce(OH)4 产品纯度。

您最近一年使用:0次
2019-07-17更新
|
215次组卷
|
2卷引用:江苏省无锡市江阴市三校联考2023-2024学年高二下学期4月期中联考化学试题
名校
2 . 以SO2、软锰矿(主要成分MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4溶液和Mn3O4,主要实验步骤如下:

步骤Ⅰ:如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2 = MnSO4)。
步骤Ⅱ:充分反应后,在不断搅拌下依次向三口烧瓶中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅等重金属。
步骤Ⅲ:过滤得MnSO4溶液。
(1)装置A用于制取SO2,反应的化学方程式为_____ 。
(2)装置B中反应应控制在90~100℃,适宜的加热方式是_____ 。
(3)装置C的作用是_____ 。
(4)“步骤Ⅱ”中加入纯净MnO2的目的是_____ ,用MnCO3调节溶液pH时,需调节溶液pH范围为_____ (该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下)。
(5)已知:①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:

②反应温度超过80℃时,Mn3O4产率开始降低。
③Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.03%、62.5%。
请补充完整由步骤Ⅲ得到的MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:_____ ,真空干燥6小时得产品Mn3O4。

步骤Ⅰ:如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2 = MnSO4)。
步骤Ⅱ:充分反应后,在不断搅拌下依次向三口烧瓶中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅等重金属。
步骤Ⅲ:过滤得MnSO4溶液。
(1)装置A用于制取SO2,反应的化学方程式为
(2)装置B中反应应控制在90~100℃,适宜的加热方式是
(3)装置C的作用是
(4)“步骤Ⅱ”中加入纯净MnO2的目的是
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
| 开始沉淀pH | 7.04 | 1.87 | 3.32 | 7.56 |
| 沉淀完全pH | 9.18 | 3.27 | 4.9 | 10.2 |
 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示: 
②反应温度超过80℃时,Mn3O4产率开始降低。
③Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.03%、62.5%。
请补充完整由步骤Ⅲ得到的MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:
您最近一年使用:0次
2019-02-13更新
|
454次组卷
|
2卷引用:江苏省苏州市第一中学2019-2020高二下学期期中考试化学试题
名校
解题方法
3 . 一种以生石灰(CaO)为原料制备KClO3的流程如下:
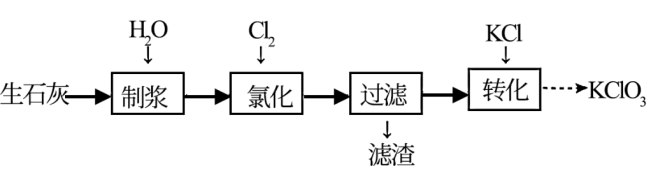
注:氯化过程中Cl2与Ca(OH)2作用生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2。
(1)制浆过程中发生的化学反应方程式为___________ 。
(2)氯化过程中须缓慢通入Cl2。
①缓慢通入Cl2的目的是___________ 。
②生成Ca(ClO)2的化学方程式为___________ 。
③氯化过程中会有少量无色无味气体生成,该气体可能是___________ (填化学式)。
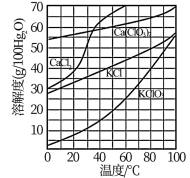
(3)根据如图的溶解度曲线,回答下列问题。
向滤液中加入过量KCl固体可将溶液中Ca(ClO3)2转化为KClO3固体而析出的原因是___________ 。若溶液中KClO3的含量为100g∙L−1,从该溶液中尽可能多地析出KClO3固体的方法是___________ 。

注:氯化过程中Cl2与Ca(OH)2作用生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2。
(1)制浆过程中发生的化学反应方程式为
(2)氯化过程中须缓慢通入Cl2。
①缓慢通入Cl2的目的是
②生成Ca(ClO)2的化学方程式为
③氯化过程中会有少量无色无味气体生成,该气体可能是
(3)根据如图的溶解度曲线,回答下列问题。
向滤液中加入过量KCl固体可将溶液中Ca(ClO3)2转化为KClO3固体而析出的原因是

您最近一年使用:0次
2021-01-27更新
|
278次组卷
|
2卷引用:江苏省盐城市田家炳中学2021-2022学年高一上学期期中考试化学试题
4 . 氯化铜在工农业生产中具有重要的用途。某化学兴趣小组设计如图所示装置,用CuCl2·2H2O晶体和SOCl2获取无水CuCl2并回收过量的SOCl2。回答下列问题:
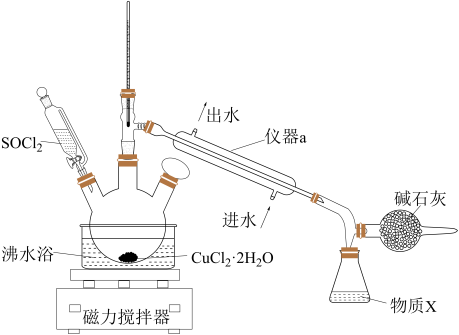
已知:①SOCl2的熔点为-105 ℃,沸点为76 ℃,遇水剧烈水解生成两种酸性气体。②三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2 CuCl2+2SO2↑+4HCl↑
CuCl2+2SO2↑+4HCl↑
(1)仪器a的名称是______ ,锥形瓶中得到的物质X的化学式为______ 。
(2)碱石灰中含有CaO和NaOH,碱石灰的作用是______ 。
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.2800 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL(滴定反应为I2+2S2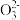 =S4
=S4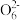 +2I-)。
+2I-)。
①滴定到终点时的现象是______ 。
②该试样中铜元素的百分含量为______ 。

已知:①SOCl2的熔点为-105 ℃,沸点为76 ℃,遇水剧烈水解生成两种酸性气体。②三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2
 CuCl2+2SO2↑+4HCl↑
CuCl2+2SO2↑+4HCl↑(1)仪器a的名称是
(2)碱石灰中含有CaO和NaOH,碱石灰的作用是
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.2800 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL(滴定反应为I2+2S2
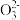 =S4
=S4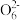 +2I-)。
+2I-)。①滴定到终点时的现象是
②该试样中铜元素的百分含量为
您最近一年使用:0次
2020-12-30更新
|
189次组卷
|
3卷引用:江苏省马坝高级中学2021-2022学年高二上学期期中考试化学(必修)试题
5 . 工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO和SiO2,不考虑其它杂质)制备七水合硫酸亚铁(FeSO4·7H2O)晶体,流程如下:
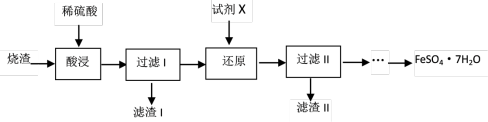
(1)为提高浸取率,可以采取的措施是___________ (填写其中的一条即可)。滤渣I的主要成分是___________ (填写化学式)
(2)如果滤渣II的成分是Fe,写出“还原”过程中发生反应的离子方程式___________ 。
(3)从分离出滤渣II后的滤液中得到产品,应进行的操作是蒸发浓缩、___________ 、过滤、洗涤、干燥。
(4)FeSO4·7H2O在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤I:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配制成250 mL溶液;
步骤II:取上述溶液25.00 mL于锥形瓶中,加入少量硫酸酸化,逐滴滴加0.0100 mol·L -1 KMnO4溶液,反应为:5Fe2++MnO +8H+=5Fe3++Mn2++4H2O。记录滴定终点时消耗KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应)。
+8H+=5Fe3++Mn2++4H2O。记录滴定终点时消耗KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应)。
步骤Ⅲ:重复“步骤II”2~3次,平均消耗KMnO4溶液的体积为20.00 mL。
①步骤I中,配制溶液需要的玻璃仪器有烧杯、玻璃棒、___________ 、胶头滴管。
②该补血剂中亚铁离子的含量为___________ mg/片(写出计算过程)。

(1)为提高浸取率,可以采取的措施是
(2)如果滤渣II的成分是Fe,写出“还原”过程中发生反应的离子方程式
(3)从分离出滤渣II后的滤液中得到产品,应进行的操作是蒸发浓缩、
(4)FeSO4·7H2O在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤I:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配制成250 mL溶液;
步骤II:取上述溶液25.00 mL于锥形瓶中,加入少量硫酸酸化,逐滴滴加0.0100 mol·L -1 KMnO4溶液,反应为:5Fe2++MnO
 +8H+=5Fe3++Mn2++4H2O。记录滴定终点时消耗KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应)。
+8H+=5Fe3++Mn2++4H2O。记录滴定终点时消耗KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应)。步骤Ⅲ:重复“步骤II”2~3次,平均消耗KMnO4溶液的体积为20.00 mL。
①步骤I中,配制溶液需要的玻璃仪器有烧杯、玻璃棒、
②该补血剂中亚铁离子的含量为
您最近一年使用:0次
6 . 二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题:
(1)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:____ 。
②溶液X中大量存在的阴离子有____ 。
(2)用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是____ (填标号)。
a 明矾 b 碘化钾 c 盐酸 d 硫酸亚铁
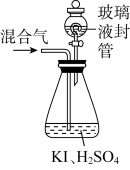
(3)用如图装置可以测定混合气中 ClO2的含量:
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;(ClO2+I-+H+ → I2+H2O+Cl-)
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用 0.1000 mol·L—1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O =2I-+S4O
=2I-+S4O )指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
)指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①玻璃液封装置的作用是____ 。
②测得混合气中ClO2的质量为____ g(写出计算过程)。
(1)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
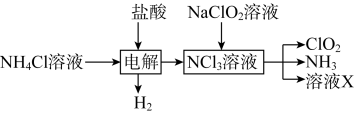
②溶液X中大量存在的阴离子有
(2)用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是
a 明矾 b 碘化钾 c 盐酸 d 硫酸亚铁
(3)用如图装置可以测定混合气中 ClO2的含量:
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;(ClO2+I-+H+ → I2+H2O+Cl-)
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用 0.1000 mol·L—1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O
 =2I-+S4O
=2I-+S4O )指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
)指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:①玻璃液封装置的作用是
②测得混合气中ClO2的质量为
您最近一年使用:0次
2020-11-26更新
|
173次组卷
|
2卷引用:江苏省启东市2021届高三上学期期中考试化学试题
解题方法
7 . 工业上用绿矾制取还原性铁粉的简单工艺流程如下:

(1)绿矾用酸浸而不用水浸的原因是____ ;转化过程中为了加快转化速率,需适当加热,但是温度不宜过高的原因是____ 。
(2)干燥过程是为了脱去沉淀FeCO3∙nH2O表面的水和结晶水,该过程会产生一种杂质FeO(OH),写出化学方程式:____ ;为了避免干燥过程中生成FeO(OH),正确操作是____ 。
(3)下图是焙烧过程中加CaCO3与未加CaCO3的铁粉产率变化图,请分析加入CaCO3导致铁粉产率提高的原因:____ 。

(4)还原性铁粉中含有少量的FexC,用下列装置通过检测CO2来测定还原性铁粉中碳的含量,则各装置的连接顺序为____ 。


(1)绿矾用酸浸而不用水浸的原因是
(2)干燥过程是为了脱去沉淀FeCO3∙nH2O表面的水和结晶水,该过程会产生一种杂质FeO(OH),写出化学方程式:
(3)下图是焙烧过程中加CaCO3与未加CaCO3的铁粉产率变化图,请分析加入CaCO3导致铁粉产率提高的原因:

(4)还原性铁粉中含有少量的FexC,用下列装置通过检测CO2来测定还原性铁粉中碳的含量,则各装置的连接顺序为

您最近一年使用:0次
名校
8 . 钛矿工业中的酸性废水富含Ti、Fe等元素,其综合利用如下(已知:TiO2+易水解,只能存在于强酸性溶液中):
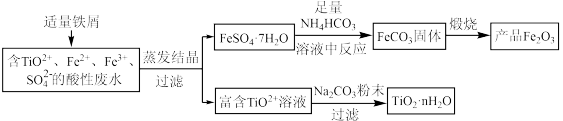
(1)富含TiO2+溶液中加入Na2CO3粉末能得到固体TiO2•nH2O,其原理是______________ 。
(2)制取FeCO3发生的化学方程式为______________________ ;反应温度一般需控制在35℃以下,其目的是______________ 。
(3)已知Ksp[Fe(OH)2]=8×10-16。制取FeCO3时,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6mol·L-1。试判断所得的FeCO3中______ (填“有”或“没有”)Fe(OH)2;煅烧中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是_________ 。
(4)为了控制NH4HCO3用量需要测定固体中FeSO4•7H2O的含量。称1g固体样品,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol·L-1KMnO4标准溶液滴定到溶液刚好变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有:
MnO4-(紫红)+5Fe2++8H+=Mn2+(粉红)+5Fe3++4H2O
5Fe3+(黄)+2H3PO4=H3[Fe(PO4)2](无色)+3H+
①H3PO4的作用____________ 。②样品中FeSO4•7H2O的含量为___________ %。
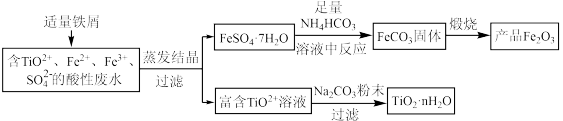
(1)富含TiO2+溶液中加入Na2CO3粉末能得到固体TiO2•nH2O,其原理是
(2)制取FeCO3发生的化学方程式为
(3)已知Ksp[Fe(OH)2]=8×10-16。制取FeCO3时,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6mol·L-1。试判断所得的FeCO3中
(4)为了控制NH4HCO3用量需要测定固体中FeSO4•7H2O的含量。称1g固体样品,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol·L-1KMnO4标准溶液滴定到溶液刚好变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有:
MnO4-(紫红)+5Fe2++8H+=Mn2+(粉红)+5Fe3++4H2O
5Fe3+(黄)+2H3PO4=H3[Fe(PO4)2](无色)+3H+
①H3PO4的作用
您最近一年使用:0次
名校
9 . 某兴趣小组模拟工业制漂白粉,设计了如下图所示的实验装置。
已知:①氯气与碱反应放出热量。②6Cl2+6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O。
试回答下列问题:

(1)甲装置中仪器a的名称是________________________ 。
(2)装置乙中饱和食盐水的作用是________________________ 。
(3)装置丁中发生反应的化学方程式为_____________________ 。
(4)漂白粉在空气中失效的原因是______________ 、______________ (用化学方程式表示)。
(5)①该小组制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2],其主要原因是________ 。
②为提高Ca(ClO)2的含量。可采取的措施是___________ (任写一种即可)。
已知:①氯气与碱反应放出热量。②6Cl2+6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O。
试回答下列问题:

(1)甲装置中仪器a的名称是
(2)装置乙中饱和食盐水的作用是
(3)装置丁中发生反应的化学方程式为
(4)漂白粉在空气中失效的原因是
(5)①该小组制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2],其主要原因是
②为提高Ca(ClO)2的含量。可采取的措施是
您最近一年使用:0次
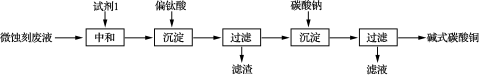
10 . 碱式碳酸铜可用于生产木材防腐剂等。工业上可用微蚀刻废液(含有一定量Cu2+、H+、SO42-、H2O2和微量Fe3+)制备高纯度碱式碳酸铜,其制备过程如下:
(1)试剂1最好选用_________ 。
a.Fe2O3 b.CaCO3 c.CuO
(2)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,写出该反应的化学方程式________________ 。
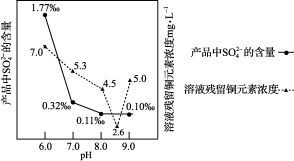
(3)加入Na2CO3沉淀时,反应液pH对产品中SO42-的含量以及反应液中Cu2+沉淀效率的影响如下图所示,第二次沉淀时溶液pH最好控制在________ 。
(4)所制得的碱式碳酸铜的组成可表示为:xCuCO3·yCu(OH)2·zH2O,要测定其组成,甲同学设计的实验方案中需要如下五个步骤:①称取12.0克的样品;②高温分解;③测出生成CO2的质量为2.2克;④测出生成水蒸气的质量为1.8克⑤称量生成CuO的质量为8.0g。计算出碱式碳酸铜的组成,写出计算过程。____________________________ 。
(1)试剂1最好选用
a.Fe2O3 b.CaCO3 c.CuO
(2)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,写出该反应的化学方程式
(3)加入Na2CO3沉淀时,反应液pH对产品中SO42-的含量以及反应液中Cu2+沉淀效率的影响如下图所示,第二次沉淀时溶液pH最好控制在
(4)所制得的碱式碳酸铜的组成可表示为:xCuCO3·yCu(OH)2·zH2O,要测定其组成,甲同学设计的实验方案中需要如下五个步骤:①称取12.0克的样品;②高温分解;③测出生成CO2的质量为2.2克;④测出生成水蒸气的质量为1.8克⑤称量生成CuO的质量为8.0g。计算出碱式碳酸铜的组成,写出计算过程。
您最近一年使用:0次



