1 . 铬酸铅[常温下,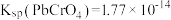 ]又称铬黄,常用于染料或颜料,某同学在实验室以
]又称铬黄,常用于染料或颜料,某同学在实验室以 为原料制备
为原料制备 ,实验步骤如下:
,实验步骤如下:
步骤1:称取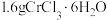 于
于 的烧杯中,加入
的烧杯中,加入 蒸馏水,搅拌使其溶解,逐滴滴入稍微过量的
蒸馏水,搅拌使其溶解,逐滴滴入稍微过量的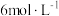 的
的 溶液;
溶液;
步骤2:向上述溶液中逐滴滴入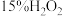 溶液,溶液由绿色变为黄色。加热煮沸
溶液,溶液由绿色变为黄色。加热煮沸 ,将多余的
,将多余的 赶尽,此时溶液变为亮黄色。再逐滴滴入
赶尽,此时溶液变为亮黄色。再逐滴滴入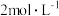 的硝酸溶液,亮黄色溶液又变为橙红色,此时溶液的
的硝酸溶液,亮黄色溶液又变为橙红色,此时溶液的 为4.6;
为4.6;
步骤3:在煮沸条件下逐滴滴入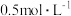 的
的 溶液,加入第一滴后先搅拌
溶液,加入第一滴后先搅拌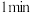 再加第2滴,每滴加一滴可以看到有黄色沉淀产生,滴加到不再有新的黄色沉淀产生时停止加入
再加第2滴,每滴加一滴可以看到有黄色沉淀产生,滴加到不再有新的黄色沉淀产生时停止加入 溶液。继续煮沸
溶液。继续煮沸 ,取下静置片刻,检验是否沉淀完全,过滤,产品用蒸馏水洗涤2~3次;
,取下静置片刻,检验是否沉淀完全,过滤,产品用蒸馏水洗涤2~3次;
步骤4:将沉淀放入烘箱中干燥、称重、计算产率。
已知:元素铬( )在溶液中主要以
)在溶液中主要以 (蓝紫色)、
(蓝紫色)、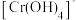 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在,
(黄色)等形式存在, 为难溶于水的灰蓝色固体。回答下列问题:
为难溶于水的灰蓝色固体。回答下列问题:
(1)实验室在配制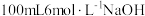 溶液时,下列仪器一定不需要的是___________(填字母)。
溶液时,下列仪器一定不需要的是___________(填字母)。
(2)步骤1中加入稍微过量的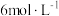 的
的 溶液过程中的现象是
溶液过程中的现象是___________ , 溶液不能过量太多,其原因是
溶液不能过量太多,其原因是___________ 。
(3)步骤2溶液中逐滴滴入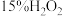 溶液,溶液由绿色变为黄色。发生反应的离子方程式为
溶液,溶液由绿色变为黄色。发生反应的离子方程式为___________ 。
(4)步骤2用硝酸调节 ,存在如下平衡:
,存在如下平衡: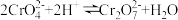 。已知
。已知 随
随 的变化如图所示。
的变化如图所示。 的平衡转化率
的平衡转化率___________ (填“增大”“减小”或“不变”)。
②升高温度,溶液中 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
___________ (填“>”或“<”)0。
(5)步骤3采用倾析法过滤,如图所示。下列关于该过滤方法的说法不正确的是___________(填字母)。
(6)对于步骤3,甲同学提出可用 代替
代替 作为原料,乙同学认为
作为原料,乙同学认为 难溶于水
难溶于水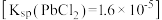 ,故设想不可能。甲同学进行实验,发现可以得到产品,但产量很低,其原因是
,故设想不可能。甲同学进行实验,发现可以得到产品,但产量很低,其原因是___________ 。
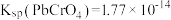 ]又称铬黄,常用于染料或颜料,某同学在实验室以
]又称铬黄,常用于染料或颜料,某同学在实验室以 为原料制备
为原料制备 ,实验步骤如下:
,实验步骤如下:步骤1:称取
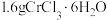 于
于 的烧杯中,加入
的烧杯中,加入 蒸馏水,搅拌使其溶解,逐滴滴入稍微过量的
蒸馏水,搅拌使其溶解,逐滴滴入稍微过量的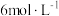 的
的 溶液;
溶液;步骤2:向上述溶液中逐滴滴入
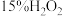 溶液,溶液由绿色变为黄色。加热煮沸
溶液,溶液由绿色变为黄色。加热煮沸 ,将多余的
,将多余的 赶尽,此时溶液变为亮黄色。再逐滴滴入
赶尽,此时溶液变为亮黄色。再逐滴滴入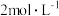 的硝酸溶液,亮黄色溶液又变为橙红色,此时溶液的
的硝酸溶液,亮黄色溶液又变为橙红色,此时溶液的 为4.6;
为4.6;步骤3:在煮沸条件下逐滴滴入
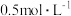 的
的 溶液,加入第一滴后先搅拌
溶液,加入第一滴后先搅拌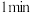 再加第2滴,每滴加一滴可以看到有黄色沉淀产生,滴加到不再有新的黄色沉淀产生时停止加入
再加第2滴,每滴加一滴可以看到有黄色沉淀产生,滴加到不再有新的黄色沉淀产生时停止加入 溶液。继续煮沸
溶液。继续煮沸 ,取下静置片刻,检验是否沉淀完全,过滤,产品用蒸馏水洗涤2~3次;
,取下静置片刻,检验是否沉淀完全,过滤,产品用蒸馏水洗涤2~3次;步骤4:将沉淀放入烘箱中干燥、称重、计算产率。
已知:元素铬(
 )在溶液中主要以
)在溶液中主要以 (蓝紫色)、
(蓝紫色)、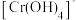 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在,
(黄色)等形式存在, 为难溶于水的灰蓝色固体。回答下列问题:
为难溶于水的灰蓝色固体。回答下列问题:(1)实验室在配制
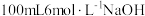 溶液时,下列仪器一定不需要的是___________(填字母)。
溶液时,下列仪器一定不需要的是___________(填字母)。A. | B. | C. | D.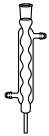 |
(2)步骤1中加入稍微过量的
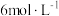 的
的 溶液过程中的现象是
溶液过程中的现象是 溶液不能过量太多,其原因是
溶液不能过量太多,其原因是(3)步骤2溶液中逐滴滴入
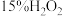 溶液,溶液由绿色变为黄色。发生反应的离子方程式为
溶液,溶液由绿色变为黄色。发生反应的离子方程式为(4)步骤2用硝酸调节
 ,存在如下平衡:
,存在如下平衡: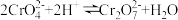 。已知
。已知 随
随 的变化如图所示。
的变化如图所示。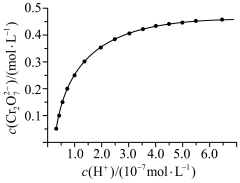
 的平衡转化率
的平衡转化率②升高温度,溶液中
 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
(5)步骤3采用倾析法过滤,如图所示。下列关于该过滤方法的说法不正确的是___________(填字母)。
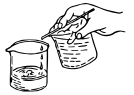
| A.该方法适用于过滤胶状沉淀或颗粒较小的沉淀 |
| B.使用该方法过滤后,若沉淀物要洗涤,可注入水(或其他洗涤液),充分搅拌后使沉淀沉降,再进行过滤 |
| C.这种过滤方法可以避免沉淀堵塞滤纸小孔而影响过滤速度 |
| D.该操作中玻璃棒的作用为引流 |
(6)对于步骤3,甲同学提出可用
 代替
代替 作为原料,乙同学认为
作为原料,乙同学认为 难溶于水
难溶于水 ,故设想不可能。甲同学进行实验,发现可以得到产品,但产量很低,其原因是
,故设想不可能。甲同学进行实验,发现可以得到产品,但产量很低,其原因是
您最近一年使用:0次
2 . 室温下,用 的二甲胺
的二甲胺 溶液(二甲胺在水中的电离与一水合氨相似)滴定
溶液(二甲胺在水中的电离与一水合氨相似)滴定 盐酸溶液。溶液
盐酸溶液。溶液 随加入二甲胺溶液体积变化曲线如图所示(忽略溶液混合时的体积变化)。下列说法正确的是
随加入二甲胺溶液体积变化曲线如图所示(忽略溶液混合时的体积变化)。下列说法正确的是
 的二甲胺
的二甲胺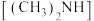 溶液(二甲胺在水中的电离与一水合氨相似)滴定
溶液(二甲胺在水中的电离与一水合氨相似)滴定 盐酸溶液。溶液
盐酸溶液。溶液 随加入二甲胺溶液体积变化曲线如图所示(忽略溶液混合时的体积变化)。下列说法正确的是
随加入二甲胺溶液体积变化曲线如图所示(忽略溶液混合时的体积变化)。下列说法正确的是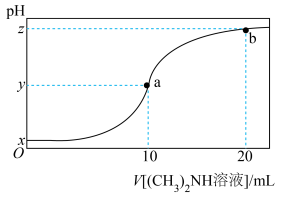
| A.x=1,y=7 |
B.a、b两点的溶液中, 不相等 不相等 |
| C.本实验应该选择酚酞作指示剂 |
D.b点溶液中存在: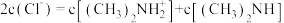 |
您最近一年使用:0次
解题方法
3 . 硼(B)、钴( )和锰(
)和锰( )形成的物质在生产、生活中应用广泛。回答下列问题:
)形成的物质在生产、生活中应用广泛。回答下列问题:
(1)基态 原子核外电子排布式为
原子核外电子排布式为___________ ,在第二周期中,第一电离能比N高的元素是___________ (填元素符号)。
(2)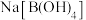 可用于织物漂白。
可用于织物漂白。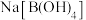 的化学键除了共价键外,还存在
的化学键除了共价键外,还存在___________ 。
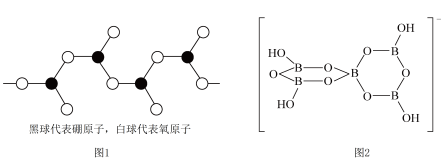
(3)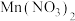 工业制备中常用的催化剂,
工业制备中常用的催化剂,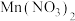 中阴离子的空间构型为
中阴离子的空间构型为___________ ;写出一种与其互为等电子体的分子式:___________ 。
(4)如图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为___________ (以n表示硼原子的个数);___________ 。
(5)立方 和立方
和立方 均为共价晶体,结构相似,
均为共价晶体,结构相似, 的熔点高于
的熔点高于 的原因是
的原因是___________ 。
(6)一种新型轻质储氢材料的晶胞结构如图所示,设阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
 )和锰(
)和锰( )形成的物质在生产、生活中应用广泛。回答下列问题:
)形成的物质在生产、生活中应用广泛。回答下列问题:(1)基态
 原子核外电子排布式为
原子核外电子排布式为(2)
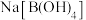 可用于织物漂白。
可用于织物漂白。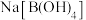 的化学键除了共价键外,还存在
的化学键除了共价键外,还存在(3)
 工业制备中常用的催化剂,
工业制备中常用的催化剂,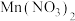 中阴离子的空间构型为
中阴离子的空间构型为(4)如图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为
(5)立方
 和立方
和立方 均为共价晶体,结构相似,
均为共价晶体,结构相似, 的熔点高于
的熔点高于 的原因是
的原因是(6)一种新型轻质储氢材料的晶胞结构如图所示,设阿伏加德罗常数的值为
 ,该晶体的密度为
,该晶体的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
4 . 近期我国科学家报道了一种低成本高储能液流电池,其工作原理如下图。下列说法中错误的是
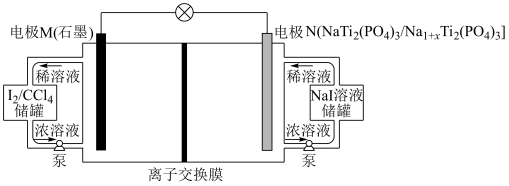
| A.电极M为正极 |
| B.离子交换膜应选用阳离子交换膜 |
C.电极N上发生反应的电极反应为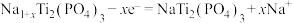 |
D.理论上N电极质量减少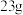 ,电路中转移的电子数目为 ,电路中转移的电子数目为 |
您最近一年使用:0次
2024-06-12更新
|
135次组卷
|
2卷引用:2024届陕西省部分学校高三下学期5月份高考适应性考试理科综合试题-高中化学
5 . 铁及其化合物在化工生产中发挥着重要作用。回答下列问题:
(1)一定温度下,在某密闭无氧环境中热分解 ,反应的热化学方程式为
,反应的热化学方程式为 。反应生成的混合气体中
。反应生成的混合气体中 的物质的量分数为
的物质的量分数为___________ 。反应达平衡后,缩小容器体积,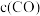
___________ (填“增大”“减小”或“不变”)。
(2)将 置入抽空的刚性容器中,升高温度,发生分解反应:
置入抽空的刚性容器中,升高温度,发生分解反应: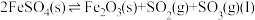 。平衡时
。平衡时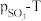 的关系如图所示。
的关系如图所示。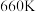 时,该反应的平衡总压
时,该反应的平衡总压
___________  ,压强平衡常数
,压强平衡常数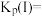
___________ 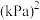 (压强平衡常数是用分压代表平衡浓度,分压=总压×物质的量分数)。
(压强平衡常数是用分压代表平衡浓度,分压=总压×物质的量分数)。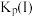 随反应温度升高而
随反应温度升高而___________ (填“增大”“减小”或“不变”)。 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 首先与表面的
首先与表面的 产生疏松多孔的产物
产生疏松多孔的产物 ,随着反应的进行,Fe2O3不断减少,产物层不断加厚,如图所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。
,随着反应的进行,Fe2O3不断减少,产物层不断加厚,如图所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。 “再生”时转化为Fe2O3的化学方程式:
“再生”时转化为Fe2O3的化学方程式:___________ 。
②“再生”时若 浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是
浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是___________ 。
(1)一定温度下,在某密闭无氧环境中热分解
 ,反应的热化学方程式为
,反应的热化学方程式为 。反应生成的混合气体中
。反应生成的混合气体中 的物质的量分数为
的物质的量分数为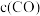
(2)将
 置入抽空的刚性容器中,升高温度,发生分解反应:
置入抽空的刚性容器中,升高温度,发生分解反应: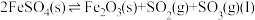 。平衡时
。平衡时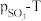 的关系如图所示。
的关系如图所示。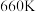 时,该反应的平衡总压
时,该反应的平衡总压
 ,压强平衡常数
,压强平衡常数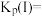
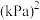 (压强平衡常数是用分压代表平衡浓度,分压=总压×物质的量分数)。
(压强平衡常数是用分压代表平衡浓度,分压=总压×物质的量分数)。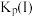 随反应温度升高而
随反应温度升高而
 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 首先与表面的
首先与表面的 产生疏松多孔的产物
产生疏松多孔的产物 ,随着反应的进行,Fe2O3不断减少,产物层不断加厚,如图所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。
,随着反应的进行,Fe2O3不断减少,产物层不断加厚,如图所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。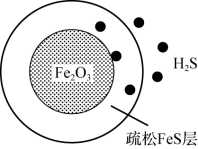
 “再生”时转化为Fe2O3的化学方程式:
“再生”时转化为Fe2O3的化学方程式:②“再生”时若
 浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是
浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是
您最近一年使用:0次
名校
解题方法
6 .  在生物学、医学等领域有重要应用,传统制氢成本高、技术复杂,研究新型制氢意义重大,已成为科学家研究的重要课题。回答下列问题:
在生物学、医学等领域有重要应用,传统制氢成本高、技术复杂,研究新型制氢意义重大,已成为科学家研究的重要课题。回答下列问题:
(1)我国科学家发现,Rh催化单分子甲酸分解制 的过程如图1所示,其中带“*”的物种表示吸附在Rh表面,该反应过程中决定反应速率步骤的化学方程式为
的过程如图1所示,其中带“*”的物种表示吸附在Rh表面,该反应过程中决定反应速率步骤的化学方程式为___________ ;甲酸分解制 的热化学方程式可表示为
的热化学方程式可表示为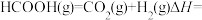
_______  (下图为单分子甲酸分解相对能量变化,能量单位为eV,阿伏加德罗常数用
(下图为单分子甲酸分解相对能量变化,能量单位为eV,阿伏加德罗常数用 表示)。
表示)。 可直接分解制取
可直接分解制取 ,反应的原理如下:
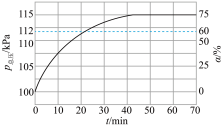
,反应的原理如下: 。实际生产中向刚性容器中同时通入
。实际生产中向刚性容器中同时通入 和水蒸气,水蒸气与反应体系的任何物质均不发生反应,测得容器总压(
和水蒸气,水蒸气与反应体系的任何物质均不发生反应,测得容器总压(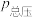 )和
)和 的转化率(α)随时间的变化关系如图所示。计算反应在0~20min内的平均反应速率
的转化率(α)随时间的变化关系如图所示。计算反应在0~20min内的平均反应速率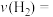
_____  ;平衡时,
;平衡时,
_____ kPa,平衡常数
_____ kPa,(Kp为以分压表示的平衡常数)。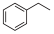 )气体催化脱氢法制取
)气体催化脱氢法制取 ,同时生成苯乙烯(
,同时生成苯乙烯(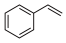 )气体。其他条件不变时,在不同催化剂(n、m、p)作用下,反应进行相同时间后,乙苯的转化率随反应温度的变化如图所示。相同温度下,三种催化剂(n、m、p)的催化活性由高到低的顺序为
)气体。其他条件不变时,在不同催化剂(n、m、p)作用下,反应进行相同时间后,乙苯的转化率随反应温度的变化如图所示。相同温度下,三种催化剂(n、m、p)的催化活性由高到低的顺序为___________ ;b点乙苯的转化率高于a点的原因是___________ 。
 在生物学、医学等领域有重要应用,传统制氢成本高、技术复杂,研究新型制氢意义重大,已成为科学家研究的重要课题。回答下列问题:
在生物学、医学等领域有重要应用,传统制氢成本高、技术复杂,研究新型制氢意义重大,已成为科学家研究的重要课题。回答下列问题:(1)我国科学家发现,Rh催化单分子甲酸分解制
 的过程如图1所示,其中带“*”的物种表示吸附在Rh表面,该反应过程中决定反应速率步骤的化学方程式为
的过程如图1所示,其中带“*”的物种表示吸附在Rh表面,该反应过程中决定反应速率步骤的化学方程式为 的热化学方程式可表示为
的热化学方程式可表示为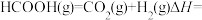
 (下图为单分子甲酸分解相对能量变化,能量单位为eV,阿伏加德罗常数用
(下图为单分子甲酸分解相对能量变化,能量单位为eV,阿伏加德罗常数用 表示)。
表示)。
 可直接分解制取
可直接分解制取 ,反应的原理如下:
,反应的原理如下: 。实际生产中向刚性容器中同时通入
。实际生产中向刚性容器中同时通入 和水蒸气,水蒸气与反应体系的任何物质均不发生反应,测得容器总压(
和水蒸气,水蒸气与反应体系的任何物质均不发生反应,测得容器总压(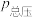 )和
)和 的转化率(α)随时间的变化关系如图所示。计算反应在0~20min内的平均反应速率
的转化率(α)随时间的变化关系如图所示。计算反应在0~20min内的平均反应速率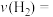
 ;平衡时,
;平衡时,

 )气体催化脱氢法制取
)气体催化脱氢法制取 ,同时生成苯乙烯(
,同时生成苯乙烯( )气体。其他条件不变时,在不同催化剂(n、m、p)作用下,反应进行相同时间后,乙苯的转化率随反应温度的变化如图所示。相同温度下,三种催化剂(n、m、p)的催化活性由高到低的顺序为
)气体。其他条件不变时,在不同催化剂(n、m、p)作用下,反应进行相同时间后,乙苯的转化率随反应温度的变化如图所示。相同温度下,三种催化剂(n、m、p)的催化活性由高到低的顺序为
您最近一年使用:0次
名校
7 . 为保护环境、充分利用金属资源,以红土镍镉矿(NiS、CdO,含 、CuO、PbO、
、CuO、PbO、 等杂质)为原料通过下图流程回收金属Ni、Cd和Cu:
等杂质)为原料通过下图流程回收金属Ni、Cd和Cu:
②水溶液中物质得失电子的能力可用标准电极电势[E(高价态/低价态)]衡量,E越大说明高价态物质的氧化性越强、E越小说明低价态物质的还原性越强。
回答下列问题:
(1)“浆化”的目的是___________ 。
(2)滤渣I中含有硫单质,写出“酸浸”时NiS反应的离子方程式___________ ;滤渣I中还含有___________ (填化学式)。
(3)溶液中金属离子开始沉淀和完全沉淀时(浓度≤10-5mol/L)的pH如下表所示,则物质X所调pH范围为___________ 。
(4)电解时阴极的电极反应有___________ 、___________ 。
(5)金属A是___________ ,整个流程中可以循环使用的化合物有 和
和___________ (填化学式)。
 、CuO、PbO、
、CuO、PbO、 等杂质)为原料通过下图流程回收金属Ni、Cd和Cu:
等杂质)为原料通过下图流程回收金属Ni、Cd和Cu:
②水溶液中物质得失电子的能力可用标准电极电势[E(高价态/低价态)]衡量,E越大说明高价态物质的氧化性越强、E越小说明低价态物质的还原性越强。
| 物质 |  /Cu /Cu |  /Pb /Pb |  /Cd /Cd |  /Fe /Fe |  /Ni /Ni |
| E/V | +0.34 | -0.13 | -0.40 | -0.44 | 0.26 |
(1)“浆化”的目的是
(2)滤渣I中含有硫单质,写出“酸浸”时NiS反应的离子方程式
(3)溶液中金属离子开始沉淀和完全沉淀时(浓度≤10-5mol/L)的pH如下表所示,则物质X所调pH范围为
| 离子 |  |  |  |  |  |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 | 4.7 | 6.8 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 | 6.7 | 9.2 |
(4)电解时阴极的电极反应有
(5)金属A是
 和
和
您最近一年使用:0次
8 . 电镀在工业生产中具有重要作用,某电镀厂生产的废水经预处理后含有 和少量的
和少量的 、
、 ,能够采用如图流程进行逐一分离,实现资源再利用。
,能够采用如图流程进行逐一分离,实现资源再利用。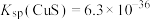 和
和 。
。
回答下列问题:
(1) 中Cr元素的化合价为
中Cr元素的化合价为___________ 。
(2)还原池中有 生成,反应的离子方程式为
生成,反应的离子方程式为___________ 。
(3)沉淀1为 ,其性质与
,其性质与 相似,则
相似,则 与NaOH溶液反应的化学方程式
与NaOH溶液反应的化学方程式___________ 。
(4) 溶液呈碱性的原因是
溶液呈碱性的原因是___________ (用离子方程式表示),沉淀2为___________ 。
(5)利用膜电解技术(装置如图所示),以 为主要原料制备
为主要原料制备 的总反应方程式为:
的总反应方程式为: 。
。___________ (填“阴”或“阳”,下同)离子交换膜, 在
在___________ (填“阴”或“阳”)极室制得。
 和少量的
和少量的 、
、 ,能够采用如图流程进行逐一分离,实现资源再利用。
,能够采用如图流程进行逐一分离,实现资源再利用。
 和
和 。
。回答下列问题:
(1)
 中Cr元素的化合价为
中Cr元素的化合价为(2)还原池中有
 生成,反应的离子方程式为
生成,反应的离子方程式为(3)沉淀1为
 ,其性质与
,其性质与 相似,则
相似,则 与NaOH溶液反应的化学方程式
与NaOH溶液反应的化学方程式(4)
 溶液呈碱性的原因是
溶液呈碱性的原因是(5)利用膜电解技术(装置如图所示),以
 为主要原料制备
为主要原料制备 的总反应方程式为:
的总反应方程式为: 。
。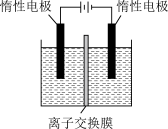
 在
在
您最近一年使用:0次
9 . 手性甲脒四氢异喹啉( )是D-荷态牡丹碱全合成的重要原料。其合成路线如下:
)是D-荷态牡丹碱全合成的重要原料。其合成路线如下:
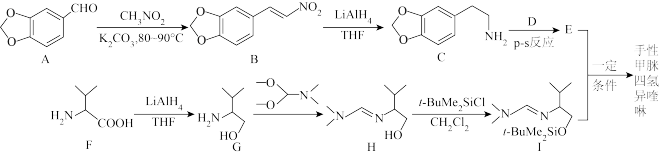
已知: 反应为
反应为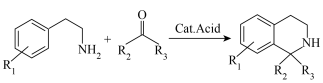 。
。
(1)等浓度的F和G的水溶液的碱性:F比G
(2)A与
 反应生成B经历了如下反应过程:A→X→B,X的分子式为
反应生成B经历了如下反应过程:A→X→B,X的分子式为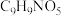 ,则X→B的反应类型为
,则X→B的反应类型为(3)E的结构简式为
(4)G→H的另一种有机产物的结构简式为
(5)写出同时满足下列条件的C的一种同分异构体的结构简式:
①能发生银镜反应和水解反应,且水解产物之一遇
 溶液能发生显色反应;
溶液能发生显色反应;②含有4种等效氢原子。
(6)已知:

 ,写出以
,写出以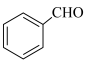 和
和 为原料制备
为原料制备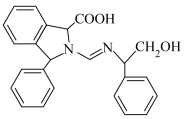 的合成路线流程图
的合成路线流程图
您最近一年使用:0次
10 . 钴基变形高温合金是指含钴40%~70%的铸造合金,具有较好的抗氧化和抗热腐蚀性。制备某钴基变形高温合金的废料中主要含有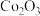 ,还含有少量
,还含有少量 、
、 及铝、镁、钙等金属元素的氧化物。用该废料采用酸溶法回收
及铝、镁、钙等金属元素的氧化物。用该废料采用酸溶法回收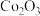 的工业流程如图所示。
的工业流程如图所示。 、
、 、
、 、
、 、
、 、
、 等。
等。
②部分阳离子以氢氧化物形式开始沉淀和沉淀完全(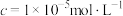 )时的pH见下表。
)时的pH见下表。
(1)“溶浸”前,通常需要将合金废料粉碎,这样做的目的是___________ 。“溶浸”时加入 的作用是
的作用是___________ 。
(2)“滤液1”中加入 溶液的作用是
溶液的作用是___________ (用离子方程式表示)。得到“滤渣2”时需要加 溶液调节溶液的
溶液调节溶液的 范围是
范围是___________ 。
(3)已知:25℃时, 、
、 。向“滤液2”中加入
。向“滤液2”中加入 溶液的目的是将溶液中的
溶液的目的是将溶液中的 与
与 转化为氮化物沉淀。如果“滤液2”中的
转化为氮化物沉淀。如果“滤液2”中的 ,则开始滴加
,则开始滴加 溶液时,首先析出的沉淀是
溶液时,首先析出的沉淀是___________ (填化学式),已知当加入过量 溶液后,所得滤液中
溶液后,所得滤液中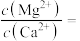
___________ 。
(4) 在空气中充分煅烧,除得到产品外,还生成了
在空气中充分煅烧,除得到产品外,还生成了 ,写出该反应的化学方程式:
,写出该反应的化学方程式:___________ 。
(5)若将草酸铵溶液换为碳酸氢钠溶液,可将 转化为
转化为 沉淀,反应的离子方程式为
沉淀,反应的离子方程式为___________ 。
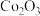 ,还含有少量
,还含有少量 、
、 及铝、镁、钙等金属元素的氧化物。用该废料采用酸溶法回收
及铝、镁、钙等金属元素的氧化物。用该废料采用酸溶法回收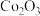 的工业流程如图所示。
的工业流程如图所示。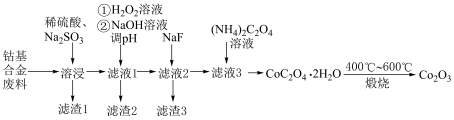
 、
、 、
、 、
、 、
、 、
、 等。
等。②部分阳离子以氢氧化物形式开始沉淀和沉淀完全(
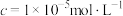 )时的pH见下表。
)时的pH见下表。| 沉淀物 |  |  |  |  |  |
| 开始沉淀时的pH | 6.6 | 7.6 | 2.7 | 3.4 | 9.2 |
| 沉淀完全时的pH | 9.2 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“溶浸”前,通常需要将合金废料粉碎,这样做的目的是
 的作用是
的作用是(2)“滤液1”中加入
 溶液的作用是
溶液的作用是 溶液调节溶液的
溶液调节溶液的 范围是
范围是(3)已知:25℃时,
 、
、 。向“滤液2”中加入
。向“滤液2”中加入 溶液的目的是将溶液中的
溶液的目的是将溶液中的 与
与 转化为氮化物沉淀。如果“滤液2”中的
转化为氮化物沉淀。如果“滤液2”中的 ,则开始滴加
,则开始滴加 溶液时,首先析出的沉淀是
溶液时,首先析出的沉淀是 溶液后,所得滤液中
溶液后,所得滤液中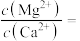
(4)
 在空气中充分煅烧,除得到产品外,还生成了
在空气中充分煅烧,除得到产品外,还生成了 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(5)若将草酸铵溶液换为碳酸氢钠溶液,可将
 转化为
转化为 沉淀,反应的离子方程式为
沉淀,反应的离子方程式为
您最近一年使用:0次



