解题方法
1 . TiO2在工业生产和日常生活中有重要用途。
I、工业上用钛铁矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:

其中,步骤③发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)写出钛元素在周期表中的位置______________ 。
净化钛矿石时,是否需要除去杂质FeO?________ (填“需要”或“不需要”)
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中两性氧化物发生反应的离子反应方程式:____________________ 。
(3)④中加入的X可能是( )
A.H2O2 B.KMnO4 C.KOH D.SO2
(4)④⑤两步的目的是___________________________ 。
(5)写出⑥的化学反应方程式_____________________ 。
II、TiO2可通过下述两种方法制备金属钛:方法一是电解TiO2来获得Ti(同时产生O2):
将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。
(6)阴极反应的电极反应式为_____________________ 。
(7)电解过程中需定期向电解槽池中加入碳块的原因是__________________ 。
方法二是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:
TiO2 (s) +2Cl2 (g) TiCl4(1)+O2 (g) △H=" +151" kJ/mol
TiCl4(1)+O2 (g) △H=" +151" kJ/mol
所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4。请从反应原理角度说明该反应难进行的原因__________________ 。
I、工业上用钛铁矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:

其中,步骤③发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)写出钛元素在周期表中的位置
净化钛矿石时,是否需要除去杂质FeO?
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中两性氧化物发生反应的离子反应方程式:
(3)④中加入的X可能是
A.H2O2 B.KMnO4 C.KOH D.SO2
(4)④⑤两步的目的是
(5)写出⑥的化学反应方程式
II、TiO2可通过下述两种方法制备金属钛:方法一是电解TiO2来获得Ti(同时产生O2):
将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。
(6)阴极反应的电极反应式为
(7)电解过程中需定期向电解槽池中加入碳块的原因是
方法二是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:
TiO2 (s) +2Cl2 (g)
 TiCl4(1)+O2 (g) △H=" +151" kJ/mol
TiCl4(1)+O2 (g) △H=" +151" kJ/mol所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4。请从反应原理角度说明该反应难进行的原因
您最近一年使用:0次
解题方法
2 . 钼酸钠(Na2MoO4)具有广泛的用途.可做新型水处理荆、优良的金属缓蚀剂及可用于局部过热的循环水系统;Al(OH)3工业和医药上都具有重要用途.现从某废钼催化剂(主要成分MoO3、Al2O3、Fe2O3等)中回收Na2MoO4和Al(OH)3,其工艺如图:
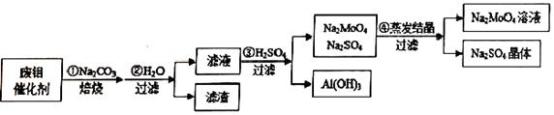
回答下列问题:
(1)已知MoO3、Al2O3与SiO2相似,均能在高温下跟Na2CO3发生类似反应,试写出MoO3与Na2CO3反应的化学方程式:__________________ 。
(2)第②步操作所后的滤液中,溶质有Na2MoO4、_________ 和过量的Na2CO3;检验第②步操作所得滤渣中含有三价铁的方法是___________________ 。
(3)第③步操作H2SO4需要适量,通常是通过_________ 来调控H2SO4的用量;与Na2SO4相比,Na2MoO4的溶解度受温度的影响变化__________ (填“较大”或“较小”)。
(4)利用铝热反应可回收金属钼。将所得钼酸钠溶液用酸处理得到沉淀,再加热可得MoO3。写出MoO3发生铝热反应的化学方程式:_________________ 。
(5)取废钼催化剂5.00g,加入5.30gNa2CO3(足量),经上述实验操作后,最终得到2.34g Al(OH)3和6.39gNa2SO4晶体,则废钼催化剂中Al2O3、MoO3的物质的量的比值为_______ 。

回答下列问题:
(1)已知MoO3、Al2O3与SiO2相似,均能在高温下跟Na2CO3发生类似反应,试写出MoO3与Na2CO3反应的化学方程式:
(2)第②步操作所后的滤液中,溶质有Na2MoO4、
(3)第③步操作H2SO4需要适量,通常是通过
(4)利用铝热反应可回收金属钼。将所得钼酸钠溶液用酸处理得到沉淀,再加热可得MoO3。写出MoO3发生铝热反应的化学方程式:
(5)取废钼催化剂5.00g,加入5.30gNa2CO3(足量),经上述实验操作后,最终得到2.34g Al(OH)3和6.39gNa2SO4晶体,则废钼催化剂中Al2O3、MoO3的物质的量的比值为
您最近一年使用:0次
名校
3 . A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为__________________ 。写出E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式____________________________________ 。
(2)由A、B、W三种元素组成的18电子微粒的分子式为____________________ 。
(3)经测定A2W2为二元弱酸,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式_________________________________________ 。
(4)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I-时,共转移3mol电子,该反应的离子方程式是___________________________________ 。
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是_________ L(标准状况下)。
(1)E元素在周期表中的位置为
(2)由A、B、W三种元素组成的18电子微粒的分子式为
(3)经测定A2W2为二元弱酸,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式
(4)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I-时,共转移3mol电子,该反应的离子方程式是
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是
您最近一年使用:0次
2016-12-09更新
|
1339次组卷
|
4卷引用:2016届山东省泰安市高三上学期期末考试化学试卷
解题方法
4 . 含氮的化合物在化学反应中变化复杂。I.现用下图所示仪器(夹持装置已省略及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。已知:①NO+NO2+2OH-=2NO2-+H2O;②气体液化的温度:NO2 21℃、NO -152℃。
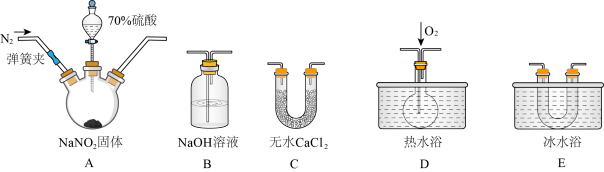
(1)为了检验装置A中生成的气体产物,上述仪器的连接顺序(按左→右连接)为__________ 。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是:____________ 。
(3)在关闭弹簧夹,滴入70%硫酸后,A中产生红棕色气体。
①盛装70%浓硫酸的仪器名称是___________ ;
②实验确认有NO的现象是______________________ 。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是______________ 。
Ⅱ.NH3经一系列反应可以得到HNO3和NH4NO3,如图1所示。


图1 图2
【资料卡片】
a.NH4NO3是一种白色晶体,易溶于水,微溶于乙醇.
b.在230℃ 以上时,同时有弱光:2NH4NO3=2N2↑+ O2↑+ 4H2O
c.在400℃以上时,剧烈分解发生爆炸:4NH4NO3=3N2↑+ 2NO2↑+ 8H2O
(5)如图2 将水滴入盛有硝酸铵的试管中,观察到的A处液面上升,B处液面下降,产生该现象的原因_______________ 。
(6)实验室可以用氯化铵和熟石灰反应来制备氨气,该反应的化学方程式是____________ (填“能”或“不能”)_____ 用硝酸铵代替氯化铵。
(7)在汽车发生碰撞时,NaN3会产生________ (填化学式)气体充满安全气囊来减轻碰撞事故中乘员伤害程度。
(8)完成离子反应IV:______ NO+ _______ H2O=______ +______ +____ H+。

(1)为了检验装置A中生成的气体产物,上述仪器的连接顺序(按左→右连接)为
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是:
(3)在关闭弹簧夹,滴入70%硫酸后,A中产生红棕色气体。
①盛装70%浓硫酸的仪器名称是
②实验确认有NO的现象是
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是
Ⅱ.NH3经一系列反应可以得到HNO3和NH4NO3,如图1所示。


图1 图2
【资料卡片】
a.NH4NO3是一种白色晶体,易溶于水,微溶于乙醇.
b.在230℃ 以上时,同时有弱光:2NH4NO3=2N2↑+ O2↑+ 4H2O
c.在400℃以上时,剧烈分解发生爆炸:4NH4NO3=3N2↑+ 2NO2↑+ 8H2O
(5)如图2 将水滴入盛有硝酸铵的试管中,观察到的A处液面上升,B处液面下降,产生该现象的原因
(6)实验室可以用氯化铵和熟石灰反应来制备氨气,该反应的化学方程式是
(7)在汽车发生碰撞时,NaN3会产生
(8)完成离子反应IV:
您最近一年使用:0次
2016-12-09更新
|
748次组卷
|
2卷引用:2015-2016学年重庆市巴蜀中学高一下3月月考化学试卷
解题方法
5 . 海带中含有丰富的碘,,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
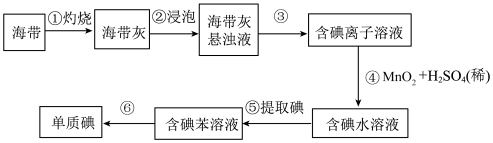
请填写下列空白:
(1)步骤①所需要的硅酸盐仪器是___________ ,步骤③的实验操作是___________ 。
(2)步骤⑤中,某学生选择用苯来提取碘水中的单质碘的理由是_____ 。(选填序号)
a.单质碘与苯不发生化学反应 b.碘在苯中溶解度小
c.碘在苯中溶解度大 d.苯与水互不相溶
(3)提取碘的过程中,不能使用的有机溶剂是_________ 。(选填序号)
a.酒精 b.汽油 c.四氯化碳
(4)步骤④中所发生的离子反应方程式______________ 。
(5)已知:2Fe3++2I-→2Fe2++I2氯气既可以氧化Fe2+,也可以氧化I-。 往FeI2溶液中通入一定量的 Cl2,反应完成后,溶液中有1/2Fe2+被氧化,请写出该反应的化学反应方程式:____________ 。

请填写下列空白:
(1)步骤①所需要的硅酸盐仪器是
(2)步骤⑤中,某学生选择用苯来提取碘水中的单质碘的理由是
a.单质碘与苯不发生化学反应 b.碘在苯中溶解度小
c.碘在苯中溶解度大 d.苯与水互不相溶
(3)提取碘的过程中,不能使用的有机溶剂是
a.酒精 b.汽油 c.四氯化碳
(4)步骤④中所发生的离子反应方程式
(5)已知:2Fe3++2I-→2Fe2++I2氯气既可以氧化Fe2+,也可以氧化I-。 往FeI2溶液中通入一定量的 Cl2,反应完成后,溶液中有1/2Fe2+被氧化,请写出该反应的化学反应方程式:
您最近一年使用:0次
6 . 某研究小组将纯净的SO2气体通入0.1mol•L-1的Ba(NO3)2溶液中,得到了BaSO4沉淀.为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
(2)为深入研究该反应,该小组还测得上述两个实验中溶液pH随通入SO2体积的变化曲线如图:

实验1中溶液pH变小的原因是_______________ ;V1时,实验2中溶液pH小于实验1的原因是_______________ (用离子方程式表示)。
(3)该小组还设计了实验验证假设二,请在实验4横线处写出实验步骤。
假设一:溶液中的NO3-
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25mL0.1mol•L-1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
| 实验2:在盛有不含O2的25mL0.1mol•L-1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |

实验1中溶液pH变小的原因是
(3)该小组还设计了实验验证假设二,请在实验4横线处写出实验步骤。
| 实验步骤 | 实验现象 | 结论 |
| 实验3:在盛有不含O2的25m10.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | ||
| 实验4: |
您最近一年使用:0次
解题方法
7 . 锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231 ℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为________ 。
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是__________________ ;此锡粉样品中锡的质量分数:____________ 。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
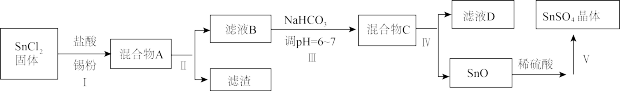
①步骤Ⅰ加入Sn粉的作用:____________________ 及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、________________________ 。
③步骤Ⅲ生成SnO的离子方程式:__________________________ 。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是___________________ ,证明已洗净。
⑤步骤Ⅴ操作依次为___________________ 、过滤、洗涤、低温干燥。
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:_____________ 。实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是_______________
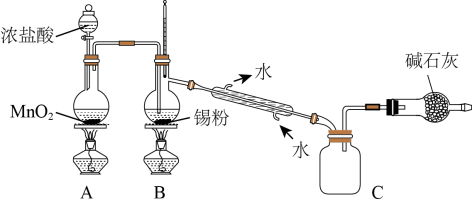
(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是______________________ 。
(1)元素锡比同主族碳的周期数大3,锡的原子序数为
(2)用于微电子器件生产的锡粉纯度测定:
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe2(SO4)3;
③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
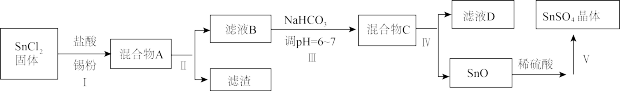
①步骤Ⅰ加入Sn粉的作用:
②步骤Ⅱ用到的玻璃仪器有烧杯、
③步骤Ⅲ生成SnO的离子方程式:
④步骤Ⅳ中检验SnO是否洗涤干净的操作是
⑤步骤Ⅴ操作依次为
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:

(5)利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是
您最近一年使用:0次
2016-12-09更新
|
257次组卷
|
4卷引用:2015届天津市河西区高三下学期总复习质量调查(二)化学试卷
8 . 亚硝酸钠是一种工业盐,用途广泛;外观与食盐非常相似,但毒性较强。某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:
㈠鉴别NaCl和NaNO2
(1)测定溶液pH
用pH试纸分别测定0.1mol•L-1两种盐溶液的pH,测得NaNO2溶液呈碱性.NaNO2溶液呈碱性的原因是__________ (用离子方程式解释),NaNO2溶液中c(HNO2)=__________ (用溶液中其它离子的浓度关系式表示)。
(2)沉淀法
取2mL0.1mol•L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液,两支试管均产生白色沉淀,分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。该温度下Ksp(AgNO2)=2×10-8 (mol•L-1)2; Ksp(AgCl)=1.8×10-10(mol•L-1)2,则反应AgNO2(s)+Cl-(aq)═AgCl(s)+NO2-(aq)的化学平衡常数K=__________ (计算结果写成分数)。
(二)实验室可用如下装置(略去部分夹持仪器)备亚硝酸钠。
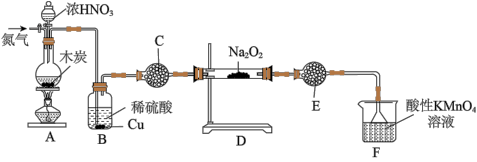
已知:①2NO+Na2O2=2NaNO2;②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(3)加热装置A前,先通一段时间N2,目的是__________ 。
(4)装置A中发生反应的化学方程式为__________ ,装置B的作用是__________ 。
(5)仪器C的名称为__________ ,其中盛放的药品为__________ (填名称)。
㈠鉴别NaCl和NaNO2
(1)测定溶液pH
用pH试纸分别测定0.1mol•L-1两种盐溶液的pH,测得NaNO2溶液呈碱性.NaNO2溶液呈碱性的原因是
(2)沉淀法
取2mL0.1mol•L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液,两支试管均产生白色沉淀,分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。该温度下Ksp(AgNO2)=2×10-8 (mol•L-1)2; Ksp(AgCl)=1.8×10-10(mol•L-1)2,则反应AgNO2(s)+Cl-(aq)═AgCl(s)+NO2-(aq)的化学平衡常数K=
(二)实验室可用如下装置(略去部分夹持仪器)备亚硝酸钠。

已知:①2NO+Na2O2=2NaNO2;②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(3)加热装置A前,先通一段时间N2,目的是
(4)装置A中发生反应的化学方程式为
(5)仪器C的名称为
您最近一年使用:0次
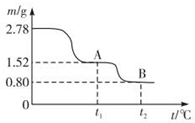
9 . 在中国古代,炼丹家以绿矾(FeSO4•7H2O为原料,放在炼丹炉中煅烧可制得绿矾油.绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈.如图是2.78g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线.将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g.
(1)绿矾油主要成份的化学式为_________ .t1~t2.发生反应的化学方程式为_________________ .
(2)若将2.88g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到1.44g黑色细粉,则可推知该黑色细粉为_________ .
(3)以下是FeSO4•7H2O的实验室制备流理图.
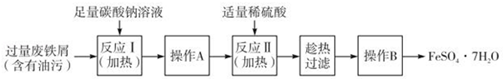
根据题意完成下列填空:
①反应II需要100mL1. 5mol•L﹣1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1.84g•cm﹣3的浓H2SO4配制.所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及____________ .
②操作A的名称为_____________ .
③测定FeSO4•7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法.已知称取6.0g FeSO4•7H2O产品,配制成溶液,用硫酸酸化的0.2000mol•L﹣1KMnO4溶液滴定,消耗KMnO4溶液的体积为20.00mL.发生反应的离子方程式为_______________ ,计算上述样品中FeSO4•7H2O的质量分数为_________ (保留两位有效数字).
(1)绿矾油主要成份的化学式为
(2)若将2.88g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到1.44g黑色细粉,则可推知该黑色细粉为
(3)以下是FeSO4•7H2O的实验室制备流理图.

根据题意完成下列填空:

①反应II需要100mL1. 5mol•L﹣1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1.84g•cm﹣3的浓H2SO4配制.所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及
②操作A的名称为
③测定FeSO4•7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法.已知称取6.0g FeSO4•7H2O产品,配制成溶液,用硫酸酸化的0.2000mol•L﹣1KMnO4溶液滴定,消耗KMnO4溶液的体积为20.00mL.发生反应的离子方程式为
您最近一年使用:0次
解题方法
10 . 天津港“8.12”特别重大爆炸事故教训深刻。氰化钠(N元素显﹣3价)属于剧毒化学品,处理氰化物的方法主要有两种:
(1)碱性氯化法是在碱性条件下通入氯气,氯气将CN﹣氧化成无污染的气体。请补充并配平该反应的离子方程式:CN﹣+OH﹣+Cl2═CO2+ + +H2O。处理35吨NaCN,理论上需要液氯 吨。
(2)过氧化氢氧化法:NaCN+H2O2+H2O═NaHCO3+NH3↑。检测水坑里氰化钠的浓度,取水样1mL,加入11mL1mol•L﹣1H2O2溶液,充分反应后,加入过量的KI固体,充分反应后调节pH至7左右,用0.2500mol•L﹣1Na2S2O3溶液8.00mL(已知:实验中涉及的部分离子方程式为: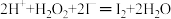 、
、 )。请计算水坑里氰化钠的浓度。
)。请计算水坑里氰化钠的浓度。
(1)碱性氯化法是在碱性条件下通入氯气,氯气将CN﹣氧化成无污染的气体。请补充并配平该反应的离子方程式:CN﹣+OH﹣+Cl2═CO2+ + +H2O。处理35吨NaCN,理论上需要液氯 吨。
(2)过氧化氢氧化法:NaCN+H2O2+H2O═NaHCO3+NH3↑。检测水坑里氰化钠的浓度,取水样1mL,加入11mL1mol•L﹣1H2O2溶液,充分反应后,加入过量的KI固体,充分反应后调节pH至7左右,用0.2500mol•L﹣1Na2S2O3溶液8.00mL(已知:实验中涉及的部分离子方程式为:
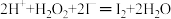 、
、 )。请计算水坑里氰化钠的浓度。
)。请计算水坑里氰化钠的浓度。
您最近一年使用:0次



