1 . 将 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收
的混合溶液中回收 ,其转化如图所示(
,其转化如图所示( 不溶于水)。下列说法错误的是
不溶于水)。下列说法错误的是

 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收
的混合溶液中回收 ,其转化如图所示(
,其转化如图所示( 不溶于水)。下列说法错误的是
不溶于水)。下列说法错误的是
A.整个转化过程中 可以循环使用 可以循环使用 |
B.过程②中,发生反应的离子方程式为 |
C.过程中 数量不变,当有 数量不变,当有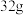 硫生成时,消耗 硫生成时,消耗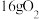 |
| D.过程①发生复分解反应 |
您最近一年使用:0次
名校
解题方法
2 . 从干海带中提取碘的实验流程如下:
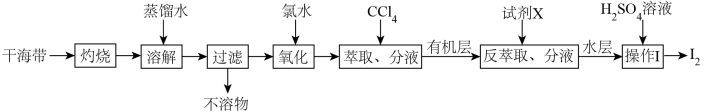
| A.氧化步骤中氯水可用过氧化氢代替 |
B.试剂X可以为 ,反萃取的离子方程式为: ,反萃取的离子方程式为: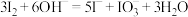 |
C. 可循环利用以有效提高干海带提碘的产率 可循环利用以有效提高干海带提碘的产率 |
| D.操作Ⅰ要用到普通漏斗、烧杯和玻璃棒 |
您最近一年使用:0次
2024-01-28更新
|
573次组卷
|
6卷引用:湖南省岳阳市 岳阳县第一中学2023-2024学年高一下学期开学化学试题
名校
解题方法
3 . 以含钼( )废催化剂(含
)废催化剂(含 ,以及
,以及 、
、 、
、 等)为原料制备
等)为原料制备 ,其过程表示如下:
,其过程表示如下: 固体置于焙烧炉中,通入足量空气加热至
固体置于焙烧炉中,通入足量空气加热至 充分反应。焙烧过程中
充分反应。焙烧过程中 转化为
转化为 的化学方程式为
的化学方程式为___________ 。
(2)浸取。将焙烧所得固体加水浸泡,然后过滤、洗涤。过滤后所得滤液中存在的阴离子有 、
、 、
、___________ 。欲提高单位时间内钼的浸取率,可以采取的措施有___________ (任写一点)。
(3)除杂。向浸取后的滤液中通入过量 ,过滤。通入过量
,过滤。通入过量 的目的
的目的___________ 。
(4)制备。向上述(3)所得滤液中加入硝酸调节溶液的 小于6,使
小于6,使 转化为
转化为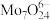 ,然后加入
,然后加入 充分反应,析出
充分反应,析出 ,灼烧后可得到
,灼烧后可得到 。灼烧
。灼烧 得到
得到 的化学方程式为
的化学方程式为___________ 。
(5)应用。将 制成
制成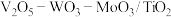 催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得
催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得 的转化率随温度的变化关系如图所示。在温度
的转化率随温度的变化关系如图所示。在温度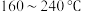 之间,
之间, 转化率不高的原因是
转化率不高的原因是___________ 。
 )废催化剂(含
)废催化剂(含 ,以及
,以及 、
、 、
、 等)为原料制备
等)为原料制备 ,其过程表示如下:
,其过程表示如下: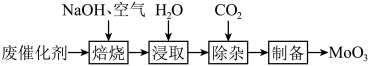
 固体置于焙烧炉中,通入足量空气加热至
固体置于焙烧炉中,通入足量空气加热至 充分反应。焙烧过程中
充分反应。焙烧过程中 转化为
转化为 的化学方程式为
的化学方程式为(2)浸取。将焙烧所得固体加水浸泡,然后过滤、洗涤。过滤后所得滤液中存在的阴离子有
 、
、 、
、(3)除杂。向浸取后的滤液中通入过量
 ,过滤。通入过量
,过滤。通入过量 的目的
的目的(4)制备。向上述(3)所得滤液中加入硝酸调节溶液的
 小于6,使
小于6,使 转化为
转化为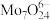 ,然后加入
,然后加入 充分反应,析出
充分反应,析出 ,灼烧后可得到
,灼烧后可得到 。灼烧
。灼烧 得到
得到 的化学方程式为
的化学方程式为(5)应用。将
 制成
制成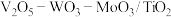 催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得
催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得 的转化率随温度的变化关系如图所示。在温度
的转化率随温度的变化关系如图所示。在温度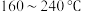 之间,
之间, 转化率不高的原因是
转化率不高的原因是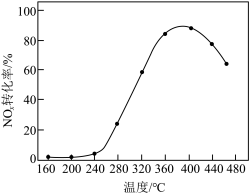
您最近一年使用:0次
2024-01-28更新
|
834次组卷
|
3卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期末测试化学试题
湖南省株洲市第一中学2021-2022学年高三上学期期末测试化学试题2024届江苏省连云港市高三第一次调研考试(一模)化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
解题方法
4 . 如图是无机物A~F在一定条件下的转化关系(部分产物及反应条件未标出)。
已知:A为气体,A~F都含有相同的元素。
(1)写出下列物质的化学式:C___________ 、F___________
(2)在①②③④中属于氮的固定的是___________ (填序号)
(3)D易溶于水。常温常压下(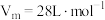 ),将体积为VmL的试管充满D后倒扣在水中。
),将体积为VmL的试管充满D后倒扣在水中。
①最终试管中所得E的物质的量浓度为(不考虑E的扩散)___________  。
。
②为了消除D的污染,可将它与B在催化剂作用下反应,生成水和一种无污染物质,该反应的化学方程式是___________ 。
③若C、D按物质的量之比1:1被 溶液吸收,只生成一种盐,则该反应的离子方程式是
溶液吸收,只生成一种盐,则该反应的离子方程式是___________ 。为提高吸收速率与效率,最好选用___________ 装置(填序号)。 的物质的量为
的物质的量为___________ 。
已知:A为气体,A~F都含有相同的元素。
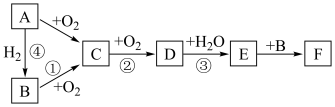
(1)写出下列物质的化学式:C
(2)在①②③④中属于氮的固定的是
(3)D易溶于水。常温常压下(
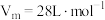 ),将体积为VmL的试管充满D后倒扣在水中。
),将体积为VmL的试管充满D后倒扣在水中。①最终试管中所得E的物质的量浓度为(不考虑E的扩散)
 。
。②为了消除D的污染,可将它与B在催化剂作用下反应,生成水和一种无污染物质,该反应的化学方程式是
③若C、D按物质的量之比1:1被
 溶液吸收,只生成一种盐,则该反应的离子方程式是
溶液吸收,只生成一种盐,则该反应的离子方程式是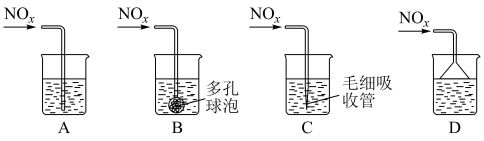
 的物质的量为
的物质的量为
您最近一年使用:0次
2024-01-28更新
|
279次组卷
|
4卷引用:湖南省衡阳市衡阳县第五中学2023-2024学年高一下学期第一次月考化学试题
5 . 从某废液(含有Fe3+、Fe2+、Cu2+、Cl-)中回收铜并制得纯净的FeCl3溶液。现以制得的纯净的FeCl3溶液为原料制取优良的水处理剂高铁酸钾(K2FeO4),其流程如图:
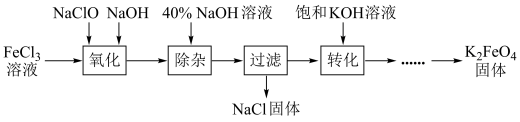
已知:高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定;具有强氧化性;与水作用产生Fe(OH)3。
(1)高铁酸钾(K2FeO4)在处理水过程中的作用是_________ 和_________ 。
(2)检验废液中含有Fe2+选用的试剂是__________ (填化学式)。
(3)“氧化”过程反应的离子方程式为__________ 。
(4)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品用______ 溶解,然后______ ,过滤。
(5)用回收的铜为原料可制得粗CuSO4·5H2O晶体(含有少量的FeSO4·7H2O),除去CuSO4·5H2O晶体中杂质的方法是将该晶体溶于水,向溶液中加入H2O2,再调节溶液pH。过滤即可制得纯净的CuSO4溶液,进而可制得纯净的CuSO4·5H2O晶体。
已知:室温时一些物质的Ksp如表所示:
已知溶液中的某离子浓度小于1×10-5 mol/L时就认为该离子沉淀完全。加双氧水的目的是_________ ;若溶液中CuSO4的浓度为3.0mol/L,通过计算说明此方法可除去粗CuSO4·5H2O晶体中FeSO4·7H2O的理由:___________ 。

已知:高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定;具有强氧化性;与水作用产生Fe(OH)3。
(1)高铁酸钾(K2FeO4)在处理水过程中的作用是
(2)检验废液中含有Fe2+选用的试剂是
(3)“氧化”过程反应的离子方程式为
(4)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品用
(5)用回收的铜为原料可制得粗CuSO4·5H2O晶体(含有少量的FeSO4·7H2O),除去CuSO4·5H2O晶体中杂质的方法是将该晶体溶于水,向溶液中加入H2O2,再调节溶液pH。过滤即可制得纯净的CuSO4溶液,进而可制得纯净的CuSO4·5H2O晶体。
已知:室温时一些物质的Ksp如表所示:
| 化学式 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 3×10-20 |
您最近一年使用:0次
名校
6 . 下表列出了五种燃煤烟气脱硫的方法。
(1)方法Ⅰ中吸收 后的溶液通过
后的溶液通过___________ (填字母)可使吸收液再生。
a.加热 b.加入适量NaOH c.通入
(2)方法Ⅱ中CO还原 反应的化学方程式为
反应的化学方程式为___________ 。
(3)方法Ⅲ在脱硫塔中进行,在脱硫的同时可得到产品硫酸。由于 对热不稳定,且硫酸浓度大也会导致其分解产生
对热不稳定,且硫酸浓度大也会导致其分解产生 ,需定时向脱硫塔中补充
,需定时向脱硫塔中补充___________ 。
(4)方法Ⅳ按如图所示方式,将含有 烟气和NaClO碱性溶液通入反应釜。
烟气和NaClO碱性溶液通入反应釜。___________ 。
②反应釜中采用“气-液逆流”接触吸收法的优点是___________ 。
(5)工业上方法Ⅴ的转化流程如下:___________ 。
②若用NaOH溶液代替 悬浊液,增加了生产成本,但可以防止
悬浊液,增加了生产成本,但可以防止___________ 。
| 方法Ⅰ | 用 溶液吸收 溶液吸收 |
| 方法Ⅱ | 用生物质热解气(主要成分为CO、 、 、 )将 )将 在高温下还原成S 在高温下还原成S |
| 方法Ⅲ | 用 溶液吸收 溶液吸收 |
| 方法Ⅳ | 用NaClO碱性溶液吸收 |
| 方法Ⅴ | 石灰-石膏法吸收 |
(1)方法Ⅰ中吸收
 后的溶液通过
后的溶液通过a.加热 b.加入适量NaOH c.通入

(2)方法Ⅱ中CO还原
 反应的化学方程式为
反应的化学方程式为(3)方法Ⅲ在脱硫塔中进行,在脱硫的同时可得到产品硫酸。由于
 对热不稳定,且硫酸浓度大也会导致其分解产生
对热不稳定,且硫酸浓度大也会导致其分解产生 ,需定时向脱硫塔中补充
,需定时向脱硫塔中补充(4)方法Ⅳ按如图所示方式,将含有
 烟气和NaClO碱性溶液通入反应釜。
烟气和NaClO碱性溶液通入反应釜。
②反应釜中采用“气-液逆流”接触吸收法的优点是
(5)工业上方法Ⅴ的转化流程如下:

②若用NaOH溶液代替
 悬浊液,增加了生产成本,但可以防止
悬浊液,增加了生产成本,但可以防止
您最近一年使用:0次
2024-01-24更新
|
314次组卷
|
2卷引用:湖南省常德市津市市第一中学2023-2024学年高一下学期4月份月考化学试卷
名校
解题方法
7 . 工业上生产红矾钠(重铬酸钠 )的原料为铬铁矿(可视为
)的原料为铬铁矿(可视为 ,还含有
,还含有 、
、 )、纯碱、石灰石和硫酸等。工业制备的流程如下:
)、纯碱、石灰石和硫酸等。工业制备的流程如下:
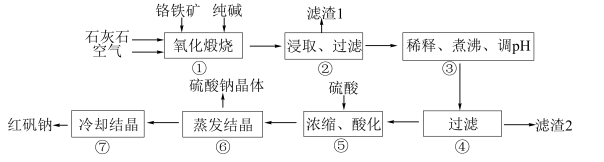
已知:“氧化煅烧”时 、
、 发生反应:
发生反应: 、
、 ;
;
“氧化煅烧”时 发生反应:
发生反应: 。
。
(1)“氧化煅烧”铬铁矿是在回转窑中进行,为加快反应速率可以采取的措施是___________ (任答2点)。
(2)“氧化煅烧”铬铁矿时还应加入石灰石,发生反应生成不溶或难溶的钙化合物: 、
、 、
、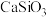 等,则加入石灰石的作用是
等,则加入石灰石的作用是___________ 。
(3)若此时纯碱不足或石灰石过量,易生成难溶的 ,则此时由
,则此时由 生成难溶的
生成难溶的 的反应方程式为
的反应方程式为___________ 。
(4)步骤②浸取时,可溶于水的 强烈水解,有关的离子方程式为
强烈水解,有关的离子方程式为___________ 。
(5)滤液加入硫酸酸化过程中,往混合溶液中加入硫酸必须适量的原因是硫酸少量不能除尽 等杂质,硫酸过量会生成
等杂质,硫酸过量会生成 等副产物。硫酸过量时反应的离子方程式为
等副产物。硫酸过量时反应的离子方程式为___________ 。
(6)碱性条件下重铬酸钠( )可将
)可将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(7)全钒液流电池是一种新型电能储存和高效转化装置。某溶液中含有 和
和 ,现向此溶液中滴入
,现向此溶液中滴入 溶液,恰好使
溶液,恰好使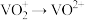 、
、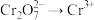 ,再滴入
,再滴入 溶液,又恰好使
溶液,又恰好使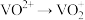 ,而
,而 不变,此时
不变,此时 ,则原溶液中Cr的质量为
,则原溶液中Cr的质量为___________ mg。
 )的原料为铬铁矿(可视为
)的原料为铬铁矿(可视为 ,还含有
,还含有 、
、 )、纯碱、石灰石和硫酸等。工业制备的流程如下:
)、纯碱、石灰石和硫酸等。工业制备的流程如下:
已知:“氧化煅烧”时
 、
、 发生反应:
发生反应: 、
、 ;
;“氧化煅烧”时
 发生反应:
发生反应: 。
。(1)“氧化煅烧”铬铁矿是在回转窑中进行,为加快反应速率可以采取的措施是
(2)“氧化煅烧”铬铁矿时还应加入石灰石,发生反应生成不溶或难溶的钙化合物:
 、
、 、
、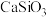 等,则加入石灰石的作用是
等,则加入石灰石的作用是(3)若此时纯碱不足或石灰石过量,易生成难溶的
 ,则此时由
,则此时由 生成难溶的
生成难溶的 的反应方程式为
的反应方程式为(4)步骤②浸取时,可溶于水的
 强烈水解,有关的离子方程式为
强烈水解,有关的离子方程式为(5)滤液加入硫酸酸化过程中,往混合溶液中加入硫酸必须适量的原因是硫酸少量不能除尽
 等杂质,硫酸过量会生成
等杂质,硫酸过量会生成 等副产物。硫酸过量时反应的离子方程式为
等副产物。硫酸过量时反应的离子方程式为(6)碱性条件下重铬酸钠(
 )可将
)可将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为(7)全钒液流电池是一种新型电能储存和高效转化装置。某溶液中含有
 和
和 ,现向此溶液中滴入
,现向此溶液中滴入 溶液,恰好使
溶液,恰好使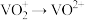 、
、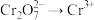 ,再滴入
,再滴入 溶液,又恰好使
溶液,又恰好使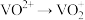 ,而
,而 不变,此时
不变,此时 ,则原溶液中Cr的质量为
,则原溶液中Cr的质量为
您最近一年使用:0次
名校
解题方法
8 . 肼(联氨)是一种常用的还原剂,下列说法不正确的是
A.碱性: |
B.键角( ): ): |
C. 和 和 均可用于处理高压锅炉水中的氧,防止锅炉被腐蚀,使用联氨的优点是 均可用于处理高压锅炉水中的氧,防止锅炉被腐蚀,使用联氨的优点是 的用量少,且不产生其他杂质 的用量少,且不产生其他杂质 |
D.向装有少量AgBr的试管中加入联氨溶液,可观察到固体逐渐变黑,发生的反应为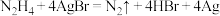 |
您最近一年使用:0次
名校
解题方法
9 . 随着新能源汽车销量的猛增,动力电池退役高峰将至,磷酸铁锂(LFP)是目前使用最多的动力电池材料,因此回收磷酸铁锂具有重要意义。一种从废旧磷酸铁锂正极片( 、导电石墨、铝箔)中回收锂的工艺流程如下:
、导电石墨、铝箔)中回收锂的工艺流程如下:
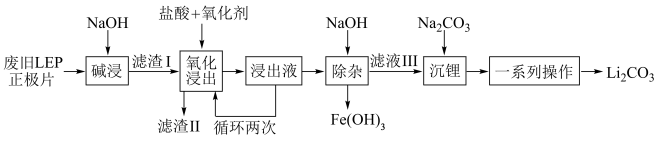
已知: 在水中的溶解度随温度升高而降低。
在水中的溶解度随温度升高而降低。
回答下列问题:
(1)旧电池拆解前进行放电处理有利于锂在正极的回收,其原因是___________ 。
(2)“碱浸”时,为加快浸出速率,可采取的措施是___________ (答出一点即可)。
(3)“氧化浸出”时,实际生产中氧化剂选用 ,不选用
,不选用 的原因是
的原因是___________ 。“氧化浸出”时生成了难溶的 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(4)“沉锂”过程中使用水浴加热保持温度在95℃,“一系列操作”具体包括___________ 、___________ 、干燥。
(5)滤液Ⅲ中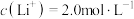 ,“沉锂”结束时溶液中
,“沉锂”结束时溶液中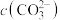 为
为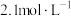 ,则“沉锂”过程中,锂的沉降率为
,则“沉锂”过程中,锂的沉降率为___________ %[已知:浸出液在沉锂过程中溶液体积不变,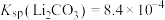 ]。
]。
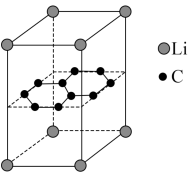
(6)某锂电池的负极材料晶体是锂原子嵌入石墨烯层间形成的,晶胞结构(底面为平行四边形)如图所示。该晶体的化学式为___________ ,该晶体中最近的两个碳原子核间距离为apm,石墨烯层间距离为bpm,则该晶体的密度为___________  (列出计算式,用
(列出计算式,用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
 、导电石墨、铝箔)中回收锂的工艺流程如下:
、导电石墨、铝箔)中回收锂的工艺流程如下:
已知:
 在水中的溶解度随温度升高而降低。
在水中的溶解度随温度升高而降低。回答下列问题:
(1)旧电池拆解前进行放电处理有利于锂在正极的回收,其原因是
(2)“碱浸”时,为加快浸出速率,可采取的措施是
(3)“氧化浸出”时,实际生产中氧化剂选用
 ,不选用
,不选用 的原因是
的原因是 ,该反应的离子方程式为
,该反应的离子方程式为(4)“沉锂”过程中使用水浴加热保持温度在95℃,“一系列操作”具体包括
(5)滤液Ⅲ中
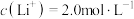 ,“沉锂”结束时溶液中
,“沉锂”结束时溶液中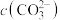 为
为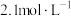 ,则“沉锂”过程中,锂的沉降率为
,则“沉锂”过程中,锂的沉降率为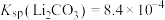 ]。
]。(6)某锂电池的负极材料晶体是锂原子嵌入石墨烯层间形成的,晶胞结构(底面为平行四边形)如图所示。该晶体的化学式为
 (列出计算式,用
(列出计算式,用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
您最近一年使用:0次
10 . 钒具有广泛用途。黏土钒矿中,钒以 、
、 、
、 价的化合物存在,还包括钾、镁的铝硅酸盐,以及
价的化合物存在,还包括钾、镁的铝硅酸盐,以及 、
、 。采用以下工艺流程可由黏土钒矿制备
。采用以下工艺流程可由黏土钒矿制备 。
。
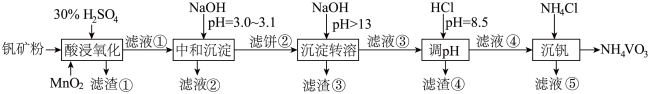
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“酸浸氧化”中, 和
和 被氧化成
被氧化成 ,同时还有
,同时还有_______ 离子被氧化。写出 转化为
转化为 反应的离子方程式
反应的离子方程式_______ 。
(2)“中和沉淀”中,钒水解并沉淀为 ,随滤液②可除去金属离子
,随滤液②可除去金属离子 、
、 、
、 、
、_______ ,以及部分的_______ 。
(3)“沉淀转溶”中, 转化为钒酸盐溶解。滤渣③的主要成分是
转化为钒酸盐溶解。滤渣③的主要成分是_______ 。
(4)利用上述表格数据,计算 的
的
_______ ( 完全沉淀后其浓度应小于
完全沉淀后其浓度应小于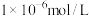 )。
)。
(5)“沉钒”中析出 晶体时,需要加入过量
晶体时,需要加入过量 ,其原因是
,其原因是_______ 。
 、
、 、
、 价的化合物存在,还包括钾、镁的铝硅酸盐,以及
价的化合物存在,还包括钾、镁的铝硅酸盐,以及 、
、 。采用以下工艺流程可由黏土钒矿制备
。采用以下工艺流程可由黏土钒矿制备 。
。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
| 完全沉淀pH | 3.0 | 9.0 | 4.7 | 10.1 |
(1)“酸浸氧化”中,
 和
和 被氧化成
被氧化成 ,同时还有
,同时还有 转化为
转化为 反应的离子方程式
反应的离子方程式(2)“中和沉淀”中,钒水解并沉淀为
 ,随滤液②可除去金属离子
,随滤液②可除去金属离子 、
、 、
、 、
、(3)“沉淀转溶”中,
 转化为钒酸盐溶解。滤渣③的主要成分是
转化为钒酸盐溶解。滤渣③的主要成分是(4)利用上述表格数据,计算
 的
的
 完全沉淀后其浓度应小于
完全沉淀后其浓度应小于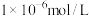 )。
)。(5)“沉钒”中析出
 晶体时,需要加入过量
晶体时,需要加入过量 ,其原因是
,其原因是
您最近一年使用:0次



