名校
解题方法
1 . MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下:

(1)第①步加稀H2SO4时,粗MnO2样品中的__________________ (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式________________________________________ 。
(3)已知第③步蒸发得到的固体中有NaClO3和NaOH外,还含有一种固体,则第③步反应的离子方程式为______________________________________________________________ 。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224LCO2(标准状况下),则在第②步反应中至少需要____________ mol NaClO3。

(1)第①步加稀H2SO4时,粗MnO2样品中的
(2)第②步反应的离子方程式
(3)已知第③步蒸发得到的固体中有NaClO3和NaOH外,还含有一种固体,则第③步反应的离子方程式为
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224LCO2(标准状况下),则在第②步反应中至少需要
您最近一年使用:0次
名校
2 . 下列表示对应化学反应的离子方程式正确的是
| A.向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O |
| B.向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- |
| C.向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3++4NH3·H2O═[Al(OH)4]-+4NH4+ |
| D.酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+ = 2Mn2++5O2↑+8H2O |
您最近一年使用:0次
名校
3 . Ⅰ、(1)在Fe(OH)3胶体中逐渐滴入HI稀溶液,会出现一系列变化。
①先出现红褐色沉淀,原因是_________________________________________ 。
②随后沉淀溶解,溶液呈黄色,此反应的离子方程式是________________________ 。
③最后溶液颜色加深,此反应的离子方程式是________________________________ 。
(2)若用稀盐酸代替HI稀溶液,能出现(1)中所述变化现象中的____ (填写上面各题序号)。
Ⅱ、某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2―→O2。
(1)该反应中,发生还原反应的过程是____________ ―→______________ 。
(2)写出该反应的化学方程式,并标出电子转移的方向和数目。
__________________________________________________________ 。
(3)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为______ 。
①先出现红褐色沉淀,原因是
②随后沉淀溶解,溶液呈黄色,此反应的离子方程式是
③最后溶液颜色加深,此反应的离子方程式是
(2)若用稀盐酸代替HI稀溶液,能出现(1)中所述变化现象中的
Ⅱ、某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2―→O2。
(1)该反应中,发生还原反应的过程是
(2)写出该反应的化学方程式,并标出电子转移的方向和数目。
(3)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为
您最近一年使用:0次
4 . 重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
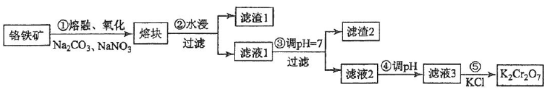
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为
Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________ 。该步骤不能使用陶瓷容器,原因是________________ 。
(2)滤渣1中含量最多的金属元素是____________ ,滤渣2的主要成分是_____________ 及含硅杂质。
(3)步骤④调滤液2的pH使之变____________ (填“大”或“小”),原因是___________________ (用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________ (填标号)得到的K2Cr2O7固体产品最多。
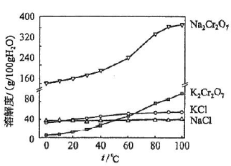
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________ 。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为________ 。

回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3
 Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为
Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为(2)滤渣1中含量最多的金属元素是
(3)步骤④调滤液2的pH使之变
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为
您最近一年使用:0次
2017-08-08更新
|
9607次组卷
|
21卷引用:宁夏石嘴山市第三中学2018届高三上学期期末考试理综-化学试题
宁夏石嘴山市第三中学2018届高三上学期期末考试理综-化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)甘肃省武威市第六中学2018届高三上学期第二次阶段性过关考试化学试题(已下线)《考前20天终极攻略》-5月28日 工艺流程分析(已下线)解密19 工艺流程题(教师版)——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第5讲 无机框图题的解答策略【教学案】云南省弥勒市第二中学2020届高三上学期开学考试化学试题云南省南华县一中2020届高三上学期开学考试化学试题2020届高考化学二轮复习大题精准训练——定量分析化学实验中物质含量的测定2019-2020学年人教版高中化学高考基础复习专题10《无机化学基础》测试卷贵州省黔南布依族苗族自治州龙里中学2019-2020学年高三上学期期末考试理综化学试题云南省昭通市绥江县二中2019-2020学年高三上学期期末考试理综化学试题贵州省镇远县二中2019-2020学年高三上学期期末考试化学试题贵州省施秉县一中2019-2020学年高三上学期期末考试化学试题贵州省剑河县第二中学2019-2020学年高三上学期期末考试化学试题云南省玉溪市新平县一中2019-2020学年高三上学期1月月考理综化学试题(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训2020届湖南省湘潭市高三教学质量监测卷化学试题四川省成都市第七中学2020年高中毕业班教学质量监测卷理科综合化学试题浙江省金华市东阳中学2019-2020学年高二下学期期中考试化学试题江西省景德镇市第一中学2021-2022学年高一上学期期中19班化学试题
真题
名校
5 . 在酸性条件下,可发生如下反应:  +2M3++4H2O=
+2M3++4H2O=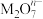 +Cl-+8H+,
+Cl-+8H+, 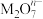 中M的化合价是
中M的化合价是
 +2M3++4H2O=
+2M3++4H2O=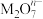 +Cl-+8H+,
+Cl-+8H+, 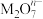 中M的化合价是
中M的化合价是 | A.+4 | B.+5 | C.+6 | D.+7 |
您最近一年使用:0次
2017-08-08更新
|
12099次组卷
|
141卷引用:【全国百强校】宁夏回族自治区育才中学2019届高三上学期月考(二)化学试题
【全国百强校】宁夏回族自治区育才中学2019届高三上学期月考(二)化学试题宁夏回族自治区银川市六盘山市高级中学2020-2021学年高一上学期第二次月考化学试题宁夏吴忠中学2022-2023学年高一上学期期末考试化学试题2017年全国普通高等学校招生统一考试化学(海南卷精编版)2福建省福州市八县(市)协作校2017-2018学年高二上学期期中联考化学(理)试题贵州省兴义中学2017-2018学年高一上学期期中考试化学试题陕西省西安市长安区第一中学2017-2018学年高一上学期第二次月考化学(重点、平行班)试题广东省惠州市2017-2018学年高一上学期期末教学质量检测化学试题(已下线)《考前20天终极攻略》6月2日 专项二 化学用语(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】【全国县级联考】江西省上饶县高中2017-2018学年高一下学期期末考试化学试题【全国百强校】江西省新余市第四中学2019届高三9月月考化学试题山西省临猗县临晋中学2019届高三9月月考化学试题(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (教学案)福建省厦门市湖滨中学2018-2019学年高一上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)【全国百强校】广东省湛江第一中学2018-2019学年高一上学期第二次大考化学试题河南省安阳市第三十六中学2018-2019学年高二6月月考化学试题第2章《元素与物质世界》期中复习检测试卷海南省儋州市第一中学2020届高三上学期第一次月考化学试卷浙江省宁波三中2019-2020学年高三10月月考化学试题贵州省贵阳市第六中学2019—2020学年高一上学期期中考试化学试题福建省永泰县第一中学2019-2020学年高二上学期期中考试化学试题海南省海南枫叶国际学校2019-2020学年高一上学期期中考试化学试题广西柳州市柳江中学2019-2020学年高一上学期期中考试化学试题内蒙古呼和浩特市土默特左旗第一中学2019-2020学年高一上学期第二次月考化学试题云南省西双版纳傣族自治州勐腊县第一中学2019-2020学年高一上学期期末考试化学试题辽宁省滨海实验中学2019-2020学年高一上学期期末化学试题重庆市南开中学2020年高一化学春季在线学习重点知识查漏补缺《离子反应》专题训练山东省日照市2019-2020学年高一上学期期末校际联考化学试题(已下线)专题四 氧化还原反应(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训陕西省吴起高级中学2019-2020学年高二下学期第一次质量检测化学试题贵州省贵阳市南明甲秀高级中学2019—2020学年高一上学期期中考试化学试题(已下线)小题必刷07 氧化还原反应概念及应用——2021年高考化学一轮复习小题必刷(通用版)人教版(2019)高一必修第一册第一章 物质及其变化 高考挑战区人教版(2019)高一必修第一册 第一章素养检测鲁科版(2019)高一必修第一册第2章 元素与物质世界 总结检测鲁科版(2019)高一必修第一册第二章C 高考挑战区 过高考 3年真题强化闯关(已下线)期末模拟卷(一)-2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)高一必修第一册(鲁科2019)第2章第3节 氧化还原反应 高考帮人教版(2019)高一必修第一册 第一章 物质及其变化 第三节 氧化还原反应 高考帮山东省济宁邹城市第一中学2020-2021学年高一10月月考化学试题江苏省南通市海安县2020-2021学年高一上学期第一次月考化学试题重庆市杨家坪中学2020-2021学年高一上学期第一次月考化学试题黑龙江省大庆市东风中学2020-2021学年高一上学期第一次阶段考试化学试题安徽省滁州市明光县明光中学2020-2021学年高一上学期第一次月考化学试题福建省福州市罗源第一中学2020-2021学年高二上学期10月月考化学试题福建省福州市福清西山学校高中部2019-2020学年高一上学期期中考试化学试题(已下线)【浙江新东方】1山西省晋中市平遥第四中学2020-2021学年高一上学期10月月考化学试题江西省南昌市第二中学2020-2021学年高一上学期期中考试化学试题辽宁省大连市瓦房店市2019-2020学年高一上学期期中考试化学试题湖北省沙市中学2020-2021学年高一上学期期中考试化学(选考)试题山东省临沂外国语学校2020-2021学年高一上学期10月月考化学试题湖南省湘潭电机子弟中学2020-2021学年高一上学期段考化学试题(已下线)【南昌新东方】11 . 2020 高一上 南昌二中 期中 刘志平,项金辉内蒙古赤峰市翁牛特旗乌丹第二中学2020-2021学年高一上学期期中考试化学试题湖南平江县第一中学2021届高三上学期第二次月考化学试题吉林省白城市大安市第一中学校2020-2021学年高一上学期第三次月考化学试题(已下线)【浙江新东方】71.河南省许昌市建安区第一高级中学2020-2021学年高一上学期阶段性测试(12月)化学试题黑龙江省齐齐哈尔市2020-2021学年高一上学期期末考试化学试题江苏省海安高级中学2020~2021学年高一上学期阶段检测(一)化学试题天津市静海区第一中学2020-2021学年高一12月考化学试题吉林省白山市抚松县第五中学2020-2021学年高一上学期期中考试化学试题海南省东方市八所中学2020-2021学年高一上学期期中考试化学试题吉林省延边朝鲜族自治州2020-2021学年高一上学期期末考试化学试题江苏省南菁高级中学2020-2021学年高一上学期第一次阶段性检测考试化学试题重庆实验中学2020-2021学年高一上学期第一阶段测试化学试题海南省海南鑫源高级中学2019-2020学年高一上学期期中考试化学试题海南省海南鑫源高级中学2019-2020学年高三上学期期中考试化学试题山东省嘉祥县第一中学2020-2021学年高一上学期10月月考化学试题(已下线)专题1.3.2 氧化还原反应中电子转移的表示方法(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)课时10 氧化还原反应规律及应用-2022年高考化学一轮复习小题多维练(全国通用)河北省石家庄市第九中学2020-2021学年高一上学期11月月考化学试题黑龙江省哈尔滨市第三中学2022届高三第一次验收考试化学试题江西省南昌八一中学2021-2022学年高一上学期10月月考化学试题河北省辛集市第一中学2021-2022学年高一上学期第一次月考化学试题黑龙江省尚志市尚志中学2021-2022学年高一上学期第一次月考化学试题云南省罗平县第二中学2021-2022学年高一上学期10月月考化学试题江西省奉新县第一中学2021-2022学年高一上学期第一次月考化学试题黑龙江省哈尔滨师范大学青冈实验中学2021-2022学年高一10月月考化学试题河南省新乡县高级中学2021-2022学年高一上学期第一次月考化学试题广东省普宁市华侨中学2021-2022学年高一上学期期中考试化学试题湖南省邵阳邵东市第一中学2021-2022学年高一上学期期中考试化学试题四川省广安市武胜烈面中学校2021-2022学年高一上学期期中测试化学试题贵州省黔南州都匀市都匀第一中学2021-2022学年高一上学期期中化学试题内蒙古呼和浩特市2021-2022学年高一上学期期末考试化学试题第三节 氧化还原反应 第2课时 氧化剂和还原剂黑龙江省大庆市肇州县第二中学2021-2022学年高一上学期第一次月考化学试题新疆石河子第二中学2021-2022学年高一上学期第一次月考化学试题吉林省松原市2021-2022学年高一上学期11月联考化学试题浙江省吴兴高级中学2021-2022学年高一上学期10月月考化学试题云南省德宏州2021-2022学年高一上学期期末统一监测化学试题浙江省马寅初中学2022--2023学年高一上学期第一次月考化学试题四川省绵阳南山中学2022-2023学年高一上学期10月月考化学试题河南省洛阳市强基联盟2022-2023学年高一上学期第一次大联考化学试题江苏省南京市第二十九中学2022-2023学年高一上学期10月月考化学试题天津市宝坻区第一中学2022-2023学年高一上学期阶段性练习(一)化学试题天津市南开大学附属中学2022-2233学年高一上学期阶段检测化学试题(一)山东省淄博实验中学2022-2023学年高一上学期月考化学试题湖北省宜昌市协作体2022-2023学年高一上学期期中考试化学试题天津市实验中学2022-2023学年高一上学期学情评估(一)化学试题内蒙古呼和浩特市第二中学致远级部2022-2023学年高一上学期第一次月考化学试题内蒙古包头市第九中学2022-2023学年高一上学期10月月考化学试题贵州省贵阳市花溪第六中学2022-2023学年高一上学期期中考试化学试题四川省芦山中学2022-2023学年高一上学期半期考试(期中)化学试题四川省成都市东部新区养马高级中学2022-2023学年高一上学期期中考试化学试题河南省开封市尉氏三中南校区2021-2022学年高一上学期月考化学试题福建省福清西山学校2021-2022学年高一上学期12月月考化学试题安徽省淮北市实验高级中学2022-2023学年高一上学期阶段性考试化学试题云南省曲靖市第一中学2022-2023学年高一上学期第一次检测化学试题广东省肇庆市封开县广信中学2022-2023学年高一上学期第一次月考化学试题内蒙古乌兰浩特市第四中学2022-2023学年高一上学期第一次月考化学试题贵州省贵阳清镇北大培文学校2022-2023学年高二下学期3月月考(4班)化学试题安徽省马鞍山市花山区等4地安徽工业大学附属中学2022-2023学年高一上学期10月月考化学试题河北省石家庄市第一中学东校区2023-2024学年高一上学期第一次月考化学试题天津市南开中学2023-2024学年高一上学期第一次月考化学试题江西省南昌市豫章中学2022-2023学年高一上学期10月月考化学试题浙江省温州市新力量联盟2023-2024学年高一上学期11月期中联考化学试题浙江省湖州市第二中学2023-2024学年高一上学期9月月考化学试题辽宁省沈阳市第十五中学2023-2024学年高一上学期10月月考化学试题(已下线)BBWYhjhx1001.pdf新疆乌鲁木齐市第二十三中学2023-2024学年高一上学期10月月考化学试题山西省太原市第十二中学校2023-2024学年高一上学期第一次月考化学试题陕西省宝鸡市金台区2023-2024学年高一上学期期中考试化学试题黑龙江省齐齐哈尔市恒昌中学校2023-2024学年高一上学期期中考试化学试题云南省楚雄东兴中学2023-2024学年高一上学期10月月考化学试题四川省兴文第二中学校2023-2024学年高一上学期11月期中考试化学试题河南省济源市2023-2024学年高级中学高一上学期化学模拟练习广东省肇庆市四会市四会中学、封开县广信中学2023-2024学年高一上学期第二次月考化学试题辽宁省朝阳市第一高级中学 第二高级中学2023-2024学年高一上学期12月月考化学试题 吉林省通化市梅河口市第五中学2023-2024学年高一上学期1月期末化学试题福建省宁德衡水育才中学2022-2023学年高一上学期1月期末测试化学试题青海省西宁市大通回族土族自治县第二完全中学2022-2023学年高一下学期开学检测化学试卷 海南华侨中学2023-2024学年高一上学期期末考试化学试题海南省华东师范大学第二附属中学乐东黄流中学2023-2024学年高一上学期11月期中化学试题云南省罗平县第二中学2021-2022学年高一上学期期末考试化学试题云南省保山市腾冲市第八中学2020-2021学年高一下学期期末考试化学试题内蒙古自治区通辽市科尔沁左翼中旗实验高级中学2023-2024学年高一上学期1月期末化学试题云南大理州实验中学2021-2022学年高二下学期化学开学试题
名校
6 . 铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:
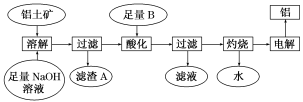
已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O===Na2Al2Si2O8↓+4NaOH。
请回答下列问题:
(1)铝土矿中Al2O3与氢氧化钠溶液反应的离子方程式为
________________________________________________________________________ 。
(2)在工艺流程中“酸化”时,加入的最佳物质B是______ ,理由是________________________________________________________________________ ,
写出酸化过程发生反应的化学方程式________________________________________________________________________ 。
(3)工业上用Al2O3与C、Cl2在高温条件下反应制取AlCl3,理论上每消耗6.0 g碳单质,转移1 mol电子,则反应的化学方程式为______________________________ 。
(4)某同学推测铝与氧化铁发生铝热反应得到的熔融物中还含有Fe2O3,设计了如下方案来验证:取一块该熔融物投入少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3。
则物质甲是________ (填化学式),请判断该同学设计的实验方案的合理性________ (填“合理”或“不合理”)。原因是_____________________________ (若合理,则不用填写)。

已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O===Na2Al2Si2O8↓+4NaOH。
请回答下列问题:
(1)铝土矿中Al2O3与氢氧化钠溶液反应的离子方程式为
(2)在工艺流程中“酸化”时,加入的最佳物质B是
写出酸化过程发生反应的化学方程式
(3)工业上用Al2O3与C、Cl2在高温条件下反应制取AlCl3,理论上每消耗6.0 g碳单质,转移1 mol电子,则反应的化学方程式为
(4)某同学推测铝与氧化铁发生铝热反应得到的熔融物中还含有Fe2O3,设计了如下方案来验证:取一块该熔融物投入少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3。
则物质甲是
您最近一年使用:0次
2017-05-24更新
|
1024次组卷
|
8卷引用:宁夏银川市景博中学2022-2023学年高二上学期期中考试化学试题
宁夏银川市景博中学2022-2023学年高二上学期期中考试化学试题河北省邢台市第一中学2016-2017学年高二下学期第三次月考化学试题黑龙江省大庆实验中学2016-2017学年高一6月月考化学试题内蒙古巴彦淖尔市第一中学2018届高三上学期期中考试理科综合化学试题【全国百强校】广西陆川县中学2017-2018学年高一下学期6月考化学试题(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第2讲 镁、铝及其重要化合物【押题专练】江苏省启东中学2020-2021学年高一上学期第二次月考化学试题(已下线)考点11 镁、铝及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
解题方法
7 . 将Cl2通入200mL0.5mol·L-1氢氧化钾溶液中,二者恰好完全反应得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量之比是1︰2,则通入的Cl2在标准状况下的体积为
| A.0.56L | B.1.68L | C.2.24L | D.1.12L |
您最近一年使用:0次
2017-03-11更新
|
582次组卷
|
7卷引用:宁夏固原第一中学2017-2018学年高一上学期期末考试化学试题
名校
解题方法
8 . 氯化铁和高铁酸钾都是常见的水处理剂,下图为制备粗高铁酸钾的工业流程。

请回答下列问题:
(1)氯化铁做净水剂的原因是(结合化学用语表达)___________ 。
(2)吸收剂X的化学式为___________ ,氧化剂Y的化学式为___________ 。
(3)碱性条件下反应①的离子方程式为___________ 。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+NaFeO4=K2FeO4+2NaOH,请根据反应原理分析反应能发生的原因_______________ 。
(5)K2FeO4在水溶液中易发生反应:4 FeO +10H2O=4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
+10H2O=4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用___________ (填序号)。
除了这种洗涤剂外,一般工业生产还要加入异丙醇作为洗涤剂,你认为选择异丙醇的原因是_____________ 。
(6)高铁电池是正在研制中的充电电池,具有电压稳定、放电时间长等优点。以高铁酸钾、二氧化硫和三氧化硫为原料,硫酸钾为电解质,用惰性电极设计成能在高温下使用的电池,写出该电池的正极反应式_____________ 。

请回答下列问题:
(1)氯化铁做净水剂的原因是(结合化学用语表达)
(2)吸收剂X的化学式为
(3)碱性条件下反应①的离子方程式为
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+NaFeO4=K2FeO4+2NaOH,请根据反应原理分析反应能发生的原因
(5)K2FeO4在水溶液中易发生反应:4 FeO
 +10H2O=4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
+10H2O=4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用| A.H2O | B.稀KOH溶液 | C.NH4Cl溶液 | D.Fe(NO3)3溶液 |
除了这种洗涤剂外,一般工业生产还要加入异丙醇作为洗涤剂,你认为选择异丙醇的原因是
(6)高铁电池是正在研制中的充电电池,具有电压稳定、放电时间长等优点。以高铁酸钾、二氧化硫和三氧化硫为原料,硫酸钾为电解质,用惰性电极设计成能在高温下使用的电池,写出该电池的正极反应式
您最近一年使用:0次
2017-02-17更新
|
656次组卷
|
4卷引用:2017届宁夏固原市第一中学高三下学期第一次月考理综化学试卷2
解题方法
9 . 主族元素碳、氧、氮、氟、磷、硒及副族元素镍、铜元素在化学中有很重要的地位,回答下列问题:
(1)在基态14C原子中,核外存在________ 对自旋相反的电子,基态氮原子的价层电子排布图为________ 。
(2)将F2通入稀NaOH溶液中可生成OF2,OF2分子构型为___ ,其中氧原子的杂化方式为_____ 。
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=_______ 。CO与N2结构相似,CO分子内σ键与π键个数之比为_________ 。
(4)CuSO4溶液能用作P4中毒的解毒剂,反应可生成P的最高价含氧酸和铜,该反应的化学方程式是______ 。
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释H2SeO4比H2SeO3酸性强的原因:__________ ;
(6)已知Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有__________ 个铜原子。
(7)用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如图),已知该晶体的密度为9.00 g·cm-3,Cu的原子半径为________ cm(阿伏伽德罗常数为NA,只要求列式表示)。
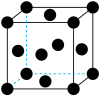
(1)在基态14C原子中,核外存在
(2)将F2通入稀NaOH溶液中可生成OF2,OF2分子构型为
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=
(4)CuSO4溶液能用作P4中毒的解毒剂,反应可生成P的最高价含氧酸和铜,该反应的化学方程式是
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释H2SeO4比H2SeO3酸性强的原因:
(6)已知Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有
(7)用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如图),已知该晶体的密度为9.00 g·cm-3,Cu的原子半径为

您最近一年使用:0次
解题方法
10 . 研究NOx、CO等大气污染物的测量及处理具有重要意义。
(1)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。NOx在催化转化器中被CO还原成N2排除。写出NO被CO还原的化学方程式:___________ 。
(2)选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在金属催化剂作用下,用还原剂(如NH3)选择性地与NOx反应生成N2和H2O。
①已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-905.5kJ•mol-1
4NO(g)+6H2O(g) ΔH=-905.5kJ•mol-1
N2(g)+O2(g) 2NO(g) ΔH=+180kJ•mol-1
2NO(g) ΔH=+180kJ•mol-1
完成该方法中主要反应的热化学方程式4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) ΔH=
4N2(g)+6H2O(g) ΔH=___________ 。
②该方法应控制反应温度在315~400℃之间,反应温度过低会影响反应速率,但温度也不宜过高,原因是___________ 。
③氨氮比[ ]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,反应物x的转化率与氨氮比的关系如图所示,则X是
]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,反应物x的转化率与氨氮比的关系如图所示,则X是___________ (填化学式)。当 >1.0时,烟气中NO浓度反而增大,主要原因是
>1.0时,烟气中NO浓度反而增大,主要原因是___________ 。

(3)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
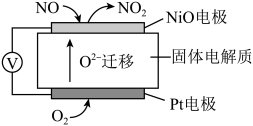
①Pt电极上发生的是___________ 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:___________ 。
(1)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。NOx在催化转化器中被CO还原成N2排除。写出NO被CO还原的化学方程式:
(2)选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在金属催化剂作用下,用还原剂(如NH3)选择性地与NOx反应生成N2和H2O。
①已知:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ΔH=-905.5kJ•mol-1
4NO(g)+6H2O(g) ΔH=-905.5kJ•mol-1N2(g)+O2(g)
 2NO(g) ΔH=+180kJ•mol-1
2NO(g) ΔH=+180kJ•mol-1完成该方法中主要反应的热化学方程式4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(g) ΔH=
4N2(g)+6H2O(g) ΔH=②该方法应控制反应温度在315~400℃之间,反应温度过低会影响反应速率,但温度也不宜过高,原因是
③氨氮比[
 ]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,反应物x的转化率与氨氮比的关系如图所示,则X是
]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,反应物x的转化率与氨氮比的关系如图所示,则X是 >1.0时,烟气中NO浓度反而增大,主要原因是
>1.0时,烟气中NO浓度反而增大,主要原因是
(3)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

①Pt电极上发生的是
②写出NiO电极的电极反应式:
您最近一年使用:0次



