名校
1 . 离子反应和氧化还原反应在生产、生活中应用广泛,用所学知识回答问题:
(1)新制氢氧化亚铁被氧气氧化,其化学方程式为______________ 。
(2)氯化铝溶液中滴加四羟基合铝酸钠溶液的离子方程式________ 。
(3)向硫酸铜溶液中逐滴滴加氨水至过量的离子方程式是____ 、______ 。
(4)向硫酸铝钾溶液中逐滴加入Ba(OH)2溶液至SO42-全部沉淀时的离子方程式_______ ;
(1)新制氢氧化亚铁被氧气氧化,其化学方程式为
(2)氯化铝溶液中滴加四羟基合铝酸钠溶液的离子方程式
(3)向硫酸铜溶液中逐滴滴加氨水至过量的离子方程式是
(4)向硫酸铝钾溶液中逐滴加入Ba(OH)2溶液至SO42-全部沉淀时的离子方程式
您最近一年使用:0次
名校
2 . 某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平离子方程式(将化学计量数填于空白处)____ I-+____ IO3—+____ H+ =____ I2+____ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的化学方程式是:____________________________ 。
②某学生设计回收四氯化碳的操作为:a.加入适量Na2SO3稀溶液; b.分离出下层液体;c.将碘的四氯化碳溶液置于分液漏斗中; d.将分液漏斗充分振荡后静置。其中分液漏斗使用前须进行的操作是_______ ,上述操作正确的顺序是:_______ (填序号)
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:a.准确称取ag食盐,加适量蒸馏水使其完全溶解;b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;c.以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是_______________________ 。
②b中反应所消耗的KI的物质的量是____________ mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含a的代数式表示)_____ mg/kg。
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平离子方程式(将化学计量数填于空白处)
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的化学方程式是:
②某学生设计回收四氯化碳的操作为:a.加入适量Na2SO3稀溶液; b.分离出下层液体;c.将碘的四氯化碳溶液置于分液漏斗中; d.将分液漏斗充分振荡后静置。其中分液漏斗使用前须进行的操作是
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:a.准确称取ag食盐,加适量蒸馏水使其完全溶解;b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;c.以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是
②b中反应所消耗的KI的物质的量是
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含a的代数式表示)
您最近一年使用:0次
3 . 碲(Te)位于元素周期表第ⅥA族,该元素组成的物质可用作石油裂化的催化剂、电镀液的光亮剂、玻璃的着色材料及合金材料的添加剂等。精炼铜的阳极混含有Cu2Te、Au、Ag等,利用下列工艺流程可回收碲:
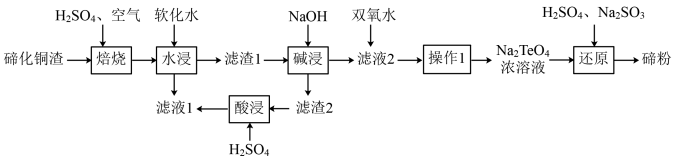
已知:TeO2熔点733℃,微溶于水,可溶于强酸和强碱。回答下列问题:
(1)Te与S的简单氢化物的稳定性强弱顺序为:__________ (用氢化物的化学式表示)。
(2)“焙烧”的化学方程式__________ (碲主要以TeO2形式存在)。
(3)“焙烧”后的固体用软化水“水浸”,该过程的有效物质的浸出率及浸出速率对该工艺流程很重要,写出两条提高“水浸”速率的措施:________ 。“滤液1”的溶质有________ 。
(4)“滤渣1”进行“碱浸”的目的是________
(5)“滤液2”加入双氧水,能否改用氯水或氯气,说明原因:_________
(6)“还原”制备碲粉的氧化产物是_________
(7)从环境保护和资源合理开发的可持续发展意识和绿色化学观念来看,分析“滤渣2”进行“酸浸”的意义:________

已知:TeO2熔点733℃,微溶于水,可溶于强酸和强碱。回答下列问题:
(1)Te与S的简单氢化物的稳定性强弱顺序为:
(2)“焙烧”的化学方程式
(3)“焙烧”后的固体用软化水“水浸”,该过程的有效物质的浸出率及浸出速率对该工艺流程很重要,写出两条提高“水浸”速率的措施:
(4)“滤渣1”进行“碱浸”的目的是
(5)“滤液2”加入双氧水,能否改用氯水或氯气,说明原因:
(6)“还原”制备碲粉的氧化产物是
(7)从环境保护和资源合理开发的可持续发展意识和绿色化学观念来看,分析“滤渣2”进行“酸浸”的意义:
您最近一年使用:0次
2018-05-13更新
|
498次组卷
|
2卷引用:宁夏回族自治区银川市唐徕中学2023-2024学年高三上学期12月月考理科综合试题
名校
解题方法
4 . 硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取硝基的炸药等。有机化工中也用硝酸与丙烯或乙烯、乙二醇作用制取草酸。
(1)某同学对铁与稀硝酸的反应进行探究,若稀HNO3只被还原成NO。
①写出铁与过量稀硝酸反应的离子方程式_______________________________ 。
②写出过量铁与稀硝酸反应的离子方程式_______________________________ 。
③若28克铁与含1.6摩尔硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比__________________ 。
④上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为_________ g。
(2)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中的NO3-浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:____ Al+___NO3-+___OH-==___AlO2-+___N2↑+_________。
②上述反应中,还原剂与还原产物的物质的量之比是____ ,反应中转移电子0.3mol,标准状况下生成N2是___________ mL。
(1)某同学对铁与稀硝酸的反应进行探究,若稀HNO3只被还原成NO。
①写出铁与过量稀硝酸反应的离子方程式
②写出过量铁与稀硝酸反应的离子方程式
③若28克铁与含1.6摩尔硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比
④上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为
(2)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中的NO3-浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:
②上述反应中,还原剂与还原产物的物质的量之比是
您最近一年使用:0次
2018-01-26更新
|
425次组卷
|
4卷引用:宁夏银川一中2017-2018学年高一上学期期末考试化学试题
名校
5 . 某化学反应的反应物和产物如下:KMnO4 + KI+ H2SO4→ MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1)该反应的氧化剂是______________ 。
(2)如果该反应方程式中I2和KIO3的系数都是5,KMnO4的系数是______ 。
(3)在下面的化学式上标出电子转移的方向和数目:
MnO2 + 4HCl(浓) = MnCl2 + Cl2↑ + 2H2O_____________ 。
(4)通常用碳酸氢钠的饱和溶液除去CO2中混有的少量HCl气体,反应的离子方程式是_________________________________________ 。不用碳酸钠稀溶液除杂的原因是(用离子方程式表示)____________________________________ 。
(1)该反应的氧化剂是
(2)如果该反应方程式中I2和KIO3的系数都是5,KMnO4的系数是
(3)在下面的化学式上标出电子转移的方向和数目:
MnO2 + 4HCl(浓) = MnCl2 + Cl2↑ + 2H2O
(4)通常用碳酸氢钠的饱和溶液除去CO2中混有的少量HCl气体,反应的离子方程式是
您最近一年使用:0次
名校
6 . 已知Na2O2(过氧化钠)与H2O反应的方程式是: 2Na2O2+2H2O =4NaOH+O2↑,将一定质量的Na2O2固体加入足量水中充分反应可生成O2 3.36L标准状况,试计算:
(1)参加反应的Na2O2固体质量为_____________ 克?
(2)反应后所得溶液加入2 mol/L硫酸溶液_____________ 毫升恰好被中和?(要求两步均写出计算过程)
(1)参加反应的Na2O2固体质量为
(2)反应后所得溶液加入2 mol/L硫酸溶液
您最近一年使用:0次
名校
解题方法
7 . 氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下:

已知:① Cr2O72-+H2O 2CrO42-+2H+;
2CrO42-+2H+;
② CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)写出碱溶发生反应的化学方程式____________________________________ ,所加40%NaOH不宜过量太多的原因是______________________________ 。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式_________________ ,反应后从剩余溶液中分离出CH3OH的实验方法是_____________ 。
(3)使用下列用品来测定溶液的pH,合理的是_________ (填字母)。
A.酚酞溶液 B.石蕊试纸 C.pH计
(4)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得的洁净固体_______________________ ,蒸发浓缩,__________ ,过滤, ______________ ,低温干燥,得到CrCl3·6H2O(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)。
(5)若取原料红矾钠26.2g,实验最终得到氯化铬晶体42.64g,则该实验的产率为_________ 。

已知:① Cr2O72-+H2O
 2CrO42-+2H+;
2CrO42-+2H+;② CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)写出碱溶发生反应的化学方程式
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式
(3)使用下列用品来测定溶液的pH,合理的是
A.酚酞溶液 B.石蕊试纸 C.pH计
(4)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得的洁净固体
(5)若取原料红矾钠26.2g,实验最终得到氯化铬晶体42.64g,则该实验的产率为
您最近一年使用:0次
2017-11-19更新
|
372次组卷
|
3卷引用:【全国百强校】宁夏回族自治区石嘴山市第三中学2019届高三上学期期中考试化学试题
名校
解题方法
8 . 根据所学知识,回答下列问题:
(1)现有下列物质;①熔融的NaCl ②液态HCl ③蔗糖 ④汞 ⑤NaOH溶液 ⑥稀硫酸 ⑦CO2 ⑧KCl晶体
其中属于电解质的是_______ ;属于非电解质的是_______ ;能导电的有_______ 。
(2)按要求填空。
①NaHSO4溶液(写出电离方程式)_______ 。
②氯水与KI溶液反应(写出离子方程式)_______ 。
③苏打和澄清石灰水反应(写出离子方程式)_______ 。
(3)配平下列氧化还原方程式:
①_______ Fe+_______ HNO3 = _______ Fe(NO3)3+_______ NO↑+_______ H2O
②_______ CO+_______ Fe2O3 
_______ Fe+_______ CO2
(1)现有下列物质;①熔融的NaCl ②液态HCl ③蔗糖 ④汞 ⑤NaOH溶液 ⑥稀硫酸 ⑦CO2 ⑧KCl晶体
其中属于电解质的是
(2)按要求填空。
①NaHSO4溶液(写出电离方程式)
②氯水与KI溶液反应(写出离子方程式)
③苏打和澄清石灰水反应(写出离子方程式)
(3)配平下列氧化还原方程式:
①
②

您最近一年使用:0次
2017-11-14更新
|
579次组卷
|
2卷引用:宁夏育才中学2017-2018学年高一上学期期中化学试题
9 . 由等物质的量铁、铝、硅混合而成的混合物,分别与足量的盐酸、氢氧化钠溶液发生反应,产生气体的质量之比是多少?(写出计算过程)
您最近一年使用:0次
名校
10 . 锌与100mL 18.5mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液的pH=1。下列叙述不正确的是( )
| A.气体甲中SO2与H2的体积比为4∶1 | B.反应中共消耗1.8mol H2SO4 |
| C.反应中共消耗97.5g Zn | D.反应中共转移3mol电子 |
您最近一年使用:0次
2017-10-28更新
|
357次组卷
|
2卷引用:宁夏青铜峡市高级中学2021-2022学年高三上学期期中考试化学试题



