名校
1 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,下图物质转化中实现了循环,减少了有害物质向环境的排放,回答下列问题。
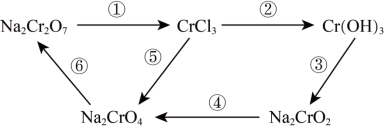
(1)Na2Cr2O7中Cr元素的化合价是______ 。
(2)浓HCl能实现反应①的转化,在浓HCl和Na2Cr2O7的反应中,Na2Cr2O7发生______ 反应(填“氧化”或“还原”),该反应有黄绿色气体生成,写出反应的化学方程式:______ 。
(3)反应④在碱性条件下发生,反应的离子方程式为: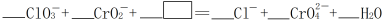 ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式______ 。

(1)Na2Cr2O7中Cr元素的化合价是
(2)浓HCl能实现反应①的转化,在浓HCl和Na2Cr2O7的反应中,Na2Cr2O7发生
(3)反应④在碱性条件下发生,反应的离子方程式为:
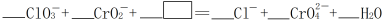 ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式
您最近一年使用:0次
名校
2 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及氧化物 、
、 ,还有少量其他不溶于酸溶液和碱溶液的物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体
,还有少量其他不溶于酸溶液和碱溶液的物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体 :
:
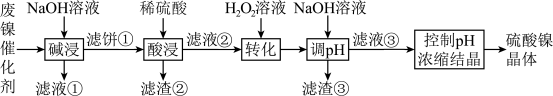
室温下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“碱浸”时需要充分搅拌,其目的是________ 。
(2)“碱浸”中NaOH的作用除去除催化剂表面的油脂外,还与催化剂中Al和 反应生成
反应生成________ (填物质的化学式),使Al元素进入“滤液①”。
(3)“滤液②”中主要含有金属离子“ ”和“
”和“ ”,则“转化”中加入
”,则“转化”中加入 的主要作用是
的主要作用是________ (用离子方程式表示)。
(4)写出 的溶度积常数的表达式
的溶度积常数的表达式
________ ,利用上述表格数据,计算 的溶度积常数
的溶度积常数
________ (列出计算式即可,不用化简)。如果“转化”后的溶液中 浓度为
浓度为 ,则“调pH”应控制pH不超过
,则“调pH”应控制pH不超过________ (填数值)。
 、
、 ,还有少量其他不溶于酸溶液和碱溶液的物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体
,还有少量其他不溶于酸溶液和碱溶液的物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体 :
:
室温下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 |
|
|
|
|
开始沉淀时 | 7 | 4 | 2 | 8 |
沉淀完全时 | 9 | 5 | 3 | 9 |
(1)“碱浸”时需要充分搅拌,其目的是
(2)“碱浸”中NaOH的作用除去除催化剂表面的油脂外,还与催化剂中Al和
 反应生成
反应生成(3)“滤液②”中主要含有金属离子“
 ”和“
”和“ ”,则“转化”中加入
”,则“转化”中加入 的主要作用是
的主要作用是(4)写出
 的溶度积常数的表达式
的溶度积常数的表达式
 的溶度积常数
的溶度积常数
 浓度为
浓度为 ,则“调pH”应控制pH不超过
,则“调pH”应控制pH不超过
您最近一年使用:0次
3 . 金属钠及其化合物在人类生产、生活中起着重要作用。诸回答下列问题:
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中加入黄豆粒大小的金属钠,可能观察到的现象是___________(填序号)。
(2)金属钠在氧气中燃烧生成Na2O2,其电子式为___________ ,采用空气和Na为原料可直接制备Na2O2.空气与熔融的金属Na反应前需依次通过的试剂为___________ 、___________ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)NaCl的熔点为800.8℃。工业上采用电解熔融的NaCl和CaCl2混合盐制备金属Na,电解的化学方程式为:2NaCl(l)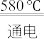 2Na(1)+Cl2(g),加入CaCl2的目的是
2Na(1)+Cl2(g),加入CaCl2的目的是___________ 。
(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应。
 +____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
+____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
①配平上述离子方程式___________ 。
②该反应说明Na2O2具有___________ (选填“氧化性”“还原性"或“漂白性”)。
(5)在密闭容器中,将a mol Na2O2和b mol NaHCO3固体混合物加热至250℃,充分反应后,若剩余固体为Na2CO3和NaOH,排出气体为O2和H2O时,a:b的取值范围为___________ 。
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中加入黄豆粒大小的金属钠,可能观察到的现象是___________(填序号)。
A.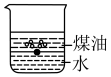 | B.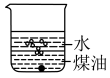 |
C. | D. |
(2)金属钠在氧气中燃烧生成Na2O2,其电子式为
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)NaCl的熔点为800.8℃。工业上采用电解熔融的NaCl和CaCl2混合盐制备金属Na,电解的化学方程式为:2NaCl(l)
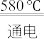 2Na(1)+Cl2(g),加入CaCl2的目的是
2Na(1)+Cl2(g),加入CaCl2的目的是(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应。
 +____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
+____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O①配平上述离子方程式
②该反应说明Na2O2具有
(5)在密闭容器中,将a mol Na2O2和b mol NaHCO3固体混合物加热至250℃,充分反应后,若剩余固体为Na2CO3和NaOH,排出气体为O2和H2O时,a:b的取值范围为
您最近一年使用:0次
名校
解题方法
4 . 通过下列实验以印刷线路板碱性蚀刻废液(主要成分为[Cu(NH3)4]Cl2)为原料制备还原性物质CuCl。下列说法不正确的是
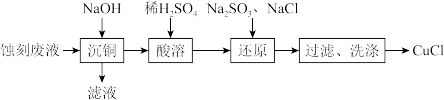

| A.“沉铜”得到的沉淀主要为Cu(OH)2 |
B.“还原”时离子方程式为SO +Cu2++Cl-+H2O=CuCl↓+SO +Cu2++Cl-+H2O=CuCl↓+SO +2H+ +2H+ |
| C.“过滤”、“洗涤”时应该在隔绝空气的条件下进行 |
| D.可循环利用的物质为H2SO4 |
您最近一年使用:0次
2023-11-07更新
|
653次组卷
|
5卷引用:宁夏银川市育才中学2023-2024学年高三上学期1月期末理科综合化学试题
宁夏银川市育才中学2023-2024学年高三上学期1月期末理科综合化学试题宁夏银川市西夏区育才中学2023-2024学年高三上学期1月期末化学试题甘肃省兰州第一中学2023-2024学年高三上学期11月期中考试化学试题(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
5 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,下图物质转化中实现了循环,减少了有害物质向环境的排放,回答下列问题。

(1)Na2Cr2O7中Cr元素的化合价是___________ ,在上述转化中,Cr元素化合价不变的步骤是___________ (填序号)。
(2)下列物质中能实现反应①转化的是___________ 。(填字母)
a.KMnO4 b.HCl c.O2
所选物质参与反应①转化中,Na2Cr2O7发生___________ 反应(填“氧化”或“还原”),该反应有黄绿色气体生成,写出反应的化学方程式:___________ 。
(3)向Cr(OH)3中加入NaOH浓溶液可实现反应③,写出该反应的化学方程式:___________ 。
(4)反应④在碱性条件下发生,反应的离子方程式为: ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式___________ 。

(1)Na2Cr2O7中Cr元素的化合价是
(2)下列物质中能实现反应①转化的是
a.KMnO4 b.HCl c.O2
所选物质参与反应①转化中,Na2Cr2O7发生
(3)向Cr(OH)3中加入NaOH浓溶液可实现反应③,写出该反应的化学方程式:
(4)反应④在碱性条件下发生,反应的离子方程式为:
 ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式
您最近一年使用:0次
6 . 储氢纳米碳管研究成功体现了科技的进步,但用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应的化学方程式为:C+K2Cr2O7+H2SO4→CO2↑+K2SO4+Cr2(SO4)3+H2O(未配平)。回答下列问题。
(1)该反应中,还原剂是___________ (填化学式),被还原的元素是___________ (填元素符号)。
(2)该反应中,K2Cr2O7表现出___________ (选填“氧化性”或“还原性”),K2Cr2O7发生了___________ (选填“氧化反应”或“还原反应”)。
(3)H2SO4在该反应中表现出___________(填字母)。
(4)配平上述方程式:________ 。每生成2分子H2O,该反应转移_________ 个电子。
(1)该反应中,还原剂是
(2)该反应中,K2Cr2O7表现出
(3)H2SO4在该反应中表现出___________(填字母)。
| A.只有酸性 | B.只有氧化性 | C.酸性和氧化性 | D.酸性和还原性 |
您最近一年使用:0次
7 . 请回答:
(1)Na2O2的电子式___________ 。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由___________ 。
(3)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为
_______KClO3+_______HCl(浓)=_______KCl+_______ClO2↑+_______Cl2↑+_______
① 请配平上述化学方程式。___________
② 浓盐酸在反应中显示出来的性质是___________
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为___________ 。
④ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的___________ 倍。
(4)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________ 。
(1)Na2O2的电子式
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由
(3)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为
_______KClO3+_______HCl(浓)=_______KCl+_______ClO2↑+_______Cl2↑+_______

① 请配平上述化学方程式。
② 浓盐酸在反应中显示出来的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为
④ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的
(4)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
8 . 石嘴山市施行的《石嘴山市小规模食品生产经营管理规定》中明确规定:小规模食经营者不得购进、存放、使用亚硝酸盐等易滥用的食品添加剂。
(1)根据物质组成分类,亚硝酸钠(NaNO2)属于___________ (填序号),写出其电离方程式:___________ 。
A.钠盐 B.硝酸盐 C.氧化物
(2)实验室中,亚硝酸钠可用来处理过量的叠氮化钠,有关反应的化学方程式如下:
a. NaNO2+H2SO4=HNO2+NaHSO4
b. 2NaN3+2HNO2=3N2↑+2NO↑+2NaOH
上述氧化还原反应中的氧化剂与还原剂的比值为___________ ,反应生成3个N2转移的电子数为___________ 。
(3)亚硝酸钠外观与食盐相似,且均有咸味。
①若误食亚硝酸钠会导致血红蛋白中的亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒、解毒过程的说法中正确的是___________ (填序号)。
A. 亚硝酸钠是还原剂 B.维生素C是氧化剂
C. 维生素C能把铁离子还原成为亚铁离子 D.亚硝酸钠被还原
②鉴别方法如下:将样品盐放入稀硫酸与另外一种溶液(溶质为X)的混合液中,振荡,再滴加淀粉溶液,如果溶液显蓝色,则可以证明该样品盐是亚硝酸钠,如果溶液颜色无变化,则证明该样品盐为氯化钠。X与亚硝酸钠发生的反应可表示为2NaNO2 + 2X + 2H2SO4 = 2NO↑ + I2 + K2SO4 + Na2SO4 + 2H2O(已配平),其中X是___________ (填化学式)该反应的离子方程式为___________ 。
③含NaNO2的废水必须经处理后才能排放,用铵盐来处理亚硝酸钠反应生成一种无毒气体写出该反应的离子方程式:___________ 。
(1)根据物质组成分类,亚硝酸钠(NaNO2)属于
A.钠盐 B.硝酸盐 C.氧化物
(2)实验室中,亚硝酸钠可用来处理过量的叠氮化钠,有关反应的化学方程式如下:
a. NaNO2+H2SO4=HNO2+NaHSO4
b. 2NaN3+2HNO2=3N2↑+2NO↑+2NaOH
上述氧化还原反应中的氧化剂与还原剂的比值为
(3)亚硝酸钠外观与食盐相似,且均有咸味。
①若误食亚硝酸钠会导致血红蛋白中的亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒、解毒过程的说法中正确的是
A. 亚硝酸钠是还原剂 B.维生素C是氧化剂
C. 维生素C能把铁离子还原成为亚铁离子 D.亚硝酸钠被还原
②鉴别方法如下:将样品盐放入稀硫酸与另外一种溶液(溶质为X)的混合液中,振荡,再滴加淀粉溶液,如果溶液显蓝色,则可以证明该样品盐是亚硝酸钠,如果溶液颜色无变化,则证明该样品盐为氯化钠。X与亚硝酸钠发生的反应可表示为2NaNO2 + 2X + 2H2SO4 = 2NO↑ + I2 + K2SO4 + Na2SO4 + 2H2O(已配平),其中X是
③含NaNO2的废水必须经处理后才能排放,用铵盐来处理亚硝酸钠反应生成一种无毒气体写出该反应的离子方程式:
您最近一年使用:0次
名校
解题方法
9 . 回答下列问题。
I.某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,并用电导率传感器测得混合溶液的导电能力(电导率)随时间变化的曲线如图所示。
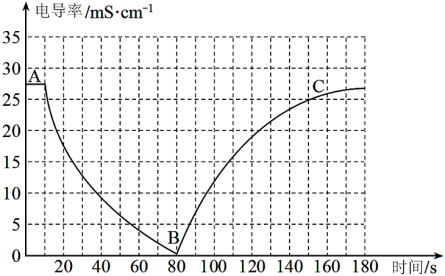
(1)Ba(OH)2在水中以离子形式存在的实验证据是___________ ;
(2)AB段发生的反应的离子方程式是___________ ;
(3)BC段电导率逐渐上升的原因是___________ ;
(4)如果将稀硫酸改为等浓度的稀盐酸,猜想此时电导率的最低点在B点的___________(填选项)
(5)该兴趣小组通过查阅资料了解到Ba2+是重金属离子,可溶性钡盐对人体有毒。医疗上常用硫酸钡作胃肠道检查的造影剂,俗称“钡餐”,而不溶性的碳酸钡却不能做钡餐。请用离子方程式解释原因___________ 。
II.回顾氧化还原反应知识内容,回答下列问题:
(6)配平反应:___________S+___________KOH = ___________K2SO3+___________K2S+___________H2O___________ ,被氧化与被还原的硫原子数目之比是___________ 。
(7)配平反应:___________KMnO4+___________HCl(浓)=___________KCl+___________MnCl2+___________Cl2↑+___________H2O___________ ,氧化剂与还原剂个数之比为___________ ,浓盐酸表现出的性质是___________ 。
(8)配平反应:___________KMnO4 +___________FeSO4 +___________H2SO4 =___________K2SO4 +___________MnSO4 +___________Fe2(SO4)3 +___________H2O___________
(9)配平反应:___________Fe(OH)3+___________NaOH+___________Cl2=___________Na2FeO4+___________NaCl+___________H2O___________
I.某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,并用电导率传感器测得混合溶液的导电能力(电导率)随时间变化的曲线如图所示。

(1)Ba(OH)2在水中以离子形式存在的实验证据是
(2)AB段发生的反应的离子方程式是
(3)BC段电导率逐渐上升的原因是
(4)如果将稀硫酸改为等浓度的稀盐酸,猜想此时电导率的最低点在B点的___________(填选项)
| A.上方 | B.下方 | C.重合 | D.无法确定 |
(5)该兴趣小组通过查阅资料了解到Ba2+是重金属离子,可溶性钡盐对人体有毒。医疗上常用硫酸钡作胃肠道检查的造影剂,俗称“钡餐”,而不溶性的碳酸钡却不能做钡餐。请用离子方程式解释原因
II.回顾氧化还原反应知识内容,回答下列问题:
(6)配平反应:___________S+___________KOH = ___________K2SO3+___________K2S+___________H2O
(7)配平反应:___________KMnO4+___________HCl(浓)=___________KCl+___________MnCl2+___________Cl2↑+___________H2O
(8)配平反应:___________KMnO4 +___________FeSO4 +___________H2SO4 =___________K2SO4 +___________MnSO4 +___________Fe2(SO4)3 +___________H2O
(9)配平反应:___________Fe(OH)3+___________NaOH+___________Cl2=___________Na2FeO4+___________NaCl+___________H2O
您最近一年使用:0次
名校
10 . 碘化钠可用于医学和摄影。实验室制备NaI的基本实验步骤为:①检查装置气密性;②关闭K,向B中滴入30%NaOH溶液3;③打开K,通入H2S至饱和制得NaI,同时有黄色沉淀产生;④关闭K,水浴加热,充分逸出H2S;⑤把B中的混合液倒入烧杯,加入足量碳酸钡除去稀硫酸
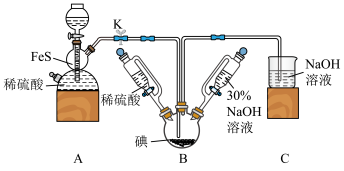
回答下列问题:
(1)A装置中的仪器名称为_______ ,利用此装置还可以制取 _______ (任写一种合理即可)。
(2)盛稀硫酸和30%NaOH溶液的仪器与分液漏斗相比,其优点是_______ 。
(3)A装置中发生反应的化学方程式为_______ 。
(4)通入H2S至饱和,与NaIO3反应制得NaI的离子方程式为_______ 。
(5)步骤⑤中的“一系列操作”包括过滤、洗涤、合并滤液和洗涤液、_______ 等操作。
(6)三颈烧瓶加入5.08g碘单质,若反应的产率为88%,则最终得到产品的质量为_______ 。

回答下列问题:
(1)A装置中的仪器名称为
(2)盛稀硫酸和30%NaOH溶液的仪器与分液漏斗相比,其优点是
(3)A装置中发生反应的化学方程式为
(4)通入H2S至饱和,与NaIO3反应制得NaI的离子方程式为
(5)步骤⑤中的“一系列操作”包括过滤、洗涤、合并滤液和洗涤液、
(6)三颈烧瓶加入5.08g碘单质,若反应的产率为88%,则最终得到产品的质量为
您最近一年使用:0次



 的pH
的pH 的pH
的pH

