名校
1 . 氨在能源、化肥生产等领域有着非常重要的用途。
(1)25℃时, 和
和 能反应生成NO和液态水,生成6mol水时放出1289kJ的热量,其热化学方程式是
能反应生成NO和液态水,生成6mol水时放出1289kJ的热量,其热化学方程式是___________ 。
(2)与 燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型
燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型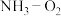 燃料电池原理如下图所示:
燃料电池原理如下图所示:
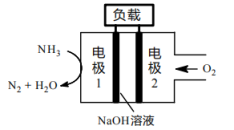
①电极1为___________ (填“正极”或“负极”),电极2的反应式为___________ 。
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:2H2(g)+O2(g)=2H2O(g) ΔH1,N2(g)+3H2(g)=2NH3(g) ΔH2,4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH3, 、
、 、
、 之间的关系式为:
之间的关系式为:
___________ 。
③与热能相比,电能具有更高的利用价值,燃料电池可将化学能直接转化为电能的原因是原电池可将氧化反应与还原反应___________ 进行,使得电子发生定向移动,形成电流。
(3)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是___________ 。
(4)常温常压下电解法合成氨的原理如下图所示:
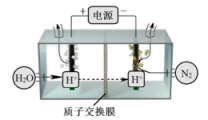
①阳极产生的气体是___________ 。
②阴极生成氨的电极反应式为___________ 。
③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式___________ 。
(1)25℃时,
 和
和 能反应生成NO和液态水,生成6mol水时放出1289kJ的热量,其热化学方程式是
能反应生成NO和液态水,生成6mol水时放出1289kJ的热量,其热化学方程式是(2)与
 燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型
燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型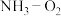 燃料电池原理如下图所示:
燃料电池原理如下图所示:
①电极1为
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:2H2(g)+O2(g)=2H2O(g) ΔH1,N2(g)+3H2(g)=2NH3(g) ΔH2,4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH3,
 、
、 、
、 之间的关系式为:
之间的关系式为:
③与热能相比,电能具有更高的利用价值,燃料电池可将化学能直接转化为电能的原因是原电池可将氧化反应与还原反应
(3)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是
| 序号 | 化学反应 | K(298K)的数值 |
| ① |  |  |
| ② | 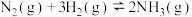 | 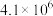 |

①阳极产生的气体是
②阴极生成氨的电极反应式为
③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式
您最近一年使用:0次
名校
2 . 生产钛的方法之一是将金红石( ,熔点为1840℃)转化为
,熔点为1840℃)转化为 (熔点为
(熔点为 ℃),再进一步还原得到钛。
℃),再进一步还原得到钛。 转化为
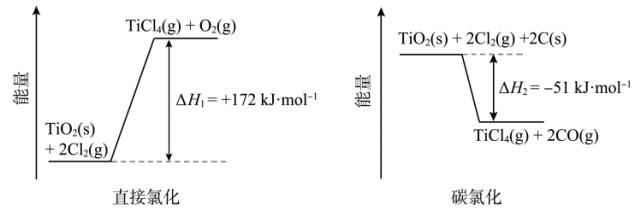
转化为 有直接氯化法和碳氯化法,相关能量示意图如下所示。下列说法
有直接氯化法和碳氯化法,相关能量示意图如下所示。下列说法不正确 的是。
 ,熔点为1840℃)转化为
,熔点为1840℃)转化为 (熔点为
(熔点为 ℃),再进一步还原得到钛。
℃),再进一步还原得到钛。 转化为
转化为 有直接氯化法和碳氯化法,相关能量示意图如下所示。下列说法
有直接氯化法和碳氯化法,相关能量示意图如下所示。下列说法
A. 与 与 的晶体类型不同 的晶体类型不同 |
B.可推知 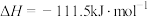 |
| C.将反应物固体粉碎可以加快直按氯化、碳氯化的反应速率 |
| D.判断直接氯化反应能否自发进行需要综合考虑体系的焓变和熵变 |
您最近一年使用:0次
名校
3 . Cl2是一种重要的化工原料,以HCl为原料,用O2氧化制取Cl2,可提高效益,减少污染。反应如下:
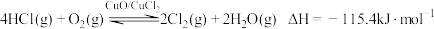
上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。
其基本原理如下图所示:
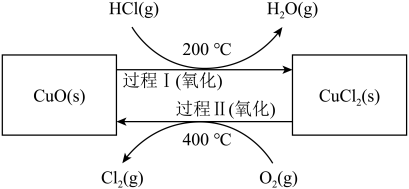
过程Ⅰ的反应为: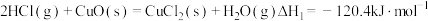
(1)用电子式表示HCl的形成过程_______ 。
(2)过程Ⅱ反应的热化学方程式为_______ 。
(3)过程Ⅰ流出的气体通过稀NaOH溶液(含少量酚酞)进行检测,氯化初期主要为不含HCl的气体,判断氧化结束时溶液的现象为_______ 。
(4)相同条件下,若将氯化温度升高到300℃,溶液中出现上述现象的时间将缩短,其原因为_______ 。
(5)实验测得在不同压强下,总反应的HCl平衡转化率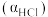 随温度变化的曲线如下图:
随温度变化的曲线如下图:
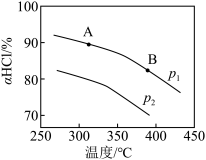
①平衡常数比较:K(A)_______ K(B)(填“>”、“<”或“=”,下同)。
②压强比较:p1_______ p2。理由是_______ 。
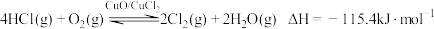
上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。
其基本原理如下图所示:

过程Ⅰ的反应为:
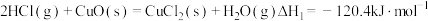
(1)用电子式表示HCl的形成过程
(2)过程Ⅱ反应的热化学方程式为
(3)过程Ⅰ流出的气体通过稀NaOH溶液(含少量酚酞)进行检测,氯化初期主要为不含HCl的气体,判断氧化结束时溶液的现象为
(4)相同条件下,若将氯化温度升高到300℃,溶液中出现上述现象的时间将缩短,其原因为
(5)实验测得在不同压强下,总反应的HCl平衡转化率
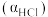 随温度变化的曲线如下图:
随温度变化的曲线如下图:
①平衡常数比较:K(A)
②压强比较:p1
您最近一年使用:0次
名校
解题方法
4 . CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g) CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1
反应Ⅱ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H2
CH3OCH3(g)+3H2O(g) △H2
恒压,投入1 mol CO2和适当过量的H2,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

CH3OCH3的选择性=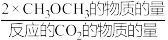 ×100%
×100%
下列说法中不正确 的是
反应Ⅰ:CO2(g)+H2(g)
 CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1反应Ⅱ:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H2
CH3OCH3(g)+3H2O(g) △H2恒压,投入1 mol CO2和适当过量的H2,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

CH3OCH3的选择性=
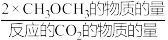 ×100%
×100%下列说法中
| A.△H1>0,△H2<0 |
| B.温度高于300℃,反应Ⅰ正移程度超过反应Ⅱ逆移程度 |
| C.220℃时,反应一段时间后,测得CH3OCH3的选择性为48%(即图中A点)。此时反应Ⅰ和Ⅱ均未达到平衡状态 |
| D.若平衡时CH3OCH3的选择性为48%,则体系中c(CH3OCH3)∶c(CO)=48∶52 |
您最近一年使用:0次
2023-05-30更新
|
693次组卷
|
2卷引用:北京市第一○一中学2023届高三下学期三模化学试题
名校
解题方法
5 . 二氧化碳的排放受到环境和能源领域的关注,其综合利用是研究的重要课题。
(1)已知下列热化学方程式:
反应Ⅰ:
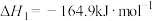
反应Ⅱ:

则反应

___________  。
。
(2)向恒压密闭容器中通入 、
、 ,分别在
,分别在 和
和 下发生反应Ⅰ和反应Ⅱ.体系平衡时,CO和
下发生反应Ⅰ和反应Ⅱ.体系平衡时,CO和 的选择性
的选择性 与温度变化关系如图所示、
与温度变化关系如图所示、


定义:
 ×100%
×100%
①下列叙述能判断反应体系达到平衡的是___________ (填字母序号)。
A. 的消耗速率和
的消耗速率和 的消耗速率相等
的消耗速率相等
B.混合气体的密度不再发生变化
C.容器内压强不再发生变化
②图中表示 时
时 随温度变化关系的曲线是
随温度变化关系的曲线是___________ (填字母),理由是___________ 。
③550℃、 条件下,上述容器通入气体的初始体积为
条件下,上述容器通入气体的初始体积为 ,则平衡时容器体积为
,则平衡时容器体积为___________ 。
(3)一种从高炉气回收 制储氢物质
制储氢物质 的综合利用示意图如图所示:
的综合利用示意图如图所示:

已知:T温度下, ,
,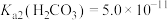
①T温度下,当吸收池中溶液的 时,此时该溶液中
时,此时该溶液中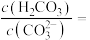
___________ 。
②铂电极上 电催化还原为
电催化还原为 ,该电极反应方程式为
,该电极反应方程式为___________ 。
铂电极上的副反应除析氢外,没有其它放电过程。若生成 的电解效率
的电解效率 %。当电路中转移
%。当电路中转移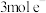 时,阴极窒溶液的质量增加
时,阴极窒溶液的质量增加___________ g。
定义: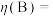

(1)已知下列热化学方程式:
反应Ⅰ:

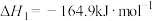
反应Ⅱ:


则反应


 。
。(2)向恒压密闭容器中通入
 、
、 ,分别在
,分别在 和
和 下发生反应Ⅰ和反应Ⅱ.体系平衡时,CO和
下发生反应Ⅰ和反应Ⅱ.体系平衡时,CO和 的选择性
的选择性 与温度变化关系如图所示、
与温度变化关系如图所示、

定义:

 ×100%
×100%①下列叙述能判断反应体系达到平衡的是
A.
 的消耗速率和
的消耗速率和 的消耗速率相等
的消耗速率相等B.混合气体的密度不再发生变化
C.容器内压强不再发生变化
②图中表示
 时
时 随温度变化关系的曲线是
随温度变化关系的曲线是③550℃、
 条件下,上述容器通入气体的初始体积为
条件下,上述容器通入气体的初始体积为 ,则平衡时容器体积为
,则平衡时容器体积为(3)一种从高炉气回收
 制储氢物质
制储氢物质 的综合利用示意图如图所示:
的综合利用示意图如图所示:
已知:T温度下,
 ,
,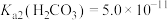
①T温度下,当吸收池中溶液的
 时,此时该溶液中
时,此时该溶液中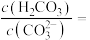
②铂电极上
 电催化还原为
电催化还原为 ,该电极反应方程式为
,该电极反应方程式为铂电极上的副反应除析氢外,没有其它放电过程。若生成
 的电解效率
的电解效率 %。当电路中转移
%。当电路中转移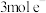 时,阴极窒溶液的质量增加
时,阴极窒溶液的质量增加定义:
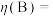

您最近一年使用:0次
名校
解题方法
6 . 光解水制氢的关键步骤是水的氧化。我国科学家用仿生催化剂[用 表示]实现在NaHCO3溶液中高效催化水的氧化,该过程物质转化及反应能量变化示意图如下:
表示]实现在NaHCO3溶液中高效催化水的氧化,该过程物质转化及反应能量变化示意图如下:不正确 的是
 表示]实现在NaHCO3溶液中高效催化水的氧化,该过程物质转化及反应能量变化示意图如下:
表示]实现在NaHCO3溶液中高效催化水的氧化,该过程物质转化及反应能量变化示意图如下: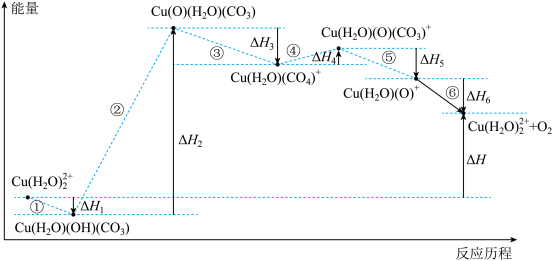
A.步骤①可表示为 |
B.水的氧化反应为: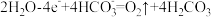 |
C.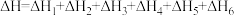 |
| D.催化剂参与反应,降低活化能,加快反应速率 |
您最近一年使用:0次
2023-05-07更新
|
1264次组卷
|
9卷引用:北京市海淀区2022-2023学年高三第二次模拟(下学期期末)考试化学试题
北京市海淀区2022-2023学年高三第二次模拟(下学期期末)考试化学试题(已下线)专题08 化学反应中的能量变化(已下线)第12练 有关反应热的综合考查 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)福建省厦门第一中学2023届高三下学期模拟考试化学试题(已下线)专题09 化学反应中的热效应与反应机理-2023年高考化学真题题源解密(全国通用)(已下线)考点1 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)选择题16-20北京交通大学附属中学2023-2024学年高三下学期3月月考化学试题湖北省武汉市洪山高级中学2024届高三下学期第 2次模拟考试化学试卷
名校
解题方法
7 . 碳酸钠晶体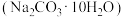 失水可得到
失水可得到 或
或 ,两个化学反应的能量变化如图所示,下列说法正确的是
,两个化学反应的能量变化如图所示,下列说法正确的是
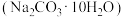 失水可得到
失水可得到 或
或 ,两个化学反应的能量变化如图所示,下列说法正确的是
,两个化学反应的能量变化如图所示,下列说法正确的是
A.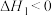 |
B.碳酸钠晶体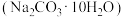 失水是物理变化 失水是物理变化 |
C. 失水生成 失水生成 : :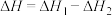 |
D.向 中滴加几滴水,温度升高 中滴加几滴水,温度升高 |
您最近一年使用:0次
2023-04-12更新
|
209次组卷
|
3卷引用:北京市首都师范大学附属中学2023-2024学年高二上学期期中考试化学试题
名校
8 . 中国科学家在淀粉人工光合成方面取得重大突破性进展,该实验方法首先将CO2催化还原为CH3OH。已知CO2催化加氢的主要反应有:
① CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH1=- 49.4 kJ/mol
CH3OH(g) + H2O(g) ΔH1=- 49.4 kJ/mol
② CO2(g) + H2(g) CO(g) + H2O(g) ΔH2=+ 41.2 kJ/mol
CO(g) + H2O(g) ΔH2=+ 41.2 kJ/mol
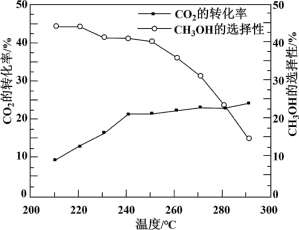
其他条件不变时,在相同时间内温度对CO2催化加氢的影响如下图。下列说法不正确 的是
【注】CH3OH的选择性=
① CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH1=- 49.4 kJ/mol
CH3OH(g) + H2O(g) ΔH1=- 49.4 kJ/mol② CO2(g) + H2(g)
 CO(g) + H2O(g) ΔH2=+ 41.2 kJ/mol
CO(g) + H2O(g) ΔH2=+ 41.2 kJ/mol其他条件不变时,在相同时间内温度对CO2催化加氢的影响如下图。下列说法

【注】CH3OH的选择性=

A.CO(g) + 2H2(g) CH3OH(g) ΔH=- 90.6 kJ/mol CH3OH(g) ΔH=- 90.6 kJ/mol |
| B.使用催化剂,能降低反应的活化能,增大活化分子百分数 |
| C.其他条件不变,增大压强,有利于反应向生成CH3OH的方向进行 |
| D.220~240 ℃,升高温度,对反应②速率的影响比对反应①的小 |
您最近一年使用:0次
2023-02-16更新
|
613次组卷
|
13卷引用:北京一零一中学2022-2023学年高三上学期统练六化学试题
北京一零一中学2022-2023学年高三上学期统练六化学试题北京市第二十中学2022-2023学年高三下学期开学检测化学试题北京市一0一中学2022-2023学年高二下学期期中考试化学试题北京市西城区2021~2022学年高三上学期期末考试化学试题北京市第一六一中学2022-2023学年高三上学期10月月考化学试题北京市北京师范大学附属中学2022-2023学年高二上学期期中考试化学试题新疆阿克苏地区等2地新疆生产建设兵团第一师第二高级中学等2校2022-2023学年高三下学期2月月考化学试题福建省南平第一中学2023-2024学年高三上学期10月月考化学试题广东省广州市实验外语学校2023-2024学年高二上学期11月期中考试化学试题 北京市回民学校2023-2024学年高三上学期统练二化学试题北京市第十五中学2023-2024学年高二上学期期中考试化学试题北京市育才学校2023-2024学年高一上学期化学期中试题北京师范大学附属实验中学2023-2024学年高二下学期开学检测化学试题
名校
解题方法
9 . 氢能是一种清洁能源,按照生产过程中的碳排放情况分为绿氢、蓝氢和灰氢。
(1)煤的气化制得灰氢 :
 。该反应的平衡常数表达式
。该反应的平衡常数表达式
_______ ,其随温度升高的变化趋势是_______ 。
(2)热化学硫碘循环分解水制得绿氢 ,全程零碳排放。反应如下:
反应i:
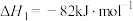
反应ii:
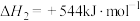
反应iii:……
反应i~iii循环实现分解水:
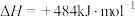 。
。
写出反应ⅲ的热化学方程式_______ 。
(3)甲烷水蒸气催化重整制得蓝氢 ,步骤如下。
I. 的制取:
的制取:

①为提高 的平衡转化率,可采取的措施有
的平衡转化率,可采取的措施有_______ (写出两条即可)。
II. 的富集:
的富集:

②已知830℃时,该反应的平衡常数 。在容积不变的的密闭容器中,将
。在容积不变的的密闭容器中,将
 与
与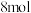
 混合加热到830℃,反应达平衡时
混合加热到830℃,反应达平衡时 的转化率为
的转化率为_______ 。
③提高 的转化率有助于
的转化率有助于 的富集,请你在下图中画出
的富集,请你在下图中画出 的转化率随温度、压强变化的趋势
的转化率随温度、压强变化的趋势_______ 。

III. 的处理。
的处理。
④HEM燃料电池可用于清除或者是富集 ,其原理如下图所示,请你尝试用化学用语表达该燃料电池正极吸收
,其原理如下图所示,请你尝试用化学用语表达该燃料电池正极吸收 的原理:
的原理:_______ 。

(1)煤的气化制得

 。该反应的平衡常数表达式
。该反应的平衡常数表达式
(2)热化学硫碘循环分解水制得
反应i:

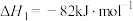
反应ii:

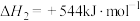
反应iii:……
反应i~iii循环实现分解水:

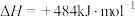 。
。写出反应ⅲ的热化学方程式
(3)甲烷水蒸气催化重整制得
I.
 的制取:
的制取:

①为提高
 的平衡转化率,可采取的措施有
的平衡转化率,可采取的措施有II.
 的富集:
的富集:

②已知830℃时,该反应的平衡常数
 。在容积不变的的密闭容器中,将
。在容积不变的的密闭容器中,将
 与
与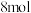
 混合加热到830℃,反应达平衡时
混合加热到830℃,反应达平衡时 的转化率为
的转化率为③提高
 的转化率有助于
的转化率有助于 的富集,请你在下图中画出
的富集,请你在下图中画出 的转化率随温度、压强变化的趋势
的转化率随温度、压强变化的趋势
III.
 的处理。
的处理。④HEM燃料电池可用于清除或者是富集
 ,其原理如下图所示,请你尝试用化学用语表达该燃料电池正极吸收
,其原理如下图所示,请你尝试用化学用语表达该燃料电池正极吸收 的原理:
的原理:
您最近一年使用:0次
名校
解题方法
10 . 利用工业废气中的 合成基础化工原料甲醇
合成基础化工原料甲醇 ,是
,是 资源化的重要方法,涉及的主要化学反应有:
资源化的重要方法,涉及的主要化学反应有:
反应ⅰ: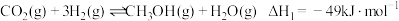
反应ⅱ: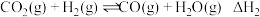
(1)反应ⅱ的化学平衡常数表达式为_______ 。
(2)已知: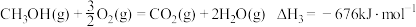 。利用
。利用 和
和 计算
计算 时,还需要利用
时,还需要利用_______ 反应的 。通过计算得出
。通过计算得出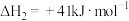 。
。
(3)控制反应条件(均使用了催化剂),研究投料比(反应物的物质的量之比)、压强、温度对反应体系的影响。
产率 和选择性S的定义:
和选择性S的定义: ,
,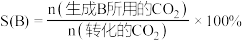
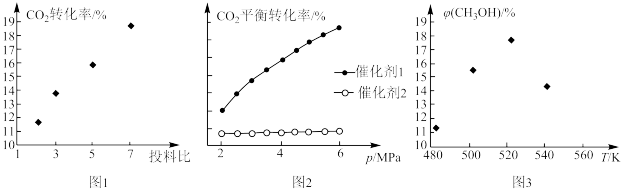
①图1中,投料比是指_______ (填“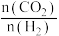 ”或“
”或“ ”);当投料比为5时,
”);当投料比为5时, 的转化率约为16%,
的转化率约为16%,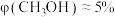 ,则
,则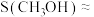
_______ 。
②图2中,在催化剂2的作用下,发生的主要反应是_______ (填“ⅰ”或“ⅱ”)。
③图3中,当温度高于 时,甲醇的产率随温度升高而减小,原因可能有
时,甲醇的产率随温度升高而减小,原因可能有_______ (写出2条)。
(4)一定条件下,向体积为 的恒容密闭容器中通入
的恒容密闭容器中通入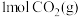 和
和 ,发生上述反应,t秒后达到平衡。此时容器中
,发生上述反应,t秒后达到平衡。此时容器中 为
为 ,
, 为
为 。
。
①平衡后 的浓度为
的浓度为_______  (用含a、b、V的代数式表示,下同)。
(用含a、b、V的代数式表示,下同)。
②用 的浓度变化表示
的浓度变化表示 秒内反应ⅱ的反应速率,
秒内反应ⅱ的反应速率,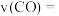
_______  。
。
③该条件下反应ⅰ的化学平衡常数为_______ 。
 合成基础化工原料甲醇
合成基础化工原料甲醇 ,是
,是 资源化的重要方法,涉及的主要化学反应有:
资源化的重要方法,涉及的主要化学反应有:反应ⅰ:
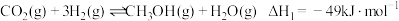
反应ⅱ:
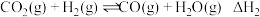
(1)反应ⅱ的化学平衡常数表达式为
(2)已知:
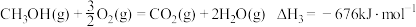 。利用
。利用 和
和 计算
计算 时,还需要利用
时,还需要利用 。通过计算得出
。通过计算得出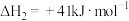 。
。(3)控制反应条件(均使用了催化剂),研究投料比(反应物的物质的量之比)、压强、温度对反应体系的影响。
产率
 和选择性S的定义:
和选择性S的定义: ,
,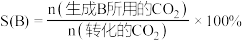

①图1中,投料比是指
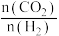 ”或“
”或“ ”);当投料比为5时,
”);当投料比为5时, 的转化率约为16%,
的转化率约为16%,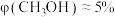 ,则
,则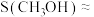
②图2中,在催化剂2的作用下,发生的主要反应是
③图3中,当温度高于
 时,甲醇的产率随温度升高而减小,原因可能有
时,甲醇的产率随温度升高而减小,原因可能有(4)一定条件下,向体积为
 的恒容密闭容器中通入
的恒容密闭容器中通入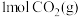 和
和 ,发生上述反应,t秒后达到平衡。此时容器中
,发生上述反应,t秒后达到平衡。此时容器中 为
为 ,
, 为
为 。
。①平衡后
 的浓度为
的浓度为 (用含a、b、V的代数式表示,下同)。
(用含a、b、V的代数式表示,下同)。②用
 的浓度变化表示
的浓度变化表示 秒内反应ⅱ的反应速率,
秒内反应ⅱ的反应速率,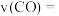
 。
。③该条件下反应ⅰ的化学平衡常数为
您最近一年使用:0次
2023-01-06更新
|
195次组卷
|
3卷引用:北京交通大学附属中学2023-2024学年高二上学期期中考试化学试题



