(1)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)⇌H2NCOONH4(s) ΔH=-272kJ•mol-1
第二步:H2NCOONH4(s)⇌CO(NH2)2(s)+H2O(g) ΔH=+138kJ•mol-1
写出工业上以NH3、CO2为原料合成尿素和H2O(g)的热化学方程式:
(2)一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,发生反应2CO(g)+SO2(g)⇌2CO2(g)+S(s)。若反应进行到20min时达到平衡,测得CO2的体积分数为0.5,则前20min内平均反应速率v(CO)=
(3)工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收SO2。
①为了提高吸收效率,常用Ni2O3作为催化剂。催化过程如图1所示。
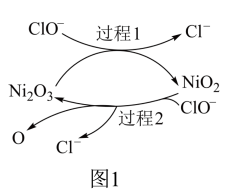
a.过程2的反应式为
b.Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是
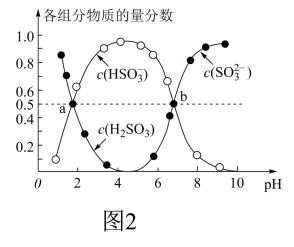
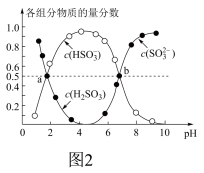
②室温下,(NH4)2SO3溶液中含硫组分物质的量分数随溶液pH的变化关系如图2所示,b点时溶液pH=7,则n(NH4+):n(SO32-)=
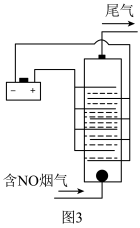
(4)用食盐水作电解液电解烟气脱氮的原理如图3所示,碱性条件下NO被阳极产生的Cl2氧化为NO3-,尾气经氢氧化钠溶液吸收后排入空气。碱性条件下NO被阳极产生的氧化性物质氧化为NO3-的离子方程式为
 尿素
尿素 是一种非常重要的高效氮肥,工业上以
是一种非常重要的高效氮肥,工业上以 、
、 为原料生产尿素,该反应实际为两步反应:
为原料生产尿素,该反应实际为两步反应:第一步:


第二步:


写出工业上以
 、
、 为原料合成尿素和
为原料合成尿素和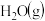 的热化学方程式:
的热化学方程式: 一定温度下,向
一定温度下,向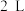 恒容密闭容器中通入
恒容密闭容器中通入 和
和 ,发生反应
,发生反应 。若反应进行到
。若反应进行到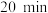 时达到平衡,测得
时达到平衡,测得 的体积分数为
的体积分数为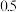 ,则前
,则前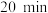 内平均反应速率
内平均反应速率

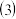 工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收
工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收 。
。 为了提高吸收效率,常用
为了提高吸收效率,常用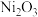 作为催化剂。催化过程如图1所示。
作为催化剂。催化过程如图1所示。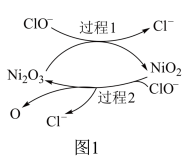
 过程2的反应式为
过程2的反应式为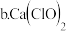 也可用于脱硫,且脱硫效果比NaClO更好,原因是
也可用于脱硫,且脱硫效果比NaClO更好,原因是 室温下,
室温下, 溶液中含硫组分物质的量分数随溶液pH的变化关系如图2所示,b点时溶液
溶液中含硫组分物质的量分数随溶液pH的变化关系如图2所示,b点时溶液 ,则
,则
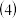 用食盐水作电解液电解烟气脱氮的原理如图3所示,碱性条件下NO被阳极产生的
用食盐水作电解液电解烟气脱氮的原理如图3所示,碱性条件下NO被阳极产生的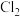 氧化为
氧化为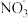 ,尾气经氢氧化钠溶液吸收后排入空气。碱性条件下NO被阳极产生的氧化性物质氧化为
,尾气经氢氧化钠溶液吸收后排入空气。碱性条件下NO被阳极产生的氧化性物质氧化为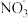 的离子方程式为
的离子方程式为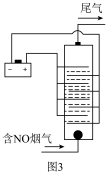
3 . 绿水青山是习总书记构建美丽中国的伟大设想,研究碳、氮、硫等大气污染物和水污染物的处理对建设美丽中国有重要意义。
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)═2NO2(g)  H1=﹣112.4kJ•mol﹣1
H1=﹣112.4kJ•mol﹣1
②NO2(g)+CO(g)═NO(g)+CO2(g) H 2=﹣234kJ•mol﹣1
H 2=﹣234kJ•mol﹣1
③N2(g)+O2(g)═2NO(g) H 3=+179.2kJ•mol﹣1
H 3=+179.2kJ•mol﹣1
请写出CO和NO2生成无污染气体的热化学方程式
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)⇌N2(g)+2CO2(g) H=﹣759.8kJ•mol﹣1,反应达到平衡时,N2的体积分数随
H=﹣759.8kJ•mol﹣1,反应达到平衡时,N2的体积分数随 的变化曲线如图1。
的变化曲线如图1。
①b点时,平衡体系中C、N原子个数之比接近
②a、c、d三点的平衡常数从大到小的顺序为
③若 =0.8,反应达平衡时,N2的体积分数为25%,则CO的转化率为
=0.8,反应达平衡时,N2的体积分数为25%,则CO的转化率为
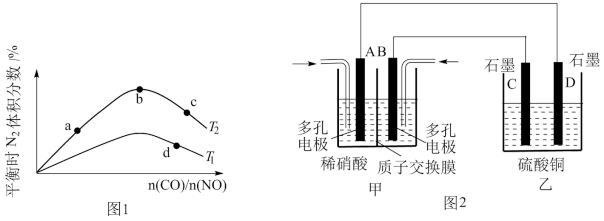
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为
(4)已知:25℃时,H2C2O4的电离常数Ka1=5.9×10﹣2,Ka2=6.4×10﹣5,25℃时,0.1 mol•L﹣1NaHC2O4溶液中各离子浓度由大到小的顺序为 )=c(C2O
)=c(C2O ),则此时溶液
),则此时溶液
(1)“催化转换器”能将汽车尾气中CO与NO转化成可参与大气生态环境循环的无毒气体,并促进烃类充分燃烧及SO2的转化,但也在一定程度上提高了空气的酸度。“催化转换器”提高空气酸度的原因是
(2)用氨水将燃煤烟气中的SO2转化成NH4HSO3。该法是利用了SO2
A.漂白性 B.氧化性 C.还原性 D.酸性氧化物性质
(3)用生物质热解气(主要成分CO、CH4、H2)将燃煤烟气中SO2在高温下还原成单质硫。主要发生了下列反应:
2H2(g) +SO2(g)= S(g) + 2H2O(g) △H1 = + 90.4kJ▪mol-1
2CO(g) +O2(g)= 2CO2(g) △H2 = - 566.0kJ▪mol-1
S(g) +O2(g)= SO2(g) △H3 = - 574.0kJ▪mol-1
试写出CO将SO2还原成S(g)的热化学方程式
(4)将硫酸工业尾气中的SO2转化成硫酸,同时获得电能。装置如图所示(电极均为惰性材料):
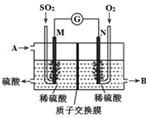
①溶液中的H+移向
②M极发生的电极反应式为
③写出A、B所代表的物质的化学式:
A
(5)利用硫酸钠溶液吸收冶金工业烟气中SO2,再用惰性电极电解,能获得所需的产品,装置如图所示。
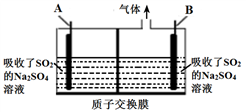
①若电解后A极区得到硫酸,则B电极反应式为
②若电解后A极区析出硫磺,则电解反应的化学方程式为
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.4 kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234 kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=+179.2 kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。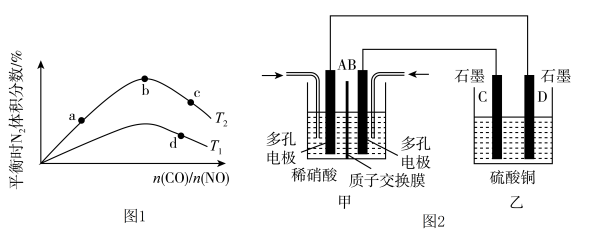
①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从大到小的顺序为
③a、c、d三点的平衡常数从大到小的顺序为
④若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为25%,则CO的转化率为
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为
(4)已知:25 ℃时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6.4×10-5,25 ℃时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为
已知:①2NO(g)+O2(g)=2NO2(g) △H1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) △H2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) △H3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从大到小的顺序为
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极处通入的气体为
(4)已知:25℃时,H2C2O4的电离常数Ka1=5.9×10—2,Ka2=6.4×10-5,则25℃时,0.1mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)⇌CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g)⇌CO2(g)+2H2(g) △H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1
则表示甲醇的燃烧热的热化学方程式为
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为
(3)过量氯气用Na2S2O3除去,反应中
 被氧化为
被氧化为 。若过量的氯气为1×10-3mol,则理论上生成的
。若过量的氯气为1×10-3mol,则理论上生成的 为
为某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:
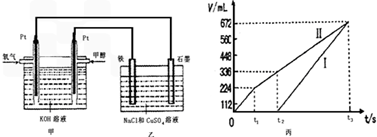
(4)写出甲中通入甲醇这一极的电极反应式
(5)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式
(6)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为
(7)若使上述电解装置的电流强度达到5.0A,理论上每分钟应向负极通入气体的质量为
2NO(g) +O2(g)=2NO2(g) H1= a kJ·mol-1
NO(g) +O3(g)=NO2(g) +O2(g) H2= b kJ·mol-1
4NO2(g) +O2(g) =2N2O5(g) H3= c kJ·mol-1
(1)反应6NO2 (g) +O3(g)=3N2O5(g) H=
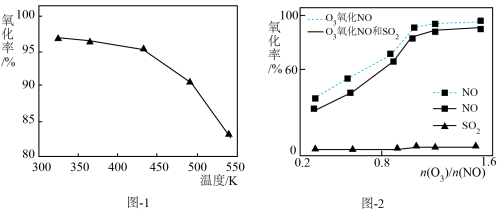
(2)O3氧化NO的氧化率随温度变化情况如图-1。随着温度升高NO的氧化率下降的原因可能是
(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验。实验结果如图-2。同时脱硫脱硝时NO的氧化率略低的原因是
a.O3氧化SO2反应的活化能较大
b.O3与NO反应速率比O3与SO2反应速率快
c.等物质的量的O3与NO反应放出的热量比与SO2反应的多
(4)尿素[CO(NH2)2]在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为
Ⅰ.若X、Y是相邻相似
 ,它们的单质都必须采用电解法制备,但都无需密封保存,
,它们的单质都必须采用电解法制备,但都无需密封保存,(1)X离子的结构示意图
Ⅱ.若X、Y是同族相似
 ,X是形成化合物种类最多的元素。
,X是形成化合物种类最多的元素。(3)I2O3以氧化XO,常用于测定XO含量,已知:①2I2(s)+5O2(g)=2I2O5(s)△H=-75.66kJ·mol-1
②2XO(g)+O2(g)=2XO2(g) △H=-566.0kJ·mol-1。请写出XO(g)与I2O5(s)和XO2(g)的热化学方程式:
(4)工业上用X单质与Y的氧化物反应制取Y单质的过程中,YO是反应中间产物,隔绝空气时YO和NaOH溶液反应(产物之一是Na2YO3)的离子方程式是
Ⅲ.若X、Y是对角相似
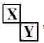 ,X、Y的最高价含氧酸的浓溶液都有强氧化性。
,X、Y的最高价含氧酸的浓溶液都有强氧化性。(5)下列试剂都可以证明X、Y的最高价含氧酸的浓溶液都有强氧化性的是
| A.铁片 | B.铜片 | C.二氧化硫 | D.木炭 |
(6)HA是含有X元素的一元酸,常温下,将0.2mol/L的HA溶液与等体积、等浓度的NaOH溶液混合,所得溶液(假设溶液体积可以相加)中部分微粒组成及浓度如右图所示,图中N表示


(7)某化工厂设计要求:空气中YO2含量不得超过0.02mg/L。某同学用右图所示简易装置测定空气中的YO2含量:准确移取10mL5×10-4mol/L的标准碘水溶液,注入试管中,加2-3滴淀粉指示剂,此时溶液呈蓝色,在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,假设该同学的测量是准确的,则他抽气的次数至少为
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高。下列措施不能够有效控制CO2所导致的温室效应的是
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka=4.7×10-8.写出84消毒液露置在空气中发生反应的离子方程式
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。

已知:H2C2O4
 CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为
CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为(4)已知C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1;CO(g)+
 O2(g)=CO2(g) ΔH=-283.0kJ·mol-1,写出CO2和C(s)反应的热化学方程式
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1,写出CO2和C(s)反应的热化学方程式


