1 . 砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知砷酸(H3AsO4)的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(pKa=-lgKa)。回答下列问题:
(1)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔHl
H2(g)+2O2(g)=H3AsO4(s) ΔHl
H2(g)+ O2(g)=H2O(1) ΔH2
O2(g)=H2O(1) ΔH2
As(s)+ O2(g)=
O2(g)= As2O5(s)ΔH3
As2O5(s)ΔH3
则反应As2O5(g)+3H2O(1)=2H3AsO4(s) ΔH=_________ 。
(2)写出砷酸(H3AsO4)的第二步电离方程式___________________________________ 。
(3)NaH2AsO4溶液呈______ (填“酸性”、“中性”或“碱性”),试通过计算说明________________________ 。
(4)亚砷酸(H3AsO3)水溶液中存在多种微粒形态,各种微粒分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的pH关系如下图所示。

以酚酞为指示剂(变色范围pH:8.2~10.0),将NaOH溶液逐滴加入H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为__________________________ 。
(5)某化学兴趣小组同学欲探究可逆反应AsO +I2+2OH-
+I2+2OH- AsO
AsO +2I-+ H2O。设计如下图Ⅰ所示装置。实验操作及现象:按图Ⅰ装置加入试剂并连接装置,电流由C2流入C1。 当电流变为零时,向图Ⅰ装置左边烧杯中逐滴加入一定量2mol/L盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅱ所示。
+2I-+ H2O。设计如下图Ⅰ所示装置。实验操作及现象:按图Ⅰ装置加入试剂并连接装置,电流由C2流入C1。 当电流变为零时,向图Ⅰ装置左边烧杯中逐滴加入一定量2mol/L盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅱ所示。
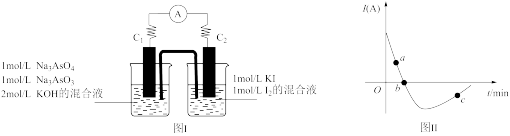
①图Ⅱ中AsO 的逆反应速率:a
的逆反应速率:a____ b( 填“ >”、” <”或“ =” )。
②写出图Ⅱ中c点对应图Ⅰ装置的正极反应式__________________________ 。
③能判断该反应达到平衡状态的是________________ 。
a.2v(I-)正=v(AsO )逆 b.溶液的pH不再变化
)逆 b.溶液的pH不再变化
c.电流表示数变为零 d.溶液颜色不再变化
(1)已知:As(s)+
 H2(g)+2O2(g)=H3AsO4(s) ΔHl
H2(g)+2O2(g)=H3AsO4(s) ΔHlH2(g)+
 O2(g)=H2O(1) ΔH2
O2(g)=H2O(1) ΔH2As(s)+
 O2(g)=
O2(g)= As2O5(s)ΔH3
As2O5(s)ΔH3则反应As2O5(g)+3H2O(1)=2H3AsO4(s) ΔH=
(2)写出砷酸(H3AsO4)的第二步电离方程式
(3)NaH2AsO4溶液呈
(4)亚砷酸(H3AsO3)水溶液中存在多种微粒形态,各种微粒分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的pH关系如下图所示。

以酚酞为指示剂(变色范围pH:8.2~10.0),将NaOH溶液逐滴加入H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为
(5)某化学兴趣小组同学欲探究可逆反应AsO
 +I2+2OH-
+I2+2OH- AsO
AsO +2I-+ H2O。设计如下图Ⅰ所示装置。实验操作及现象:按图Ⅰ装置加入试剂并连接装置,电流由C2流入C1。 当电流变为零时,向图Ⅰ装置左边烧杯中逐滴加入一定量2mol/L盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅱ所示。
+2I-+ H2O。设计如下图Ⅰ所示装置。实验操作及现象:按图Ⅰ装置加入试剂并连接装置,电流由C2流入C1。 当电流变为零时,向图Ⅰ装置左边烧杯中逐滴加入一定量2mol/L盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅱ所示。
①图Ⅱ中AsO
 的逆反应速率:a
的逆反应速率:a②写出图Ⅱ中c点对应图Ⅰ装置的正极反应式
③能判断该反应达到平衡状态的是
a.2v(I-)正=v(AsO
 )逆 b.溶液的pH不再变化
)逆 b.溶液的pH不再变化c.电流表示数变为零 d.溶液颜色不再变化
您最近一年使用:0次
名校
2 . 按要求书写下列表达式。
(1)用次氯酸钠除去氨氮的原理如图所示。该图示的总反应化学方程式为_________ 。

(2)已知:
反应Ⅰ N2(g)+O2(g)=2NO(g) ΔH1=a kJ·mol-1
反应Ⅱ 2NO(g)+O2(g)=2NO2(g) ΔH2=b kJ·mol-1
反应Ⅲ 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH3=c kJ·mol-1
写出NO2和NH3反应生成N2和液态水的热化学反应方程式_________ 。
(3)用压强传感器探究生铁在pH=2和pH=4的醋酸溶液中发生的腐蚀装置及得到的图象如图。


①溶液的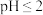 时,生铁发生电化学腐蚀的正极反应式为
时,生铁发生电化学腐蚀的正极反应式为_________ 。
②溶液的pH=4时,生铁发生_________ 腐蚀。
(4)用KOH做电解质的CO碱性燃料电池(如图)作电源,用惰性电极电解含CN-的酸性废水,将CN-彻底氧化为无害气体,以净化废水。该电池的负极反应式为_________ ;电解CN-废水的阳极反应式为_______ 。

(1)用次氯酸钠除去氨氮的原理如图所示。该图示的总反应化学方程式为

(2)已知:
反应Ⅰ N2(g)+O2(g)=2NO(g) ΔH1=a kJ·mol-1
反应Ⅱ 2NO(g)+O2(g)=2NO2(g) ΔH2=b kJ·mol-1
反应Ⅲ 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH3=c kJ·mol-1
写出NO2和NH3反应生成N2和液态水的热化学反应方程式
(3)用压强传感器探究生铁在pH=2和pH=4的醋酸溶液中发生的腐蚀装置及得到的图象如图。


①溶液的
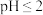 时,生铁发生电化学腐蚀的正极反应式为
时,生铁发生电化学腐蚀的正极反应式为②溶液的pH=4时,生铁发生
(4)用KOH做电解质的CO碱性燃料电池(如图)作电源,用惰性电极电解含CN-的酸性废水,将CN-彻底氧化为无害气体,以净化废水。该电池的负极反应式为

您最近一年使用:0次
名校
3 . Ⅰ.氧、硫、硒、碲均位于元素周期表的VIA族,其化合物在化工生产中有广泛应用。
(1)下列性质的递变顺序不正确 的是_____ (填字母)。
A.酸性:H2SeO4 > H2SeO3 B.非金属性:O > S > Se > Te
C.还原性:H2Te > H2Se > H2S > H2O D.热稳定性:H2O > H2Te > H2Se > H2S
E.沸点:H2Te > H2Se > H2S > H2O
(2)在常温下进行的置换反应X+W→Y+V中, H2O可以扮演不同的“角色”。已知X、Y是短周期主族元素形成的单质,W、V是化合物。
①若W是水,且作还原剂,反应的化学方程式为_____________________________________ 。
②若V是水,为还原产物,反应的化学方程式为_____________________________________ 。
(3)已知:液态CS2完全燃烧生成CO2、SO2气体,每转移3mol电子时放出269.2kJ热量。写出表示CS2(1)的燃烧热的热化学方程式:________________________________________ 。
(4)工业上,用S02还原TeC14溶液制备碲(Te),反应中氧化产物与还原产物的物质的量之比为____________ 。
Ⅱ.硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
(1)下列环境问题主要由硫氧化物和氮氧化物的排放引发的是__________________ 。
A.全球变暖 B.酸雨 C.水体富营养化(水华) D.白色污染
(2)SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)==CO2(g)+CaO(s) △H=+178.2 kJ·mol-1
SO2(g)+CaO(s)==CaSO3(s) △H=-402 kJ·mol-1
2CaSO3(s)+O2(g )==2CaSO4(s) △H=-234.2 kJ·mol-1
写出石灰石脱硫的热化学反应方程式_______________________________________ 。
(1)下列性质的递变顺序
A.酸性:H2SeO4 > H2SeO3 B.非金属性:O > S > Se > Te
C.还原性:H2Te > H2Se > H2S > H2O D.热稳定性:H2O > H2Te > H2Se > H2S
E.沸点:H2Te > H2Se > H2S > H2O
(2)在常温下进行的置换反应X+W→Y+V中, H2O可以扮演不同的“角色”。已知X、Y是短周期主族元素形成的单质,W、V是化合物。
①若W是水,且作还原剂,反应的化学方程式为
②若V是水,为还原产物,反应的化学方程式为
(3)已知:液态CS2完全燃烧生成CO2、SO2气体,每转移3mol电子时放出269.2kJ热量。写出表示CS2(1)的燃烧热的热化学方程式:
(4)工业上,用S02还原TeC14溶液制备碲(Te),反应中氧化产物与还原产物的物质的量之比为
Ⅱ.硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
(1)下列环境问题主要由硫氧化物和氮氧化物的排放引发的是
A.全球变暖 B.酸雨 C.水体富营养化(水华) D.白色污染
(2)SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)==CO2(g)+CaO(s) △H=+178.2 kJ·mol-1
SO2(g)+CaO(s)==CaSO3(s) △H=-402 kJ·mol-1
2CaSO3(s)+O2(g )==2CaSO4(s) △H=-234.2 kJ·mol-1
写出石灰石脱硫的热化学反应方程式
您最近一年使用:0次
解题方法
4 . 碘及其化合物在生活中应用广泛,含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列三个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH1
反应Ⅱ:HI(aq)= H2(g)+
H2(g)+ I2(aq) ΔH2
I2(aq) ΔH2
反应Ⅲ:2H2SO4(aq)=2SO2(g)+O2(g)+2H2O(l)
①反应:SO2(g)+2H2O(l)=H2SO4(aq)+H2(g)的ΔH=___ (用ΔH1、ΔH2表示)。
②分析上述反应,下列判断正确的是___
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2同时产生1molH2
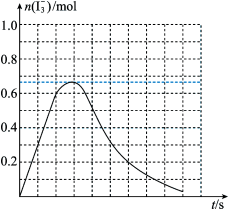
③反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq) I3-(aq),其反应速率极快且平衡常数大。现将1molSO2缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是
I3-(aq),其反应速率极快且平衡常数大。现将1molSO2缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是___ 。
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量就能将碘单质进一步氧化成碘酸根离子(IO3-),写出氯气与碘单质反应的离子方程式:___ 。
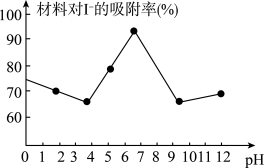
(3)科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究。如图是不同pH条件下,碘离子吸附效果的变化曲线。据此推断Ag/TiO2材料最适合吸附___ (填“酸性”“中性”或“碱性”)溶液中的I-。
(4)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s) AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=
AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=___ [用c(Cl-)、Ksp(AgCl)和Ksq(AgI)表示]。该方法去除碘离子的原理是___ 。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列三个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH1
反应Ⅱ:HI(aq)=
 H2(g)+
H2(g)+ I2(aq) ΔH2
I2(aq) ΔH2反应Ⅲ:2H2SO4(aq)=2SO2(g)+O2(g)+2H2O(l)
①反应:SO2(g)+2H2O(l)=H2SO4(aq)+H2(g)的ΔH=
②分析上述反应,下列判断正确的是
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2同时产生1molH2
③反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)
 I3-(aq),其反应速率极快且平衡常数大。现将1molSO2缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是
I3-(aq),其反应速率极快且平衡常数大。现将1molSO2缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量就能将碘单质进一步氧化成碘酸根离子(IO3-),写出氯气与碘单质反应的离子方程式:
(3)科研小组用新型材料Ag/TiO2对溶液中碘离子进行吸附研究。如图是不同pH条件下,碘离子吸附效果的变化曲线。据此推断Ag/TiO2材料最适合吸附

(4)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)
 AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=
AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)=
您最近一年使用:0次
5 . 氧、硫、硒、碲都位于元素周期表的VIA族,其化合物在化工生产中有广泛应用。
(1)下列性质的递变顺序不正确的是_____ (填字母)。
A.酸性:H2SeO4>H2SeO3 B.非金属性:O>S>Se>Te
C.还原性:H2Te>H2Se>H2S>H2O D.热稳定性:H2O>H2Te>H2Se>H2S
E.沸点: H2Te>H2Se>H2S>H2O
(2)在常温下进行的置换反应X+W→Y+V中, H2O可以扮演不同的“角色”。已知X、Y是短周期主族元素形成的单质,W、V是化合物。
①若W是水,且作还原剂,反应的化学方程式为_________ 。
②若V是水,为还原产物,反应的化学方程式为_____________ 。
(3) ①一定温度下,向恒容密闭容器中充入一定量的H2S,发生反应H2S(g) S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是
S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是_______ (填字母)。
A.混合气体的密度不再变化 B.混合气体的压强不再变化
C.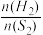 不再变化 D.H2S与H2的消耗速率相等
不再变化 D.H2S与H2的消耗速率相等
②已知:液态CS2完全燃烧生成CO2、SO2气体,每转移3mol电子时放出269.2kJ热量。写出表示CS2(1)的燃烧热的热化学方程式:______________ 。
(4) ①工业上,用S02还原TeC14溶液制备碲(Te),反应中氧化产物与还原产物的物质的量之比为____________ 。
②以石墨为电极,电解强碱性Na2TeO3溶液也可获得碲,电解过程中阴极的电极反应式为_____ ;阳极产生的气体是_____ (填化学式)。
(1)下列性质的递变顺序不正确的是
A.酸性:H2SeO4>H2SeO3 B.非金属性:O>S>Se>Te
C.还原性:H2Te>H2Se>H2S>H2O D.热稳定性:H2O>H2Te>H2Se>H2S
E.沸点: H2Te>H2Se>H2S>H2O
(2)在常温下进行的置换反应X+W→Y+V中, H2O可以扮演不同的“角色”。已知X、Y是短周期主族元素形成的单质,W、V是化合物。
①若W是水,且作还原剂,反应的化学方程式为
②若V是水,为还原产物,反应的化学方程式为
(3) ①一定温度下,向恒容密闭容器中充入一定量的H2S,发生反应H2S(g)
 S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是
S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是A.混合气体的密度不再变化 B.混合气体的压强不再变化
C.
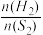 不再变化 D.H2S与H2的消耗速率相等
不再变化 D.H2S与H2的消耗速率相等②已知:液态CS2完全燃烧生成CO2、SO2气体,每转移3mol电子时放出269.2kJ热量。写出表示CS2(1)的燃烧热的热化学方程式:
(4) ①工业上,用S02还原TeC14溶液制备碲(Te),反应中氧化产物与还原产物的物质的量之比为
②以石墨为电极,电解强碱性Na2TeO3溶液也可获得碲,电解过程中阴极的电极反应式为
您最近一年使用:0次
2017-12-25更新
|
456次组卷
|
2卷引用:江西名校学术联盟(临川一中、景德镇一中、雁潭一中等)2018届高三教学质量检测考试(二)理综-化学试题
解题方法
6 . (I)A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
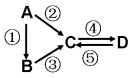
(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物。D物质常用于食品工业。写出④反应的化学方程式___________________________ 。
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式______________ 。
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式________________________ 。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式________________________ 。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式______________________________________________ 。
(II)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。已知:2SO2(g)+O2(g) 2SO3(g) ΔH =-98.3kJ·mol-1。
2SO3(g) ΔH =-98.3kJ·mol-1。
则:α1+α2=_________________ ,p=________________ mol,b+c="_______________ kJ" 。
(III)HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:A.HA+HC2-(少量)=A-+H2C- B.H2B(少量)+2A-=B2-+2HA
C.H2B(少量)+H2C-=HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是_____________ 。
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子(H+)的是_________ ,最难结合质子的是____________ 。
(3)完成下列反应的离子方程式HA(过量)+C3-:________________________________ 。
(IV)在25下,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+) = c(Cl-),则溶液显______________ (填“酸”、“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=_____________ 。

(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物。D物质常用于食品工业。写出④反应的化学方程式
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式
(II)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。已知:2SO2(g)+O2(g)
 2SO3(g) ΔH =-98.3kJ·mol-1。
2SO3(g) ΔH =-98.3kJ·mol-1。| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2 mol SO2、1 mol O2 | 2 mol SO3 | m mol SO2、n mol O2、p mol SO3 |
| c(SO3) /mol·L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |
则:α1+α2=
(III)HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:A.HA+HC2-(少量)=A-+H2C- B.H2B(少量)+2A-=B2-+2HA
C.H2B(少量)+H2C-=HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子(H+)的是
(3)完成下列反应的离子方程式HA(过量)+C3-:
(IV)在25下,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+) = c(Cl-),则溶液显
您最近一年使用:0次
解题方法
7 . 脱除工业废气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。
(1)早期是利用NH3还原法,可将NOx还原为N2进行脱除。
已知:①4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1
4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1
②N2(g)+O2(g) 2NO(g) ΔH=+180kJ·mol-1
2NO(g) ΔH=+180kJ·mol-1
③H2O(g) H2O(l) ΔH=-44kJ·mol-1
H2O(l) ΔH=-44kJ·mol-1
写出常温下,NH3还原NO反应的热化学方程式__ 。
(2)以漂粉精溶液为吸收剂可以有效脱除烟气中的NO。
①漂粉精溶液的主要成分是Ca(ClO)2,若吸收过程中,消耗的Ca(ClO)2与吸收的NO的物质的量之比为3∶4,则脱除后NO转化为__ 。
②某一兴趣小组研究不同温度下相同浓度漂粉精溶液对NO脱除率的影响,结果如图所示。图中,40~60℃NO脱除率上升可能的原因为__ ;60~80℃NO脱除率下降可能的原因为__ 。

(3)过硫酸钠(Na2S2O8)氧化去除NO
第一步:NO在碱性环境中被Na2S2O8氧化为NaNO2
第二步:NaNO2继续被氧化为NaNO3,反应为 +
+ +2OH-
+2OH-
 +2
+2 +H2O。
+H2O。
不同温度下,平衡时 的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示。
的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示。
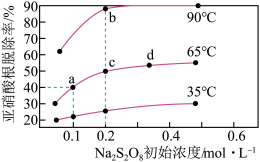
①a、b、c、d四点平衡常数K由大到小的顺序为__ ,原因是__ 。
②若a点(0.1,40%)时, 的初始浓度为amol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=
的初始浓度为amol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=__ 。(用含a的代数式表示,已知65℃时Kw=1.0×10-13)
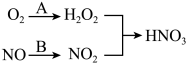
(4)利用新型材料光催化脱除NO法如图所示。
某电化学小组将过程A、B设计成酸性电解池反应,则该反应中阴极反应方程式为___ 。
(1)早期是利用NH3还原法,可将NOx还原为N2进行脱除。
已知:①4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1
4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1②N2(g)+O2(g)
 2NO(g) ΔH=+180kJ·mol-1
2NO(g) ΔH=+180kJ·mol-1③H2O(g)
 H2O(l) ΔH=-44kJ·mol-1
H2O(l) ΔH=-44kJ·mol-1写出常温下,NH3还原NO反应的热化学方程式
(2)以漂粉精溶液为吸收剂可以有效脱除烟气中的NO。
①漂粉精溶液的主要成分是Ca(ClO)2,若吸收过程中,消耗的Ca(ClO)2与吸收的NO的物质的量之比为3∶4,则脱除后NO转化为
②某一兴趣小组研究不同温度下相同浓度漂粉精溶液对NO脱除率的影响,结果如图所示。图中,40~60℃NO脱除率上升可能的原因为

(3)过硫酸钠(Na2S2O8)氧化去除NO
第一步:NO在碱性环境中被Na2S2O8氧化为NaNO2
第二步:NaNO2继续被氧化为NaNO3,反应为
 +
+ +2OH-
+2OH-
 +2
+2 +H2O。
+H2O。不同温度下,平衡时
 的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示。
的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示。
①a、b、c、d四点平衡常数K由大到小的顺序为
②若a点(0.1,40%)时,
 的初始浓度为amol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=
的初始浓度为amol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=(4)利用新型材料光催化脱除NO法如图所示。
某电化学小组将过程A、B设计成酸性电解池反应,则该反应中阴极反应方程式为

您最近一年使用:0次
8 . 甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。已知:①CO(g)+
CH3OH(g)。已知:①CO(g)+ O2(g)=CO2(g) △H1=-283.0kJ/mol
O2(g)=CO2(g) △H1=-283.0kJ/mol
②H2(g)+ O2(g)=H2O(g) △H2=-241.8kJ/mol
O2(g)=H2O(g) △H2=-241.8kJ/mol
③CH3OH(g)+ O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
回答下列问题:
(1)计算CO(g)+2H2(g) CH3OH(g)的反应热△H4=
CH3OH(g)的反应热△H4=________________ 。
(2)若在绝热、恒容的密闭容器中充入1mol CO、2mol H2,发生CO(g)+2H2(g) CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是________ (填选项字母)。
(3)T1℃时,在一个体积为5L的恒容容器中充入1mol CO、2mol H2,经过5min达到平衡,CO的转化率为0.8,则5min内用H2表示的反应速率为v(H2)=__________ 。T1℃时,CO(g)+2H2(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=______________ 。
(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:_____________________ 。
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:_________ 。
 CH3OH(g)。已知:①CO(g)+
CH3OH(g)。已知:①CO(g)+ O2(g)=CO2(g) △H1=-283.0kJ/mol
O2(g)=CO2(g) △H1=-283.0kJ/mol②H2(g)+
 O2(g)=H2O(g) △H2=-241.8kJ/mol
O2(g)=H2O(g) △H2=-241.8kJ/mol③CH3OH(g)+
 O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol回答下列问题:
(1)计算CO(g)+2H2(g)
 CH3OH(g)的反应热△H4=
CH3OH(g)的反应热△H4=(2)若在绝热、恒容的密闭容器中充入1mol CO、2mol H2,发生CO(g)+2H2(g)
 CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
(3)T1℃时,在一个体积为5L的恒容容器中充入1mol CO、2mol H2,经过5min达到平衡,CO的转化率为0.8,则5min内用H2表示的反应速率为v(H2)=
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:
您最近一年使用:0次
名校
解题方法
9 . 氮及其化合物对环境具有显著影响。
(1)已知汽车气缸中氮及其化合物发生如下反应:N2(g)+O2(g)=2NO(g)ΔH=+180kJ/mol;N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol;则2NO(g)+O2(g)=2NO2(g)ΔH=______ kJ/mol。
(2)查阅资料:2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
Ⅰ.2NO(g)⇌N2O2(g)(快)
Ⅱ.N2O2(g)+O2(g)⇌2NO2(g)(慢)
反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1_____ E2(填“>”“<”或“=”),2NO(g)+O2(g)⇌2NO2(g)的反应速率主要由反应______ (填“I”或“Ⅱ”)决定。
(3)温度为T1时,在容积为1L的恒容密闭容器中充入0.6molNO2(g),发生反应:2NO2(g)⇌2NO(g)+O2(g)△H>0,达平衡时c(O2)=0.2mol/L。
①反应的平衡常数K=______ 。
②实验测得:v正=k正•c2(NO2),v逆=k逆•c2(NO)•c(O2),k正、k逆为速率常数,仅受温度影响。当温度为T2时,反应达到平衡状态,若k正=k逆,则T1______ T2(填“>”或“<”),得出该结论的理由是______ 。
(4)NO 是水体中的主要污染物。碱性条件下,强氧化剂过硫酸钠(Na2S2O8)可脱除水体中的NO
是水体中的主要污染物。碱性条件下,强氧化剂过硫酸钠(Na2S2O8)可脱除水体中的NO ,该反应的离子方程式是
,该反应的离子方程式是_______ 。
(5)不同温度下,达到平衡时NO 的脱除率与过硫酸钠初始浓度的关系如图所示。
的脱除率与过硫酸钠初始浓度的关系如图所示。

比较a、b点的反应速率:va_____ vb(填“>”“<”或“=”)。若要提高NO 的脱除率,可以采取的措施有
的脱除率,可以采取的措施有_____ (写出一点即可)。
(1)已知汽车气缸中氮及其化合物发生如下反应:N2(g)+O2(g)=2NO(g)ΔH=+180kJ/mol;N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol;则2NO(g)+O2(g)=2NO2(g)ΔH=
(2)查阅资料:2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
Ⅰ.2NO(g)⇌N2O2(g)(快)
Ⅱ.N2O2(g)+O2(g)⇌2NO2(g)(慢)
反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1
(3)温度为T1时,在容积为1L的恒容密闭容器中充入0.6molNO2(g),发生反应:2NO2(g)⇌2NO(g)+O2(g)△H>0,达平衡时c(O2)=0.2mol/L。
①反应的平衡常数K=
②实验测得:v正=k正•c2(NO2),v逆=k逆•c2(NO)•c(O2),k正、k逆为速率常数,仅受温度影响。当温度为T2时,反应达到平衡状态,若k正=k逆,则T1
(4)NO
 是水体中的主要污染物。碱性条件下,强氧化剂过硫酸钠(Na2S2O8)可脱除水体中的NO
是水体中的主要污染物。碱性条件下,强氧化剂过硫酸钠(Na2S2O8)可脱除水体中的NO ,该反应的离子方程式是
,该反应的离子方程式是(5)不同温度下,达到平衡时NO
 的脱除率与过硫酸钠初始浓度的关系如图所示。
的脱除率与过硫酸钠初始浓度的关系如图所示。
比较a、b点的反应速率:va
 的脱除率,可以采取的措施有
的脱除率,可以采取的措施有
您最近一年使用:0次
解题方法
10 . 脱除工业废气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。
(1)早期是利用NH3还原法,可将NOx还原为N2进行脱除。
已知:①4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905.9 kJ/mol
4NO(g)+6H2O(g) △H=-905.9 kJ/mol
②N2(g)+O2(g) 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
③H2O(g) H2O(l) △H=-44 kJ/mol
H2O(l) △H=-44 kJ/mol
写出常温下,NH3还原NO反应的热化学方程式:____________ 。
(2)以漂粉精溶液为吸收剂可以有效脱除烟气中的NO。
①漂粉精溶液的主要成分是Ca(ClO)2,若吸收过程中,消耗的Ca(ClO)2与吸收的NO的物质的量之比为3:4,则脱除后NO转化为____________ 。
②某一兴趣小组研究不同温度下相同浓度漂粉精溶液对NO脱除率的影响,结果如图所示:

图中,40~60℃ NO脱除率上升可能的原因为____________ ;60~80℃ NO脱除率下降可能的原因为____________ 。
(3)过硫酸钠(Na2S2O8)氧化去除NO
第一步:NO在碱性环境中被Na2S2O8氧化为NaNO2
第二步: NaNO2继续被氧化为NaNO3,反应为NO2-+S2O82-+2OH- NO3-+2SO42-+H2O。不同温度下,平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示:
NO3-+2SO42-+H2O。不同温度下,平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示:

①a、b、c、d四点平衡常数K由大到小的顺序为____________ ,原因是____________ 。
②若a点(0.1,40%)时,NO2-的初始浓度为a mol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=____________ 。(用含a的代数式表示)
(4)利用新型材料光催化脱除NO法如图所示:

某电化小组将过程A、B设计成酸性电解池反应,则该反应中阴极反应为_______ 。
(1)早期是利用NH3还原法,可将NOx还原为N2进行脱除。
已知:①4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H=-905.9 kJ/mol
4NO(g)+6H2O(g) △H=-905.9 kJ/mol ②N2(g)+O2(g)
 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol ③H2O(g)
 H2O(l) △H=-44 kJ/mol
H2O(l) △H=-44 kJ/mol写出常温下,NH3还原NO反应的热化学方程式:
(2)以漂粉精溶液为吸收剂可以有效脱除烟气中的NO。
①漂粉精溶液的主要成分是Ca(ClO)2,若吸收过程中,消耗的Ca(ClO)2与吸收的NO的物质的量之比为3:4,则脱除后NO转化为
②某一兴趣小组研究不同温度下相同浓度漂粉精溶液对NO脱除率的影响,结果如图所示:

图中,40~60℃ NO脱除率上升可能的原因为
(3)过硫酸钠(Na2S2O8)氧化去除NO
第一步:NO在碱性环境中被Na2S2O8氧化为NaNO2
第二步: NaNO2继续被氧化为NaNO3,反应为NO2-+S2O82-+2OH-
 NO3-+2SO42-+H2O。不同温度下,平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示:
NO3-+2SO42-+H2O。不同温度下,平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示:
①a、b、c、d四点平衡常数K由大到小的顺序为
②若a点(0.1,40%)时,NO2-的初始浓度为a mol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=
(4)利用新型材料光催化脱除NO法如图所示:

某电化小组将过程A、B设计成酸性电解池反应,则该反应中阴极反应为
您最近一年使用:0次



