1 . 一定温度下,向 恒容密闭容器中充入
恒容密闭容器中充入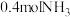 和
和 发生反应
发生反应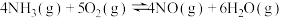 。
。 后,
后, 的浓度为
的浓度为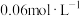 。下列有关说法正确的是
。下列有关说法正确的是
 恒容密闭容器中充入
恒容密闭容器中充入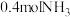 和
和 发生反应
发生反应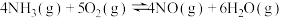 。
。 后,
后, 的浓度为
的浓度为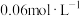 。下列有关说法正确的是
。下列有关说法正确的是A. 末,用 末,用 表示的反应速率为 表示的反应速率为 |
B. 末, 末, 的浓度为 的浓度为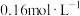 |
C. 内,生成的水的质量为 内,生成的水的质量为 |
D. 内, 内, 的物质的量减少了 的物质的量减少了 |
您最近一年使用:0次
2023-08-31更新
|
565次组卷
|
3卷引用:广西钦州市第四中学2023-2024学年高二上学期10月考试化学试卷
名校
解题方法
2 . 对于反应A(g)+3B(g)⇌2C(s)+D(g)来说,下列反应速率中最快的是
| A.v(A)=0.005 mol·L-1·s-1 | B.v(B)=0.6 mol·L-1·min-1 |
| C.v(C)=0.5 mol·L-1·min-1 | D.v(D)=0.1 mol·L-1·min-1 |
您最近一年使用:0次
2023-08-26更新
|
334次组卷
|
3卷引用:广西玉林市博白县中学2023-2024学年高二上学期第一次月考化学试题
名校
3 . 以下图像和叙述错误的是
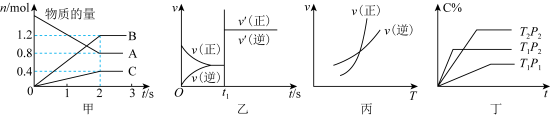
| A.图甲:该图像表示的反应方程式为2A=3B+C,反应速率v(A)=0.4mol/(L•s) |
B.图乙:某温度下发生反应: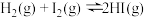 ,t1时刻改变的条件可以是加入催化剂 ,t1时刻改变的条件可以是加入催化剂 |
| C.图丙:对图中反应升高温度,该反应平衡常数增大 |
D.图丁:对于反应: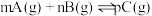 , , 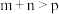 |
您最近一年使用:0次
2023-08-21更新
|
1004次组卷
|
13卷引用:广西桂林市第十一中学2023-2024学年高二上学期11月期中化学试题
广西桂林市第十一中学2023-2024学年高二上学期11月期中化学试题福建省泉州市等4校2022-2023学年高二上学期11月期中考试化学试题广东省广州市华侨中学2023-2024学年高一上学期10月月考化学试题河北省保定市定州中学2023-2024学年高二上学期9月月考化学试题重庆市万州第二高级中学教育集团2023-2024学年高二上学期10月月考化学试题湖南省邵阳市武冈市2023-2024学年高二上学期期中考试化学试题陕西省咸阳市武功县普集高级中学2023-2024学年高二上学期11月期中考试化学试题河北省石家庄市辛集市2023-2024学年高二上学期2月期末考试化学试题湖南省长长沙市德成学校2023-2024学年高二上学期11月期中考试化学试题陕西省宝鸡市扶风县法门高中2023-2024学年高二上学期期中考试化学试题山东省菏泽市郓城县第一中学2023-2024学年高二上学期第一次阶段测试化学试题新疆维吾尔自治区阿克苏地区第一中学2023-2024学年高二上学期期中考试化学试卷江西省南昌十九中2023-2024学年高二上学期期中考试化学试卷
解题方法
4 . 随原子序数的递增,八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如图所示,根据判断出的元素回答问题:

(1)e的氧化物中具有强氧化性的物质的电子式是___________ 。
(2)x、y元素形成的最简单化合物1g完全燃烧生成稳定的氧化物放出的热量是55.6kJ。该化合物完全燃烧生成稳定的氧化物的热化学方程式是___________ 。
(3)在体积是2L的密闭容器中发生反应: ,开始加入X₂物质的量是3 mol,2 min时生成
,开始加入X₂物质的量是3 mol,2 min时生成 的物质的量是1.2mol,0~2min时间段用
的物质的量是1.2mol,0~2min时间段用 表示的化学反应速率是
表示的化学反应速率是___________ 。
(4)e、g的单质在一定条件下形成的化学电池结构如图9所示。该电池的工作温度为320℃左右,电池反应为 ,负极的电极反应式为
,负极的电极反应式为___________ ,参加反应的e单质的质量是4.6g理论上电路中转移电子的物质的量是___________ 。

(5)z的最高价氧化物对应的水化物稀溶液与19.2g铜单质反应,被还原的氧化剂物质的量是___________ 。

(1)e的氧化物中具有强氧化性的物质的电子式是
(2)x、y元素形成的最简单化合物1g完全燃烧生成稳定的氧化物放出的热量是55.6kJ。该化合物完全燃烧生成稳定的氧化物的热化学方程式是
(3)在体积是2L的密闭容器中发生反应:
 ,开始加入X₂物质的量是3 mol,2 min时生成
,开始加入X₂物质的量是3 mol,2 min时生成 的物质的量是1.2mol,0~2min时间段用
的物质的量是1.2mol,0~2min时间段用 表示的化学反应速率是
表示的化学反应速率是(4)e、g的单质在一定条件下形成的化学电池结构如图9所示。该电池的工作温度为320℃左右,电池反应为
 ,负极的电极反应式为
,负极的电极反应式为
(5)z的最高价氧化物对应的水化物稀溶液与19.2g铜单质反应,被还原的氧化剂物质的量是
您最近一年使用:0次
5 . 完成下列问题
(1)向密闭容器中充入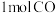 和
和 ,在一定条件下发生如下反应:
,在一定条件下发生如下反应: 。经过ts达到平衡,平衡时CO的转化率与温度、压强的关系如图所示。
。经过ts达到平衡,平衡时CO的转化率与温度、压强的关系如图所示。

请回答:
① 、
、 时,在容积为
时,在容积为 的密闭容器中发生上述反应,从开始到平衡的过程中,用
的密闭容器中发生上述反应,从开始到平衡的过程中,用 表示的平均反应速率为
表示的平均反应速率为___________ 。
②图中压强:
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(2)在压强为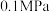 、温度为
、温度为 条件下,
条件下,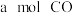 与
与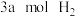 的混合气体在催化剂作用下发生反应生成甲醇:
的混合气体在催化剂作用下发生反应生成甲醇: 。
。
①平衡后将容器的容积压缩到原来的一半,其他条件不变,对平衡体系产生的影响是___________ (填字母)。
A. 减小 B.正反应速率加快,逆反应速率减慢
减小 B.正反应速率加快,逆反应速率减慢
C.反应物转化率增大 D.重新平衡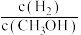 减小
减小
②若容器容积不变,下列措施可增大甲醇产率的是___________ (填字母)。
A.升高温度 B.将 从体系中分离 C.充入
从体系中分离 C.充入 ,使体系总压强增大
,使体系总压强增大
(3)一定温度下,在三个容积均为 的恒容密闭容器中发生如下反应:
的恒容密闭容器中发生如下反应: 。
。
①达到平衡时,容器Ⅱ中
___________ ,容器Ⅰ中的 的体积分数
的体积分数___________ (填“>”、“<”或“=”)容器Ⅱ中的 的体积分数。
的体积分数。
②该反应的
___________ 0(填“>”、“<”或“=”)。
(1)向密闭容器中充入
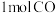 和
和 ,在一定条件下发生如下反应:
,在一定条件下发生如下反应: 。经过ts达到平衡,平衡时CO的转化率与温度、压强的关系如图所示。
。经过ts达到平衡,平衡时CO的转化率与温度、压强的关系如图所示。
请回答:
①
 、
、 时,在容积为
时,在容积为 的密闭容器中发生上述反应,从开始到平衡的过程中,用
的密闭容器中发生上述反应,从开始到平衡的过程中,用 表示的平均反应速率为
表示的平均反应速率为②图中压强:

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(2)在压强为
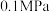 、温度为
、温度为 条件下,
条件下,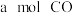 与
与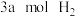 的混合气体在催化剂作用下发生反应生成甲醇:
的混合气体在催化剂作用下发生反应生成甲醇: 。
。①平衡后将容器的容积压缩到原来的一半,其他条件不变,对平衡体系产生的影响是
A.
 减小 B.正反应速率加快,逆反应速率减慢
减小 B.正反应速率加快,逆反应速率减慢C.反应物转化率增大 D.重新平衡
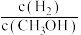 减小
减小②若容器容积不变,下列措施可增大甲醇产率的是
A.升高温度 B.将
 从体系中分离 C.充入
从体系中分离 C.充入 ,使体系总压强增大
,使体系总压强增大(3)一定温度下,在三个容积均为
 的恒容密闭容器中发生如下反应:
的恒容密闭容器中发生如下反应: 。
。| 容器编号 | 温度/℃ | 起始的物质的量/mol | 平衡的物质的量/mol | |
 |  |  | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | x | y |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |

 的体积分数
的体积分数 的体积分数。
的体积分数。②该反应的

您最近一年使用:0次
6 . 研究氮的化合物具有重要意义。
(1)已知 N2O4(g) 2NO2(g) △H>0
2NO2(g) △H>0
T1℃时若将1molN2O4气体放入1L密闭容器中,c(N2O4)随时间的变化如表所示。
①下列不能说明反应达到平衡的是________________ 填字母) 。
A.气体的压强不变 B.混合气体平均相对分子质量不变
C.容器内气体的密度不变 D.容器内颜色不变
E.相同时间,消耗n mol N2O4的同时生成2n molNO2(g)
②在0~6min时间内,化学反应速率ν(N2O4)=_________ ;T1℃时,该反应的平衡常数
K=____________ ,N2O4平衡转化率为_____________ 。
(2)在密闭容器中充入一定量的CO和NO气体,发生反应2CO(g)+2NO(g) 2CO2(g)+N2(g)△H<0, 如图为平衡时NO的体积分数与温度、压强的关系:
2CO2(g)+N2(g)△H<0, 如图为平衡时NO的体积分数与温度、压强的关系:

回答下面题目:
①温度:T1______ T2(填“>”、“<”或“=”)。
②若在D点对应容器升温,同时缩小体积使体系压强增大,重新达到的平衡状态可能是图中A~G点中的____ 点(填字母)。
(3)该反应的△S____ 0(填“>”、“<”或“=”),为提高NO的转化率,可采取的的措施有哪些?________________________ (列出2条)
(1)已知 N2O4(g)
 2NO2(g) △H>0
2NO2(g) △H>0T1℃时若将1molN2O4气体放入1L密闭容器中,c(N2O4)随时间的变化如表所示。
| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 |
| c(N2O4)/(mol•L-1) | 1 | 0.7 | 0.5 | 0.4 | 0.4 | 0.4 |
A.气体的压强不变 B.混合气体平均相对分子质量不变
C.容器内气体的密度不变 D.容器内颜色不变
E.相同时间,消耗n mol N2O4的同时生成2n molNO2(g)
②在0~6min时间内,化学反应速率ν(N2O4)=
K=
(2)在密闭容器中充入一定量的CO和NO气体,发生反应2CO(g)+2NO(g)
 2CO2(g)+N2(g)△H<0, 如图为平衡时NO的体积分数与温度、压强的关系:
2CO2(g)+N2(g)△H<0, 如图为平衡时NO的体积分数与温度、压强的关系:
回答下面题目:
①温度:T1
②若在D点对应容器升温,同时缩小体积使体系压强增大,重新达到的平衡状态可能是图中A~G点中的
(3)该反应的△S
您最近一年使用:0次
7 . 恒温密闭容器中发生反应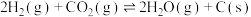 ,下列说法正确的是
,下列说法正确的是
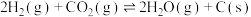 ,下列说法正确的是
,下列说法正确的是A.不同条件下,分别测得ν(H2)=1.5mol·L-1·s-1,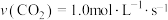 ,则前者反应速率较大 ,则前者反应速率较大 |
| B.向达到平衡后的容器中加入碳,可促使平衡向逆方向移动 |
| C.达到平衡后压缩容器体积,可促使平衡向正方向移动,逆反应速率减小 |
| D.恒容条件下达到平衡后充入水蒸气,该反应的平衡常数不变 |
您最近一年使用:0次
8 . Ⅰ.汽车是现代社会不可缺少的交通工具,利用催化技术可将汽车尾气中的CO和NO转化为CO2和N2,化学方程式为:2NO + 2CO 2CO2 + N2 。
2CO2 + N2 。
(1)某温度下,在容积不变的密闭容器中通入CO和NO,测得不同时间CO的浓度如下表:
用CO的浓度变化表示0~2s的平均反应速率为___________ mol·L﹣1·s﹣1;
(2)下列可说明该反应达到平衡状态的是___________ ;
a.CO的浓度不再改变 b.容器中混合气体密度保持不变
c.NO、CO、CO2、N2的浓度之比为2:2:2:1 d.反应消耗2mol NO同时消耗2mol N2
(3)反应物初始浓度相同时,实验温度为280℃和360℃,进行以下实验:
补全表格a___________ ,b___________ ,c___________ 。
Ⅱ.为检验上述催化技术的效果,可利用电化学气敏传感器测定汽车尾气中CO含量,原理如图。

(4)根据燃料电池的原理,推测 电极是该电池的
电极是该电池的___________ (填“正极”或“负极”), 电极上的电极反应式为
电极上的电极反应式为___________ ;若反应吸收了14g CO,则该燃料电池理论上消耗的O2的体积(在标准状况下)为___________ L。
 2CO2 + N2 。
2CO2 + N2 。(1)某温度下,在容积不变的密闭容器中通入CO和NO,测得不同时间CO的浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | …… |
| c(CO)/mol·L﹣1 | 3.60×10﹣3 | 3.05×10﹣3 | 2.85×10﹣3 | 2.75×10﹣3 | …… |
(2)下列可说明该反应达到平衡状态的是
a.CO的浓度不再改变 b.容器中混合气体密度保持不变
c.NO、CO、CO2、N2的浓度之比为2:2:2:1 d.反应消耗2mol NO同时消耗2mol N2
(3)反应物初始浓度相同时,实验温度为280℃和360℃,进行以下实验:
| 实验编号 | 实验目的 | T/℃ | 同种催化剂的比表面积m2/g | 达平衡时所用的时间/s |
| Ⅰ | 对照实验 | 280 | 80 | t1 |
| Ⅱ | a | 280 | 120 | t2 |
| Ⅲ | 研究温度对尾气转化速率的影响 | b | c | t3 |
Ⅱ.为检验上述催化技术的效果,可利用电化学气敏传感器测定汽车尾气中CO含量,原理如图。

(4)根据燃料电池的原理,推测
 电极是该电池的
电极是该电池的 电极上的电极反应式为
电极上的电极反应式为
您最近一年使用:0次
解题方法
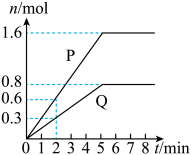
9 . 一定条件下,在体积为 的恒容密闭容器中,充入
的恒容密闭容器中,充入 气体M和
气体M和 气体N,生成气体P和固体Q,产物的物质的量随反应时间的变化图像如图,测得第
气体N,生成气体P和固体Q,产物的物质的量随反应时间的变化图像如图,测得第 时容器内剩余
时容器内剩余 气体M和
气体M和 气体N,下列说法正确的是
气体N,下列说法正确的是
 的恒容密闭容器中,充入
的恒容密闭容器中,充入 气体M和
气体M和 气体N,生成气体P和固体Q,产物的物质的量随反应时间的变化图像如图,测得第
气体N,生成气体P和固体Q,产物的物质的量随反应时间的变化图像如图,测得第 时容器内剩余
时容器内剩余 气体M和
气体M和 气体N,下列说法正确的是
气体N,下列说法正确的是
A.该反应的化学方程式为  |
B. 后,反应停止,正、逆反应速率均为0 后,反应停止,正、逆反应速率均为0 |
| C.升高反应温度,正反应速率加快,逆反应速率减慢 |
| D.该条件下气体M的最大转化率为80% |
您最近一年使用:0次
名校
解题方法
10 . 已知1,3-丁二烯与HBr加成的能量-反应进程图如图所示(图中 、
、 、
、
表示各步正向反应的焓变 )。下列说法正确的是
 、
、 、
、
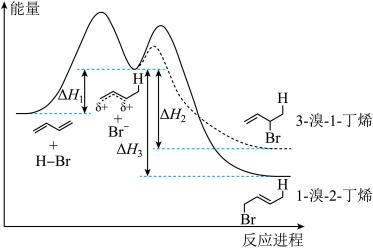
| A.反应时间越长,1,3-丁二烯与HBr反应得到3-溴-1-丁烯的比例越大 |
B.0℃、短时间t min内, 的1,3-丁二烯与HBr完全反应得到两种产物的比例为7:3(设反应前后体积不变),则生成1-溴-2-丁烯的平均速率为 的1,3-丁二烯与HBr完全反应得到两种产物的比例为7:3(设反应前后体积不变),则生成1-溴-2-丁烯的平均速率为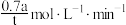 |
C.1,3-丁二烯与HBr反应,生成3-溴-1-丁烯的反应热为 、生成1-溴-2-丁烯的反应热为 、生成1-溴-2-丁烯的反应热为 |
D. 与烯烃结合的一步为决速步, 与烯烃结合的一步为决速步, 进攻时活化能小的方向得到3-溴-1-丁烯 进攻时活化能小的方向得到3-溴-1-丁烯 |
您最近一年使用:0次
2023-07-16更新
|
1743次组卷
|
4卷引用:化学02(15+4模式)2024年1月“九省联考”考前化学猜想卷



