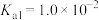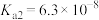1 . 分布系数的概念在分析化学中非常重要。在酸碱平衡中,分布系数指酸碱以各种形式存在的平衡浓度与其分析浓度的比值。
(1)请以H3A为例,推导出分布系数公式

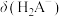
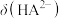
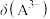
 、
、 、
、 、
、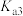 的式子表示,写出表达式即可]。
的式子表示,写出表达式即可]。(2)请用分布系数公式与电荷守恒公式,分别计算出
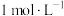 和
和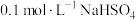 中
中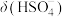 的精确值
的精确值 能否拆为H+和
能否拆为H+和
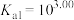 、
、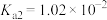 。写出计算过程)
。写出计算过程)
您最近一年使用:0次
2 . 向pH≈10的含硫废水中加入适量 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图
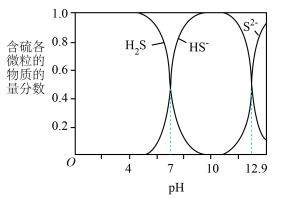
(1) 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是___________。
溶液的说法正确的是___________。
(2)pH≈10时,溶液中硫元素的主要存在形态为___________ 。
(3)用化学平衡移动原理解释向pH≈10的含硫废水中加入 溶液后pH降低的原因:
溶液后pH降低的原因:___________ 。
 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图
(1)
 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是___________。
溶液的说法正确的是___________。| A.滴加新制氯水,平衡向左移动,溶液pH减小 |
| B.加水,平衡向右移动,溶液中氢离子浓度增大 |
C.通入过量 气体,平衡向左移动,溶液pH增大 气体,平衡向左移动,溶液pH增大 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子的浓度都减小 |
(3)用化学平衡移动原理解释向pH≈10的含硫废水中加入
 溶液后pH降低的原因:
溶液后pH降低的原因:
您最近一年使用:0次
名校
解题方法
3 . 25℃时,100 mL0.1 mol·L-1的CH3COONa溶液pH为11。
(1)CH3COONa溶液呈碱性的原因是_____ (用离子方程式表示)。
(2)该溶液中水的电离度是相同温度下纯水的_____ 倍。
(3)25℃时,向0.1 mol·L-1醋酸中加入少量醋酸钠固体。当固体溶解后,推测溶液pH变化情况并说明理由。_____
(1)CH3COONa溶液呈碱性的原因是
(2)该溶液中水的电离度是相同温度下纯水的
(3)25℃时,向0.1 mol·L-1醋酸中加入少量醋酸钠固体。当固体溶解后,推测溶液pH变化情况并说明理由。
您最近一年使用:0次
名校
解题方法
4 . 化学定量计算有助于提升理解辨析能力,是科学研究过程中不可或缺的一个环节。
Ⅰ.已知常温下部分弱电解质的电离平衡常数如下表:
(1)向NaClO溶液中通入少量的 ,所发生的离子方程式为
,所发生的离子方程式为_______ 。
(2)常温下,0.1mol/L的HClO溶液和0.1molL的NaClO溶液等体积混合,判断混合溶液的酸碱性_______ (填“酸性”“碱性”“中性”)。
(3)把 溶液蒸干,灼烧,最后得到的主要固体产物是
溶液蒸干,灼烧,最后得到的主要固体产物是_______ 。
(4)常温下,在25.00mL 溶液中滴加
溶液中滴加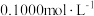 盐酸,溶液的pH变化曲线如图所示。
盐酸,溶液的pH变化曲线如图所示。

①a点溶液中
_______ ;
②b点溶液中溶质为_______ (写化学式) 。
Ⅰ.已知常温下部分弱电解质的电离平衡常数如下表:
| 化学式 |  |  |  |  |
| 电离常数 | 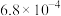 | 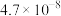 | 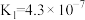 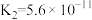 | 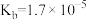 |
 ,所发生的离子方程式为
,所发生的离子方程式为(2)常温下,0.1mol/L的HClO溶液和0.1molL的NaClO溶液等体积混合,判断混合溶液的酸碱性
(3)把
 溶液蒸干,灼烧,最后得到的主要固体产物是
溶液蒸干,灼烧,最后得到的主要固体产物是(4)常温下,在25.00mL
 溶液中滴加
溶液中滴加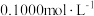 盐酸,溶液的pH变化曲线如图所示。
盐酸,溶液的pH变化曲线如图所示。
①a点溶液中

②b点溶液中溶质为
您最近一年使用:0次
5 . 草酸(H2C2O4)是常见的二元弱酸,常温下电离平衡常数Ka1=6×10-2、Ka2=2×10-4。
(1)草酸的第一步电离方程式为___________ 。
(2)下列叙述能说明草酸具有弱酸性的是___________(填标号)。
(3)0.1 mol·L-1 NaHC2O4溶液中离子浓度由大到小的顺序为___________ 。
(4)某温度下,Ksp(CaC2O4)=4×10-8,Ksp(CaCO3)=3.6×10-9。在含CaCO3和CaC2O4的悬浊液中,则溶液中
___________ 。
(5)常温下,反应NH3•H2O(aq)+HC2O (aq)
(aq) C2O
C2O (aq)+NH
(aq)+NH (aq)+H2O(l)的平衡常数K=3×105,则NH3·H2O的电离平衡常数Kb=
(aq)+H2O(l)的平衡常数K=3×105,则NH3·H2O的电离平衡常数Kb=___________ 。
(6)某实验小组利用氧化还原滴定测定草酸晶体(H2C2O4·xH2O)中x的值。实验步骤如下:准确称取m g样品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol·L-1酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。判断达到滴定终点的现象是___________ ,以下操作会造成所测x值偏高的是___________ (填标号)。
A.酸式滴定管未用标准溶液润洗
B.滴定终点读取滴定管刻度时,仰视标准液液面
C.配制标准溶液时,定容时俯视刻度线
D.在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
(1)草酸的第一步电离方程式为
(2)下列叙述能说明草酸具有弱酸性的是___________(填标号)。
| A.分别向等体积等浓度的草酸溶液和盐酸中投入大小、纯度均相同的锌粒,后者反应更剧烈 |
| B.中和等体积等浓度的草酸溶液和稀硫酸,稀硫酸消耗碱的量更多 |
| C.pH=2的草酸溶液和稀硫酸,分别稀释100倍后,前者pH更小 |
| D.将草酸晶体加入Na2CO3溶液中,有CO2放出 |
(4)某温度下,Ksp(CaC2O4)=4×10-8,Ksp(CaCO3)=3.6×10-9。在含CaCO3和CaC2O4的悬浊液中,则溶液中

(5)常温下,反应NH3•H2O(aq)+HC2O
 (aq)
(aq) C2O
C2O (aq)+NH
(aq)+NH (aq)+H2O(l)的平衡常数K=3×105,则NH3·H2O的电离平衡常数Kb=
(aq)+H2O(l)的平衡常数K=3×105,则NH3·H2O的电离平衡常数Kb=(6)某实验小组利用氧化还原滴定测定草酸晶体(H2C2O4·xH2O)中x的值。实验步骤如下:准确称取m g样品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol·L-1酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。判断达到滴定终点的现象是
A.酸式滴定管未用标准溶液润洗
B.滴定终点读取滴定管刻度时,仰视标准液液面
C.配制标准溶液时,定容时俯视刻度线
D.在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
您最近一年使用:0次
名校
6 . 25℃时,醋酸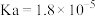 ;次氯酸
;次氯酸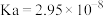 ;碳酸
;碳酸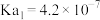 ,
,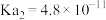 ;亚硫酸
;亚硫酸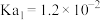 ,
,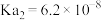 。
。
(1)写出亚硫酸的第二级电离平衡常数表达式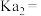
___________ 。
(2) 、
、 、
、 和
和 中结合
中结合 能力最强的是
能力最强的是___________ 。
(3)往 溶液中通入少量
溶液中通入少量 ,离子方程式为:
,离子方程式为:___________ 。
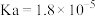 ;次氯酸
;次氯酸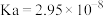 ;碳酸
;碳酸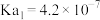 ,
,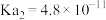 ;亚硫酸
;亚硫酸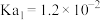 ,
,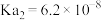 。
。(1)写出亚硫酸的第二级电离平衡常数表达式
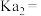
(2)
 、
、 、
、 和
和 中结合
中结合 能力最强的是
能力最强的是(3)往
 溶液中通入少量
溶液中通入少量 ,离子方程式为:
,离子方程式为:
您最近一年使用:0次
2023-06-05更新
|
245次组卷
|
2卷引用: 上海市第二中学2022-2023学年高二下学期5月阶段测试化学试题
名校
解题方法
7 . 认识和运用水溶液中的离子反应及其平衡原理,有助于指导工农业生产和科学研究。
(1)已知室温下:
①0.1mol/LNa2CO3溶液的pH_______ (填“>”“<”或“=”)0.1mol/LNa2C2O4溶液的pH。
②将等浓度H2C2O4溶液和H2CO3溶液等体积混合,溶液中各种粒子浓度顺序正确的是______ 。
A.c(H+)>c(HC2O )>c(HCO
)>c(HCO )>c(CO
)>c(CO )
)
B.c(HCO )>c(HC2O
)>c(HC2O )>c(C2O
)>c(C2O )>c(CO
)>c(CO )
)
C.c(H+)>c(HC2O )>c(C2O
)>c(C2O )>c(CO
)>c(CO )
)
D.c(H2CO3)>c(HCO )>c(HC2O
)>c(HC2O )>c(CO
)>c(CO )
)
(2)向Na2CO3溶液中滴加少量H2C2O4溶液,写出发生反应的离子方程式:______ 。
(1)已知室温下:
| 化学式 | H2CO3 | H2C2O4 |
| 电离常数 | Ka1=4.2×10-7 Ka2=4.8×10-11 | Ka1=5.6×10-2 Ka2=5.4×10-3 |
②将等浓度H2C2O4溶液和H2CO3溶液等体积混合,溶液中各种粒子浓度顺序正确的是
A.c(H+)>c(HC2O
 )>c(HCO
)>c(HCO )>c(CO
)>c(CO )
)B.c(HCO
 )>c(HC2O
)>c(HC2O )>c(C2O
)>c(C2O )>c(CO
)>c(CO )
)C.c(H+)>c(HC2O
 )>c(C2O
)>c(C2O )>c(CO
)>c(CO )
)D.c(H2CO3)>c(HCO
 )>c(HC2O
)>c(HC2O )>c(CO
)>c(CO )
)(2)向Na2CO3溶液中滴加少量H2C2O4溶液,写出发生反应的离子方程式:
您最近一年使用:0次
名校
8 . 室温下,在1mol/L的某二元酸H2A溶液中,含A元素组分的物质的量分数随pH变化的关系如图所示:

(1)写出H2A的电离方程式_______ 。
(2)根据图像可知室温下HA-的电离平衡常数的数值Ka=______ 。
(3)等物质的量浓度NaHA和Na2A溶液等体积混合,比较混合后的溶液中[Na+]、[HA-]、[A2-]的大小______ 。
(4)写出Na2A溶液中的物料守恒式______ 。

(1)写出H2A的电离方程式
(2)根据图像可知室温下HA-的电离平衡常数的数值Ka=
(3)等物质的量浓度NaHA和Na2A溶液等体积混合,比较混合后的溶液中[Na+]、[HA-]、[A2-]的大小
(4)写出Na2A溶液中的物料守恒式
您最近一年使用:0次
名校
9 . 已知298K时,几种物质的电离平衡常数(K)如下表:
(1)25℃时, 和
和 混合溶液的
混合溶液的 ,则溶液中的
,则溶液中的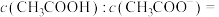
________ 。
(2) 溶液和
溶液和 溶液反应的离子方程式为
溶液反应的离子方程式为________ 。
(3)25℃时,浓度均为 的NaClO溶液和
的NaClO溶液和 溶液,二者离子总浓度
溶液,二者离子总浓度________ (填字母)。
A.前者大 B.后者大 C.相等
(4)若将 的HCl和
的HCl和 两溶液分别加水稀释,pH变化如图所示,图中a、b、c三点对应溶液的导电能力由强到弱的顺序是
两溶液分别加水稀释,pH变化如图所示,图中a、b、c三点对应溶液的导电能力由强到弱的顺序是________ 。

(5)25℃时,将 的氨水与
的氨水与 的盐酸等体积混合,反应平衡时溶液中
的盐酸等体积混合,反应平衡时溶液中 ,用含a的代数式表示
,用含a的代数式表示 的电离常数
的电离常数
________ 。
化学式 | HClO |
|
|
|
电离常数 |
|
|
|
|
 和
和 混合溶液的
混合溶液的 ,则溶液中的
,则溶液中的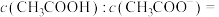
(2)
 溶液和
溶液和 溶液反应的离子方程式为
溶液反应的离子方程式为(3)25℃时,浓度均为
 的NaClO溶液和
的NaClO溶液和 溶液,二者离子总浓度
溶液,二者离子总浓度A.前者大 B.后者大 C.相等
(4)若将
 的HCl和
的HCl和 两溶液分别加水稀释,pH变化如图所示,图中a、b、c三点对应溶液的导电能力由强到弱的顺序是
两溶液分别加水稀释,pH变化如图所示,图中a、b、c三点对应溶液的导电能力由强到弱的顺序是
(5)25℃时,将
 的氨水与
的氨水与 的盐酸等体积混合,反应平衡时溶液中
的盐酸等体积混合,反应平衡时溶液中 ,用含a的代数式表示
,用含a的代数式表示 的电离常数
的电离常数
您最近一年使用:0次
名校
解题方法
10 . 在菠菜等植物中含有丰富的草酸,草酸对生命活动有重要影响。草酸的学名叫乙二酸,是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料。常温下0.01mL的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示:
(1)草酸(H2C2O4)是一种二元弱酸。写出它在水中的电离方程式:_____ 。
(2)将0.1mol/L草酸溶液中[H2C2O4]、[HC2O ]、[C2O
]、[C2O ]按照由大到小的顺序排列:
]按照由大到小的顺序排列:_____ 。
(3)在H2C2O4溶液稀释过程中,下列物理量始终增大的是_____ 。
(4)KHC2O4溶液中c(H2C2O4)_____ c(C2O )(填>、<、=,下同),若0.1mol/LH2C2O4溶液中第二步电离产生的c(H+)=amol/L,则同浓度的KHC2O4溶液中HC2O
)(填>、<、=,下同),若0.1mol/LH2C2O4溶液中第二步电离产生的c(H+)=amol/L,则同浓度的KHC2O4溶液中HC2O 电离出来的c(H+)
电离出来的c(H+)_____ amol/L
(5)写出草酸钾(K2C2O4)溶液中的电荷守恒关系式_____ ,及物料守恒关系式_____ 。
| 物质 | H2C2O4 | KHC2O4 | K2C2O4 |
| pH | 2.1 | 3.1 | 8.1 |
(2)将0.1mol/L草酸溶液中[H2C2O4]、[HC2O
 ]、[C2O
]、[C2O ]按照由大到小的顺序排列:
]按照由大到小的顺序排列:(3)在H2C2O4溶液稀释过程中,下列物理量始终增大的是
A. | B.c(H+)•c(C2O ) ) |
C.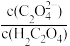 | D.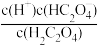 |
 )(填>、<、=,下同),若0.1mol/LH2C2O4溶液中第二步电离产生的c(H+)=amol/L,则同浓度的KHC2O4溶液中HC2O
)(填>、<、=,下同),若0.1mol/LH2C2O4溶液中第二步电离产生的c(H+)=amol/L,则同浓度的KHC2O4溶液中HC2O 电离出来的c(H+)
电离出来的c(H+)(5)写出草酸钾(K2C2O4)溶液中的电荷守恒关系式
您最近一年使用:0次