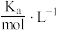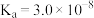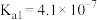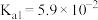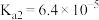1 . 氨氮废水可通过沉淀或氧化处理,使水中氨氮达到国家规定的排放标准后才可以排放。已知水溶液中氨氮的存在形式主要由pH决定。当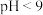 时,
时, 是主要存在形式;当
是主要存在形式;当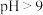 时,
时, 是主要存在形式。
是主要存在形式。
Ⅰ.沉淀法
向酸性废水中加入一定比例的 和
和 ,将氨氮转化为
,将氨氮转化为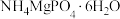 沉淀除去。已知25℃时磷酸电离平衡常数:
沉淀除去。已知25℃时磷酸电离平衡常数: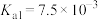 、
、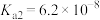 、
、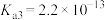 。
。
(1)写出生成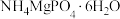 沉淀的离子方程式
沉淀的离子方程式_______ 。
(2) 溶液中:
溶液中: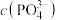
_______ 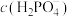 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
Ⅱ.氧化法
臭氧是一种相对安全的氧化剂,已被广泛应用于水处理中。已知臭氧很不稳定,在常温常压下即可分解为 ,在水中比在空气中更易分解。利用臭氧处理氨氮废水,实验跟踪监测
,在水中比在空气中更易分解。利用臭氧处理氨氮废水,实验跟踪监测 氧化氨氮情况如图所示,反应条件:温度10℃,初始pH不同的
氧化氨氮情况如图所示,反应条件:温度10℃,初始pH不同的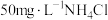 溶液(模拟氨氮废水)各250mL,
溶液(模拟氨氮废水)各250mL,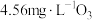 ,接触时间60min。
,接触时间60min。

(3)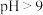 ,相同时间内氨氮去除率显著增大的可能原因是
,相同时间内氨氮去除率显著增大的可能原因是_______ 。
(4)若温度升高,相同时间内氨氮去除率降低,可能原因是_______ 。
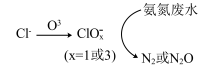
(5)在弱酸性环境下,当废水中含有大量 时,
时, 氧化氨氮废水的过程如图所示,该过程可描述为
氧化氨氮废水的过程如图所示,该过程可描述为_______ 。
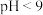 时,
时, 是主要存在形式;当
是主要存在形式;当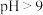 时,
时, 是主要存在形式。
是主要存在形式。Ⅰ.沉淀法
向酸性废水中加入一定比例的
 和
和 ,将氨氮转化为
,将氨氮转化为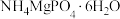 沉淀除去。已知25℃时磷酸电离平衡常数:
沉淀除去。已知25℃时磷酸电离平衡常数: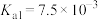 、
、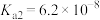 、
、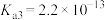 。
。(1)写出生成
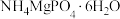 沉淀的离子方程式
沉淀的离子方程式(2)
 溶液中:
溶液中: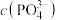
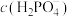 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。Ⅱ.氧化法
臭氧是一种相对安全的氧化剂,已被广泛应用于水处理中。已知臭氧很不稳定,在常温常压下即可分解为
 ,在水中比在空气中更易分解。利用臭氧处理氨氮废水,实验跟踪监测
,在水中比在空气中更易分解。利用臭氧处理氨氮废水,实验跟踪监测 氧化氨氮情况如图所示,反应条件:温度10℃,初始pH不同的
氧化氨氮情况如图所示,反应条件:温度10℃,初始pH不同的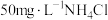 溶液(模拟氨氮废水)各250mL,
溶液(模拟氨氮废水)各250mL,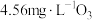 ,接触时间60min。
,接触时间60min。
(3)
 ,相同时间内氨氮去除率显著增大的可能原因是
,相同时间内氨氮去除率显著增大的可能原因是(4)若温度升高,相同时间内氨氮去除率降低,可能原因是
(5)在弱酸性环境下,当废水中含有大量
 时,
时, 氧化氨氮废水的过程如图所示,该过程可描述为
氧化氨氮废水的过程如图所示,该过程可描述为
您最近一年使用:0次
解题方法
2 . 2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。回答下列问题:
(1)醋酸钠溶液显___________ 性(填“酸”或“碱”),原因是___________ (用离子方程式解释)。
(2)已知某温度下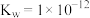 ,则该温度下
,则该温度下 的
的 溶液中,由水电离出的
溶液中,由水电离出的 为
为___________ 。
(3)常温下,某醋酸和醋酸钠的混合溶液中 ,溶液中
,溶液中 随
随 变化如图所示。
变化如图所示。

①醋酸的电离常数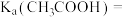
___________ , 的水解常数
的水解常数
___________ 。
②该温度下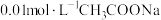 溶液的
溶液的 约为
约为___________ 。(已知 。)
。)
(1)醋酸钠溶液显
(2)已知某温度下
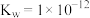 ,则该温度下
,则该温度下 的
的 溶液中,由水电离出的
溶液中,由水电离出的 为
为(3)常温下,某醋酸和醋酸钠的混合溶液中
 ,溶液中
,溶液中 随
随 变化如图所示。
变化如图所示。
①醋酸的电离常数
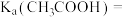
 的水解常数
的水解常数
②该温度下
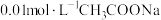 溶液的
溶液的 约为
约为 。)
。)
您最近一年使用:0次
3 . 已知,常温下,碳酸和草酸的电离常数 、
、 如下表所示:
如下表所示:
已知: 、
、
(1)常温下,在浓度均为 的四种溶液中:①
的四种溶液中:① 、②
、② 、③
、③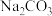 、④
、④ ,溶液中水的电离受到抑制的是
,溶液中水的电离受到抑制的是_______ (填序号,下同),溶液的 最大的是
最大的是_______ 。
(2)常温下, 草酸溶液中
草酸溶液中 、
、 、
、 的物质的量分数
的物质的量分数 随溶液
随溶液 的变化关系如图1所示[已知:
的变化关系如图1所示[已知: ],
], 或
或 与混合滂液的
与混合滂液的 的变化关系如图2所示:
的变化关系如图2所示:

①图1中的
_______ 。
②图2中直线ef纵坐标代表的是_______ [填“ ”或“
”或“ ”],其中
”],其中 点纵坐标的值为
点纵坐标的值为_______ 。
 、
、 如下表所示:
如下表所示:| 二元弱酸 |  |  |
 (简写 (简写 ) ) |  |  |
 (简写 (简写 ) ) | 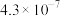 | 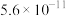 |
 、
、
(1)常温下,在浓度均为
 的四种溶液中:①
的四种溶液中:① 、②
、② 、③
、③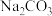 、④
、④ ,溶液中水的电离受到抑制的是
,溶液中水的电离受到抑制的是 最大的是
最大的是(2)常温下,
 草酸溶液中
草酸溶液中 、
、 、
、 的物质的量分数
的物质的量分数 随溶液
随溶液 的变化关系如图1所示[已知:
的变化关系如图1所示[已知: ],
], 或
或 与混合滂液的
与混合滂液的 的变化关系如图2所示:
的变化关系如图2所示:
①图1中的

②图2中直线ef纵坐标代表的是
 ”或“
”或“ ”],其中
”],其中 点纵坐标的值为
点纵坐标的值为
您最近一年使用:0次
4 . NaOH溶液可用于多种气体的处理。
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。已知:25℃时,Ka1(H2CO3)=5.0×10-7,Ka2(H2CO3)=5.0×10-11。
① 俗称纯碱,因
俗称纯碱,因 水解而使其水溶液呈碱性,写出
水解而使其水溶液呈碱性,写出 第一步水解的离子方程式
第一步水解的离子方程式___________ 。NaOH溶液吸收CO2得到的某溶液中。当c( ):c(
):c( )=2:1时,溶液的
)=2:1时,溶液的
___________ 。
②泡沫灭火器中通常装有NaHCO3溶液和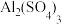 溶液,请写出这两种溶液混合时的离子反应方程式
溶液,请写出这两种溶液混合时的离子反应方程式___________ 。
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NaOH+ 2NO2= NaNO3+ NaNO2+H2O。含 的水溶液与
的水溶液与 恰好完全反应得1L溶液A,溶液B为
恰好完全反应得1L溶液A,溶液B为 溶液,则两份溶液中c(
溶液,则两份溶液中c( )、c(
)、c( )和
)和 由大到小的顺序为
由大到小的顺序为___________ (已知HNO2的电离常数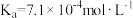 ,CH3COOH的电离常数
,CH3COOH的电离常数 。可使溶液A和溶液B的
。可使溶液A和溶液B的 相等的方法是
相等的方法是___________ (填序号)。
A.向溶液A中加适量NaOH B.向溶液A中加适量水 C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收SO2的过程中,常温下,溶液中H2SO3、 、
、 三者所占物质的量分数
三者所占物质的量分数 随
随 变化的关系如图所示:
变化的关系如图所示:

①由上图可以判断H2SO3的Ka1=___________ 。
②图中pH=7时,溶液中离子浓度关系正确的是___________ 。
A.
B.
C.
D. c(H+)=c(OH-)
c(H+)=c(OH-)
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。已知:25℃时,Ka1(H2CO3)=5.0×10-7,Ka2(H2CO3)=5.0×10-11。
①
 俗称纯碱,因
俗称纯碱,因 水解而使其水溶液呈碱性,写出
水解而使其水溶液呈碱性,写出 第一步水解的离子方程式
第一步水解的离子方程式 ):c(
):c( )=2:1时,溶液的
)=2:1时,溶液的
②泡沫灭火器中通常装有NaHCO3溶液和
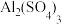 溶液,请写出这两种溶液混合时的离子反应方程式
溶液,请写出这两种溶液混合时的离子反应方程式(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NaOH+ 2NO2= NaNO3+ NaNO2+H2O。含
 的水溶液与
的水溶液与 恰好完全反应得1L溶液A,溶液B为
恰好完全反应得1L溶液A,溶液B为 溶液,则两份溶液中c(
溶液,则两份溶液中c( )、c(
)、c( )和
)和 由大到小的顺序为
由大到小的顺序为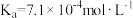 ,CH3COOH的电离常数
,CH3COOH的电离常数 。可使溶液A和溶液B的
。可使溶液A和溶液B的 相等的方法是
相等的方法是A.向溶液A中加适量NaOH B.向溶液A中加适量水 C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收SO2的过程中,常温下,溶液中H2SO3、
 、
、 三者所占物质的量分数
三者所占物质的量分数 随
随 变化的关系如图所示:
变化的关系如图所示:
①由上图可以判断H2SO3的Ka1=
②图中pH=7时,溶液中离子浓度关系正确的是
A.

B.

C.

D.
 c(H+)=c(OH-)
c(H+)=c(OH-)
您最近一年使用:0次
5 . Ⅰ.以下是生产、生活中常见的物质。按要求回答下列问题。
①冰醋酸;② ;③NaOH;④盐酸;⑤
;③NaOH;④盐酸;⑤ ;⑥熔融
;⑥熔融 ;⑦石墨;⑧酒精;⑨
;⑦石墨;⑧酒精;⑨ ;⑩
;⑩ 。
。
(1)属于强电解质的有_______ ,属于非电解质的有_______ 。(用序号填空)
(2)写出⑤溶液的电离方程式:_______ 。
(3)常温下, 的①溶液和
的①溶液和 的④溶液,加水稀释100倍,pH较大的是
的④溶液,加水稀释100倍,pH较大的是_______ 。(用序号填空)
(4)等体积的0.1 mol/L①溶液与0.1 mol/L④溶液分别与等浓度的氢氧化钠反应至中性,消耗的NaOH溶液的体积依次为 和
和 ,则
,则
_______  (填“>”、“<”或者“=”)。
(填“>”、“<”或者“=”)。
Ⅱ.已知,常温下几种酸的电离平衡常数如表:
(5)常温下,0.1 mol/L的HCN溶液中, 约为
约为_______ 。
(6)根据电离平衡常数判断,以下反应不能自发进行的是_______。
①冰醋酸;②
 ;③NaOH;④盐酸;⑤
;③NaOH;④盐酸;⑤ ;⑥熔融
;⑥熔融 ;⑦石墨;⑧酒精;⑨
;⑦石墨;⑧酒精;⑨ ;⑩
;⑩ 。
。(1)属于强电解质的有
(2)写出⑤溶液的电离方程式:
(3)常温下,
 的①溶液和
的①溶液和 的④溶液,加水稀释100倍,pH较大的是
的④溶液,加水稀释100倍,pH较大的是(4)等体积的0.1 mol/L①溶液与0.1 mol/L④溶液分别与等浓度的氢氧化钠反应至中性,消耗的NaOH溶液的体积依次为
 和
和 ,则
,则
 (填“>”、“<”或者“=”)。
(填“>”、“<”或者“=”)。Ⅱ.已知,常温下几种酸的电离平衡常数如表:
| 化学式 | HCOOH | HCN |  |
| 电离平衡常数 | 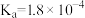 | 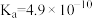 |   |
 约为
约为(6)根据电离平衡常数判断,以下反应不能自发进行的是_______。
A. |
B.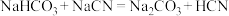 |
C.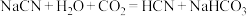 |
D. |
您最近一年使用:0次
名校
6 . 表是25℃时某些弱酸的电离平衡常数。
(1)pH相同的NaClO和 溶液,其溶液的物质的量浓度的大小关系是
溶液,其溶液的物质的量浓度的大小关系是
______ NaClO(填“ ”“
”“ ”或“
”或“ ”,下同),两溶液中:
”,下同),两溶液中:
______  。
。
(2)若
 溶液与
溶液与 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的
NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的 ,则
,则
______ 。
(3)取10mL 的
的 溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中
溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中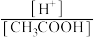 的比值将
的比值将______ (填“增大”“减小”或“无法确定”)。
(4)向碳酸钠溶液中滴加少量氯水的离子方程式______ 。
化学式 |
|
|
|
|
|
|
|
|
|
 溶液,其溶液的物质的量浓度的大小关系是
溶液,其溶液的物质的量浓度的大小关系是
 ”“
”“ ”或“
”或“ ”,下同),两溶液中:
”,下同),两溶液中:
 。
。(2)若

 溶液与
溶液与 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的
NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的 ,则
,则
(3)取10mL
 的
的 溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中
溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中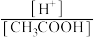 的比值将
的比值将(4)向碳酸钠溶液中滴加少量氯水的离子方程式
您最近一年使用:0次
7 .  时,三种酸的电离平衡常数如下:
时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,
_____ (填“增大”“减小”或“不变”)。
(2)用蒸馏水稀释 的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)
的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)
(3)下列能使醋酸溶液中 的电离程度增大,而电离平衡常数不变的是_____。
的电离程度增大,而电离平衡常数不变的是_____。
(4)依上表数据写出向NaClO溶液中通少量 的离子方程式:
的离子方程式:_____ 。
 时,三种酸的电离平衡常数如下:
时,三种酸的电离平衡常数如下:| 化学式 | HClO |  |  |
| 电离平衡常数 |  |  | 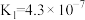 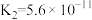 |
(1)一般情况下,当温度升高时,

(2)用蒸馏水稀释
 的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)
的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)A. | B. | C.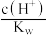 | D. |
 的电离程度增大,而电离平衡常数不变的是_____。
的电离程度增大,而电离平衡常数不变的是_____。| A.升高温度 | B.加水稀释 |
C.加少量的 固体 固体 | D.加少量氢氧化钠浓溶液 |
 的离子方程式:
的离子方程式:
您最近一年使用:0次
2023-06-24更新
|
212次组卷
|
2卷引用:广东省惠州市龙门县高级中学2021-2022学年高二下学期开学测试化学试题
名校
8 . 常温下,向100mL0.1molL-1H2S溶液中滴加0.1mol·L-1NaOH溶液。实验过程中,H2S溶液的pH与所滴加的NaOH溶液体积的关系如下图。

已知NaHS溶液显碱性,则:
(1)b点所对应的NaOH溶液体积_______ 100mL(填“大于”、“等于”或“小于”)。
(2)a、b、c、d中,水的电离程度最大的是_______ (填字母代号)。

已知NaHS溶液显碱性,则:
(1)b点所对应的NaOH溶液体积
(2)a、b、c、d中,水的电离程度最大的是
您最近一年使用:0次
9 . 分布系数的概念在分析化学中非常重要。在酸碱平衡中,分布系数指酸碱以各种形式存在的平衡浓度与其分析浓度的比值。
(1)请以H3A为例,推导出分布系数公式

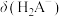
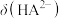
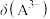
 、
、 、
、 、
、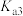 的式子表示,写出表达式即可]。
的式子表示,写出表达式即可]。(2)请用分布系数公式与电荷守恒公式,分别计算出
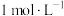 和
和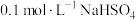 中
中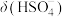 的精确值
的精确值 能否拆为H+和
能否拆为H+和
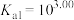 、
、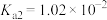 。写出计算过程)
。写出计算过程)
您最近一年使用:0次
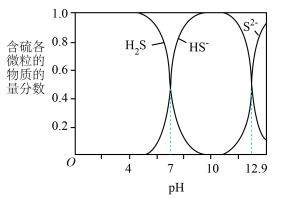
10 . 向pH≈10的含硫废水中加入适量 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图
(1) 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是___________。
溶液的说法正确的是___________。
(2)pH≈10时,溶液中硫元素的主要存在形态为___________ 。
(3)用化学平衡移动原理解释向pH≈10的含硫废水中加入 溶液后pH降低的原因:
溶液后pH降低的原因:___________ 。
 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。 、
、 、
、 在水溶液中的物质的量含物分数随pH的分布曲线如图
在水溶液中的物质的量含物分数随pH的分布曲线如图
(1)
 水溶液中存在电离平衡
水溶液中存在电离平衡 和
和 。下列关于
。下列关于 溶液的说法正确的是___________。
溶液的说法正确的是___________。| A.滴加新制氯水,平衡向左移动,溶液pH减小 |
| B.加水,平衡向右移动,溶液中氢离子浓度增大 |
C.通入过量 气体,平衡向左移动,溶液pH增大 气体,平衡向左移动,溶液pH增大 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子的浓度都减小 |
(3)用化学平衡移动原理解释向pH≈10的含硫废水中加入
 溶液后pH降低的原因:
溶液后pH降低的原因:
您最近一年使用:0次